%EC%9C%A0%EC%A0%84%EC%9E%90+%EB%84%A4%ED%8A%B8%EC%9B%8C%ED%81%AC
-
 사회처럼 건강한 유전자 커뮤니티의 모습을 찾다
구성원들 사이의 활발한 교류로 결속력이 높은 사회적 커뮤니티가 건강한 개인을 만들 듯, 유전자 커뮤니티의 결속력도 개인의 건강 상태에 영향을 미칠 수 있을까? 한국 연구진이 유전자 커뮤니티의 결속력 또한 개인의 건강 상태를 결정하고 환자 맞춤형 의료를 위해 활용될 수 있음을 보여 화제다.
우리 대학 바이오및뇌공학과 이도헌 교수 연구팀이 개인화된 유전자 네트워크에서 환자 특이적으로 결속력이 약화된 유전자 커뮤니티를 찾아내 환자 맞춤형으로 약물 표적을 예측할 수 있는 기술을 개발했다고 23일 밝혔다.
최근 고령화와 생활 습관 변화 등에 따라 암, 심혈관계 질환, 대사 질환 등 많은 복합질병의 발병률이 크게 증가하는 실정이다. 이에 전문가들은 개별 환자의 특성을 고려한 ‘환자 맞춤형 의료’를 제공해 그 치료 효과를 높임으로써 개인적, 사회적 의료비 부담을 경감해야 한다고 지적한다.
이도헌 교수 연구팀은 이러한 요구에 발맞춰 개인화된 유전자 네트워크를 정교하게 구축하고 해당 네트워크에서 각 유전자 커뮤니티의 결속력을 정확하게 측정할 수 있는 코지넷(COSINET, COmmunity COhesion Scores in Individualized gene Network Estimated from single Transcripotmics data) 기술을 개발했다.
연구진들은 수백 개의 정상 조직 유전자 발현 데이터를 근거로 유의미한 상관관계를 보이는 유전자 상호작용을 기반으로 정상 조직의 유전자 네트워크를 구축했다. 그리고 유전자 커뮤니티들의 유전자 상호작용마다 보이는 상관관계를 선형 회귀 분석을 통해 모델링한 뒤, 개별 환자의 유전자 발현량이 해당 예측 모델을 잘 따르는지를 통계적으로 분석했다. 이를 통해 환자 특이적으로 그 상호작용이 소실된 유전자 쌍을 정상 조직 유전자 네트워크에서 제거함으로써 개인화된 유전자 네트워크를 구축했다.
더 나아가 개인화된 유전자 네트워크에서 유전자들 사이의 최단 거리를 기반으로 소실된 유전자 상호작용이 각 유전자 커뮤니티 결속력 약화에 미치는 영향력을 정확하게 측정했다.
연구진들은 환자 특이적으로 그 결속력이 크게 감소한 유전자 커뮤니티를 통해 환자 특이적인 질병 기전을 설명할 수 있음을 보이고, 해당 유전자 커뮤니티에서 환자 특이적으로 결속력 약화에 크게 기여하는 유전자들을 찾아, 보다 효과적인 환자 맞춤형 약물 표적을 제안했다. 연구진들은 이러한 약물 표적 발굴 기술이 기존 기술 대비 약 4배 이상 효과적임을 증명했다.
이도헌 교수는 “여러 유전자가 관여하는 복합질병은 개별 유전자보다는 유전자들 사이의 상호작용을 고려하는 시스템적 관점에서 바라봐야 하며 현재 임상 현장에서 환자 맞춤형 의료를 위해 쓰이는 단일 유전자 기반의 바이오마커들은 복합질병의 이질성과 복잡성을 충분히 담아내기에는 한계가 있다. 따라서 이번 연구에서 개발한 개인화된 유전자 네트워크에서 유전자 커뮤니티의 결속력에 기반한 코지넷(COSINET) 기술이 복합질병의 환자 맞춤형 의료 실현을 위한 새로운 시각을 열어 줄 수 있을 것”이라고 말했다.
바이오및뇌공학과 이도헌 교수와 왕승현 박사과정이 공동으로 진행한 이번 연구는 영국 옥스퍼드대학교에서 발간하는 생명정보학 분야 최고 학술지인 `생명정보학 브리핑(Briefings in Bioinformatics)’ 2024년 5월호에 게재되고 온라인으로는 4월 15일 발표됐다.
(논문 제목: Community cohesion looseness in gene networks reveals individualized drug targets and resistance, https://academic.oup.com/bib/article/25/3/bbae175/7645997)
한편 이번 연구는 과학기술정보통신부 데이터 기반 디지털 바이오 선도 사업의 지원을 받아 수행됐다.
2024.04.23 조회수 6378
사회처럼 건강한 유전자 커뮤니티의 모습을 찾다
구성원들 사이의 활발한 교류로 결속력이 높은 사회적 커뮤니티가 건강한 개인을 만들 듯, 유전자 커뮤니티의 결속력도 개인의 건강 상태에 영향을 미칠 수 있을까? 한국 연구진이 유전자 커뮤니티의 결속력 또한 개인의 건강 상태를 결정하고 환자 맞춤형 의료를 위해 활용될 수 있음을 보여 화제다.
우리 대학 바이오및뇌공학과 이도헌 교수 연구팀이 개인화된 유전자 네트워크에서 환자 특이적으로 결속력이 약화된 유전자 커뮤니티를 찾아내 환자 맞춤형으로 약물 표적을 예측할 수 있는 기술을 개발했다고 23일 밝혔다.
최근 고령화와 생활 습관 변화 등에 따라 암, 심혈관계 질환, 대사 질환 등 많은 복합질병의 발병률이 크게 증가하는 실정이다. 이에 전문가들은 개별 환자의 특성을 고려한 ‘환자 맞춤형 의료’를 제공해 그 치료 효과를 높임으로써 개인적, 사회적 의료비 부담을 경감해야 한다고 지적한다.
이도헌 교수 연구팀은 이러한 요구에 발맞춰 개인화된 유전자 네트워크를 정교하게 구축하고 해당 네트워크에서 각 유전자 커뮤니티의 결속력을 정확하게 측정할 수 있는 코지넷(COSINET, COmmunity COhesion Scores in Individualized gene Network Estimated from single Transcripotmics data) 기술을 개발했다.
연구진들은 수백 개의 정상 조직 유전자 발현 데이터를 근거로 유의미한 상관관계를 보이는 유전자 상호작용을 기반으로 정상 조직의 유전자 네트워크를 구축했다. 그리고 유전자 커뮤니티들의 유전자 상호작용마다 보이는 상관관계를 선형 회귀 분석을 통해 모델링한 뒤, 개별 환자의 유전자 발현량이 해당 예측 모델을 잘 따르는지를 통계적으로 분석했다. 이를 통해 환자 특이적으로 그 상호작용이 소실된 유전자 쌍을 정상 조직 유전자 네트워크에서 제거함으로써 개인화된 유전자 네트워크를 구축했다.
더 나아가 개인화된 유전자 네트워크에서 유전자들 사이의 최단 거리를 기반으로 소실된 유전자 상호작용이 각 유전자 커뮤니티 결속력 약화에 미치는 영향력을 정확하게 측정했다.
연구진들은 환자 특이적으로 그 결속력이 크게 감소한 유전자 커뮤니티를 통해 환자 특이적인 질병 기전을 설명할 수 있음을 보이고, 해당 유전자 커뮤니티에서 환자 특이적으로 결속력 약화에 크게 기여하는 유전자들을 찾아, 보다 효과적인 환자 맞춤형 약물 표적을 제안했다. 연구진들은 이러한 약물 표적 발굴 기술이 기존 기술 대비 약 4배 이상 효과적임을 증명했다.
이도헌 교수는 “여러 유전자가 관여하는 복합질병은 개별 유전자보다는 유전자들 사이의 상호작용을 고려하는 시스템적 관점에서 바라봐야 하며 현재 임상 현장에서 환자 맞춤형 의료를 위해 쓰이는 단일 유전자 기반의 바이오마커들은 복합질병의 이질성과 복잡성을 충분히 담아내기에는 한계가 있다. 따라서 이번 연구에서 개발한 개인화된 유전자 네트워크에서 유전자 커뮤니티의 결속력에 기반한 코지넷(COSINET) 기술이 복합질병의 환자 맞춤형 의료 실현을 위한 새로운 시각을 열어 줄 수 있을 것”이라고 말했다.
바이오및뇌공학과 이도헌 교수와 왕승현 박사과정이 공동으로 진행한 이번 연구는 영국 옥스퍼드대학교에서 발간하는 생명정보학 분야 최고 학술지인 `생명정보학 브리핑(Briefings in Bioinformatics)’ 2024년 5월호에 게재되고 온라인으로는 4월 15일 발표됐다.
(논문 제목: Community cohesion looseness in gene networks reveals individualized drug targets and resistance, https://academic.oup.com/bib/article/25/3/bbae175/7645997)
한편 이번 연구는 과학기술정보통신부 데이터 기반 디지털 바이오 선도 사업의 지원을 받아 수행됐다.
2024.04.23 조회수 6378 -
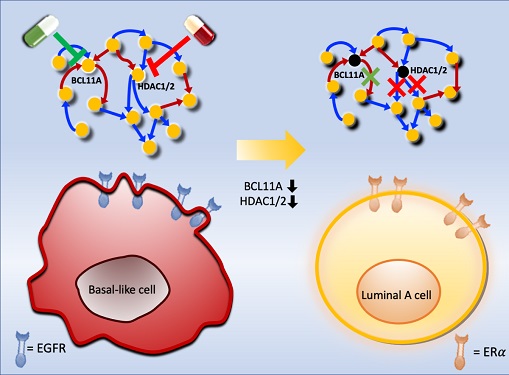 악성 유방암 세포를 치료 가능한 상태로 되돌리는 암세포 리프로그래밍 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 악성 유방암세포를 치료 가능한 상태로 되돌리는 암세포 리프로그래밍 기술을 개발하는 데 성공했다고 30일 밝혔다.
연구팀은 유방암 아류 중에서 가장 악성으로 알려진 삼중음성 유방암(basal-like 혹은 triple negative) 환자들과 호르몬 치료가 가능한 루미날-A 유방암(luminal-A) 환자들의 유전자 네트워크를 컴퓨터시뮬레이션을 통해 분석함으로써 삼중음성 유방암세포를 루미날-A 유방암세포로 변환하는데 필요한 핵심 인자를 규명했다. 그리고 이를 조절해 삼중음성 유방암세포를 루미날-A 유방암세포로 리프로그래밍한 뒤 호르몬 치료를 시행하는 새로운 치료 원리를 개발했다.
우리 대학 최새롬 박사과정, 황채영 박사, 이종훈 박사과정 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치 (Cancer Research)' 11월 30일 字 논문으로 출판됐다. (논문명: Network analysis identifies regulators of basal-like breast cancer reprogramming and endocrine therapy vulnerability)
현재 삼중음성 유방암 환자들에게 적용되는 항암 화학요법은 빠르게 분열해 전이를 일으키는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 하지만 이러한 치료는 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 심각한 부작용을 일으킨다. 또한 삼중음성 유방암세포들은 이와 같은 독성항암제에 처음부터 내성을 갖거나 새로운 내성을 획득하면서 결국 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 삼중음성 유방암에 대한 현재의 항암치료는 내성을 갖는 암세포를 없애기 위해 더 많은 정상세포의 사멸을 감수해야만 하는 큰 한계를 지니고 있다.
이를 극복하기 위해 암세포만을 특이적으로 공격하는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽이려는 공통적인 원리 때문에 근본적인 한계를 가진다.
조 교수 연구팀은 시스템생물학 연구기법을 통해 악성 유방암세포인 삼중음성 유방암세포를 호르몬 치료가 가능한 루미날-A 유방암세포로 변환시킨 뒤 치료하는 새로운 개념의 치료전략을 개발했다. 이를 위해 유전자 네트워크의 수학모델을 개발하고 대규모 컴퓨터시뮬레이션 분석과 복잡계 네트워크 제어기술을 적용한 결과 두 개의 핵심 분자 타겟인 `BCL11A'와 `HDAC1/2'를 발굴했다.
조 교수 연구팀은 BCL11A와 HDAC1/2를 억제함으로써 삼중음성 유방암세포를 효과적으로 루미날-A 유방암세포로 변환시킬 수 있음을 분자 세포실험을 통해 증명했다. 삼중음성 유방암세포에서 이 핵심 인자들을 억제했을 때 세포의 분열이 감소하고, 삼중음성 유방암세포의 주요 세포성장 신호 흐름 경로인 `EGFR'과 관련된 인자들의 활동이 감소했으며, 루미날-A 유방암세포의 주요 세포성장 신호흐름 경로인 `ERa' 신호전달 경로 인자들의 활성이 회복되는 것을 확인했다.
이번 연구에서 발굴된 분자 타겟 중 BCL11A 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 임상실험을 통해 악성 유방암세포를 치료 가능한 세포상태로 리프로그래밍 함으로써 안전하고 효과적으로 치료하는 새로운 치료기술이 실현될 수 있을 것으로 보인다. 특히 이처럼 암세포의 성질을 되돌리거나 변환하는 암세포 리프로그래밍 기반의 새로운 치료전략이 임상에서 실현된다면 현재 항암치료의 많은 부작용과 내성 발생을 근본적으로 해결함으로써 암 환자의 고통을 최소화하고 삶의 질을 크게 향상시킬 수 있을 것으로 기대된다.
조 교수는 "그동안 유방암 중에서도 가장 악성인 삼중음성 유방암은 독성이 강해 큰 부작용을 일으키는 화학 항암치료 외에는 방법이 없었으나 이를 호르몬 치료가 가능하며 덜 악성인 루미날-A 유방암세포로 리프로그래밍해 효과적으로 치료할 수 있는 새로운 가능성을 열었다ˮ라며 "이번 연구는 악성 암세포를 직접 없애려고 하기보다 치료가 수월한 세포 상태로 되돌린 뒤 치료하는 새로운 방식의 항암 치료전략을 제시했다ˮ라고 말했다.
조 교수 연구팀은 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구에 성공한 바 있으며, 이번 연구 결과는 암세포 리프로그래밍을 통한 가역화 기술 개발의 두 번째 성과다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 한국전자통신연구소 공동연구사업, KAIST Grand Challenge 30의 지원으로 수행됐다.
2021.11.30 조회수 12534
악성 유방암 세포를 치료 가능한 상태로 되돌리는 암세포 리프로그래밍 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 악성 유방암세포를 치료 가능한 상태로 되돌리는 암세포 리프로그래밍 기술을 개발하는 데 성공했다고 30일 밝혔다.
연구팀은 유방암 아류 중에서 가장 악성으로 알려진 삼중음성 유방암(basal-like 혹은 triple negative) 환자들과 호르몬 치료가 가능한 루미날-A 유방암(luminal-A) 환자들의 유전자 네트워크를 컴퓨터시뮬레이션을 통해 분석함으로써 삼중음성 유방암세포를 루미날-A 유방암세포로 변환하는데 필요한 핵심 인자를 규명했다. 그리고 이를 조절해 삼중음성 유방암세포를 루미날-A 유방암세포로 리프로그래밍한 뒤 호르몬 치료를 시행하는 새로운 치료 원리를 개발했다.
우리 대학 최새롬 박사과정, 황채영 박사, 이종훈 박사과정 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치 (Cancer Research)' 11월 30일 字 논문으로 출판됐다. (논문명: Network analysis identifies regulators of basal-like breast cancer reprogramming and endocrine therapy vulnerability)
현재 삼중음성 유방암 환자들에게 적용되는 항암 화학요법은 빠르게 분열해 전이를 일으키는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 하지만 이러한 치료는 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 심각한 부작용을 일으킨다. 또한 삼중음성 유방암세포들은 이와 같은 독성항암제에 처음부터 내성을 갖거나 새로운 내성을 획득하면서 결국 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 삼중음성 유방암에 대한 현재의 항암치료는 내성을 갖는 암세포를 없애기 위해 더 많은 정상세포의 사멸을 감수해야만 하는 큰 한계를 지니고 있다.
이를 극복하기 위해 암세포만을 특이적으로 공격하는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽이려는 공통적인 원리 때문에 근본적인 한계를 가진다.
조 교수 연구팀은 시스템생물학 연구기법을 통해 악성 유방암세포인 삼중음성 유방암세포를 호르몬 치료가 가능한 루미날-A 유방암세포로 변환시킨 뒤 치료하는 새로운 개념의 치료전략을 개발했다. 이를 위해 유전자 네트워크의 수학모델을 개발하고 대규모 컴퓨터시뮬레이션 분석과 복잡계 네트워크 제어기술을 적용한 결과 두 개의 핵심 분자 타겟인 `BCL11A'와 `HDAC1/2'를 발굴했다.
조 교수 연구팀은 BCL11A와 HDAC1/2를 억제함으로써 삼중음성 유방암세포를 효과적으로 루미날-A 유방암세포로 변환시킬 수 있음을 분자 세포실험을 통해 증명했다. 삼중음성 유방암세포에서 이 핵심 인자들을 억제했을 때 세포의 분열이 감소하고, 삼중음성 유방암세포의 주요 세포성장 신호 흐름 경로인 `EGFR'과 관련된 인자들의 활동이 감소했으며, 루미날-A 유방암세포의 주요 세포성장 신호흐름 경로인 `ERa' 신호전달 경로 인자들의 활성이 회복되는 것을 확인했다.
이번 연구에서 발굴된 분자 타겟 중 BCL11A 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 임상실험을 통해 악성 유방암세포를 치료 가능한 세포상태로 리프로그래밍 함으로써 안전하고 효과적으로 치료하는 새로운 치료기술이 실현될 수 있을 것으로 보인다. 특히 이처럼 암세포의 성질을 되돌리거나 변환하는 암세포 리프로그래밍 기반의 새로운 치료전략이 임상에서 실현된다면 현재 항암치료의 많은 부작용과 내성 발생을 근본적으로 해결함으로써 암 환자의 고통을 최소화하고 삶의 질을 크게 향상시킬 수 있을 것으로 기대된다.
조 교수는 "그동안 유방암 중에서도 가장 악성인 삼중음성 유방암은 독성이 강해 큰 부작용을 일으키는 화학 항암치료 외에는 방법이 없었으나 이를 호르몬 치료가 가능하며 덜 악성인 루미날-A 유방암세포로 리프로그래밍해 효과적으로 치료할 수 있는 새로운 가능성을 열었다ˮ라며 "이번 연구는 악성 암세포를 직접 없애려고 하기보다 치료가 수월한 세포 상태로 되돌린 뒤 치료하는 새로운 방식의 항암 치료전략을 제시했다ˮ라고 말했다.
조 교수 연구팀은 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구에 성공한 바 있으며, 이번 연구 결과는 암세포 리프로그래밍을 통한 가역화 기술 개발의 두 번째 성과다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 한국전자통신연구소 공동연구사업, KAIST Grand Challenge 30의 지원으로 수행됐다.
2021.11.30 조회수 12534 -
 조광현 교수, 대장암 유발하는 돌연변이 유전자의 네트워크 원리 규명
〈 왼쪽위부터 시계방향으로 이종훈 박사과정, 공정렬 박사과정, 조광현 교수, 신동관 연구교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암이 발병하는 과정에서 생기는 유전자 네트워크의 원리를 규명하는 데 성공했다.
이를 통해 대장암의 근본적인 발병 원리를 밝혀낼 뿐 아니라 향후 새로운 개념의 효과적인 항암제의 분자표적을 찾는데 활용될 것으로 기대된다. 또한 4차 산업혁명의 핵심 기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명해냈다는 의의를 갖는다.
신동관 박사, 이종훈, 공정렬 학생연구원 등이 함께 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 2일자 온라인 판에 게재됐다.
인간의 암은 유전자 돌연변이에 의해 발생한다. 이 돌연변이의 빈도는 암종에 따라 차이가 나는데 백혈병, 소아암은 10여 개 정도이지만 성인 고형암은 평균 50여 개, 폐암 등의 외부인자로 인한 경우는 수백 개에 이른다.
전 세계 암연구자들은 암 치료를 위해 환자들에게서 빈번하게 발견되는 유전자 돌연변이들을 파악하고 이 중 주요 암 유발 유전자를 찾아내 표적 항암제를 개발하고자 노력했다.
그러나 유전자 돌연변이는 해당 유전자의 기능에만 영향을 주는 게 아니라 그 유전자와 상호작용하는 다른 유전자에게도 영향을 끼친다. 따라서 이러한 유전자 네트워크의 원리를 모른 채 소수의 암 유발 유전자를 대상으로 하는 현재의 치료법은 일부에게만 효과가 있고 쉽게 약물의 내성을 일으키는 한계가 있다.
조 교수 연구팀은 대장암 환자의 대규모 유전체 데이터를 이용해 유전자 상호작용 네트워크에서 나타나는 다중 돌연변이의 협력적 효과에 대한 수학모형을 구축했다.
이는 국제 암유전체컨소시엄에서 발표한 전암 유전체데이터베이스(TCGA: The Cancer Genome Atlas)를 토대로 구축한 것으로, 유전자 네트워크에서 나타나는 돌연변이의 영향력을 정량화하고 이를 이용해 대장암 환자 군을 임상 특징에 따라 군집화 하는데 성공했다.
또한 대규모 컴퓨터 시뮬레이션 분석을 통해 암 발생 과정에서 나타나는 임계전이(critical transition) 현상을 밝혀내 숨겨진 유전자 네트워크의 원리를 최초로 규명했다.
임계전이란 상전이와 같이 물질의 상태가 갑작스럽게 변화하는 현상을 말한다. 암 발생 과정에서는 유전자 돌연변이의 발생 순서를 추적하기 어렵기 때문에 전이 현상이 존재하는지 확인할 수 없었다.
연구팀은 시스템생물학 기반의 연구방법을 이용해 확인한 결과 기존의 대장암에서 잘 알려진 암 유발 유전자 돌연변이의 발생 순서를 따르는 경우에 임계전이 현상을 보임을 발견했다.
이번에 개발한 수학모형을 활용하면 암환자에게 발생하는 다수 유전자 돌연변이의 영향을 가장 효과적으로 저해할 수 있는 새로운 항암 표적 약물이 개발될 것으로 기대된다.
특히 주요 암 유발 유전자 뿐 아니라 돌연변이의 영향을 받는 다른 모든 유전자들을 대상으로 종합적으로 평가해 효과적인 약물 표적을 찾아낼 수 있다.
조 교수는 “지금껏 다수 유전자들의 돌연변이가 암 발생에 어떻게 기여하는지 밝혀진 바가 없었다”며 “이번 연구에서는 시스템생물학으로 암세포의 발달과정에서 유전자 네트워크의 원리를 최초로 밝힘으로써 새로운 차원의 항암제 표적을 발굴할 수 있는 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유전자 돌연변이의 영향력 전파에 의한 거대 클러스터의 형성
그림2. 암발생 과정에서 돌연변이 협력효과의 임계전이 현상
2017.11.07 조회수 24709
조광현 교수, 대장암 유발하는 돌연변이 유전자의 네트워크 원리 규명
〈 왼쪽위부터 시계방향으로 이종훈 박사과정, 공정렬 박사과정, 조광현 교수, 신동관 연구교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암이 발병하는 과정에서 생기는 유전자 네트워크의 원리를 규명하는 데 성공했다.
이를 통해 대장암의 근본적인 발병 원리를 밝혀낼 뿐 아니라 향후 새로운 개념의 효과적인 항암제의 분자표적을 찾는데 활용될 것으로 기대된다. 또한 4차 산업혁명의 핵심 기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명해냈다는 의의를 갖는다.
신동관 박사, 이종훈, 공정렬 학생연구원 등이 함께 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 2일자 온라인 판에 게재됐다.
인간의 암은 유전자 돌연변이에 의해 발생한다. 이 돌연변이의 빈도는 암종에 따라 차이가 나는데 백혈병, 소아암은 10여 개 정도이지만 성인 고형암은 평균 50여 개, 폐암 등의 외부인자로 인한 경우는 수백 개에 이른다.
전 세계 암연구자들은 암 치료를 위해 환자들에게서 빈번하게 발견되는 유전자 돌연변이들을 파악하고 이 중 주요 암 유발 유전자를 찾아내 표적 항암제를 개발하고자 노력했다.
그러나 유전자 돌연변이는 해당 유전자의 기능에만 영향을 주는 게 아니라 그 유전자와 상호작용하는 다른 유전자에게도 영향을 끼친다. 따라서 이러한 유전자 네트워크의 원리를 모른 채 소수의 암 유발 유전자를 대상으로 하는 현재의 치료법은 일부에게만 효과가 있고 쉽게 약물의 내성을 일으키는 한계가 있다.
조 교수 연구팀은 대장암 환자의 대규모 유전체 데이터를 이용해 유전자 상호작용 네트워크에서 나타나는 다중 돌연변이의 협력적 효과에 대한 수학모형을 구축했다.
이는 국제 암유전체컨소시엄에서 발표한 전암 유전체데이터베이스(TCGA: The Cancer Genome Atlas)를 토대로 구축한 것으로, 유전자 네트워크에서 나타나는 돌연변이의 영향력을 정량화하고 이를 이용해 대장암 환자 군을 임상 특징에 따라 군집화 하는데 성공했다.
또한 대규모 컴퓨터 시뮬레이션 분석을 통해 암 발생 과정에서 나타나는 임계전이(critical transition) 현상을 밝혀내 숨겨진 유전자 네트워크의 원리를 최초로 규명했다.
임계전이란 상전이와 같이 물질의 상태가 갑작스럽게 변화하는 현상을 말한다. 암 발생 과정에서는 유전자 돌연변이의 발생 순서를 추적하기 어렵기 때문에 전이 현상이 존재하는지 확인할 수 없었다.
연구팀은 시스템생물학 기반의 연구방법을 이용해 확인한 결과 기존의 대장암에서 잘 알려진 암 유발 유전자 돌연변이의 발생 순서를 따르는 경우에 임계전이 현상을 보임을 발견했다.
이번에 개발한 수학모형을 활용하면 암환자에게 발생하는 다수 유전자 돌연변이의 영향을 가장 효과적으로 저해할 수 있는 새로운 항암 표적 약물이 개발될 것으로 기대된다.
특히 주요 암 유발 유전자 뿐 아니라 돌연변이의 영향을 받는 다른 모든 유전자들을 대상으로 종합적으로 평가해 효과적인 약물 표적을 찾아낼 수 있다.
조 교수는 “지금껏 다수 유전자들의 돌연변이가 암 발생에 어떻게 기여하는지 밝혀진 바가 없었다”며 “이번 연구에서는 시스템생물학으로 암세포의 발달과정에서 유전자 네트워크의 원리를 최초로 밝힘으로써 새로운 차원의 항암제 표적을 발굴할 수 있는 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유전자 돌연변이의 영향력 전파에 의한 거대 클러스터의 형성
그림2. 암발생 과정에서 돌연변이 협력효과의 임계전이 현상
2017.11.07 조회수 24709