%EC%9D%B8%EC%82%B0%ED%99%94
-
 수학 모델로 불안정한 수면 사이클 원인 밝혀
우리 대학 연구진이 수학적 모델을 이용해 세포질 혼잡을 유발하는 비만과 치매, 노화가 어떻게 불안정한 수면을 유발하는지를 밝히고 해결책을 제시했다.
수리과학과 김재경 교수 연구팀은 수학적 모델을 이용해 세포 내 분자 이동을 방해하는 세포질 혼잡(Cytoplasmic congestion)이 불안정한 일주기 리듬(Circadian rhythms)과 수면 사이클을 유발함을 예측하고, 미국 플로리다 주립대학 이주곤 교수 연구팀과 실험을 통해 검증하는 데 성공했다고 9일 밝혔다.
수리과학과 김대욱 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `미국국립과학원회보(PNAS)' 10월 26일 字 온라인판에 실렸다. (논문명 : Wake-sleep cycles are severely disrupted by diseases affecting cytoplasmic homeostasis)
우리 뇌 속에 있는 생체시계(Circadian clock)는 인간이 24시간 주기에 맞춰 살아갈 수 있도록 행동과 생리 작용을 조절하는 역할을 한다. 생체시계는 밤 9시경이 되면 우리 뇌 속에서 멜라토닌 호르몬의 분비를 유발해 일정 시간에 수면을 취할 수 있도록 하는 등 운동 능력이나 학습 능력에 이르기까지 거의 모든 생리 작용에 관여한다.
2017년 노벨생리의학상을 수상한 마이클 영, 제프리 홀 그리고 마이클 로스바쉬 교수는 *PER 단백질이 매일 일정한 시간에 세포핵 안으로 들어가 PER 유전자의 전사를 일정 시간에 스스로 억제하는 음성피드백 루프를 통해 24시간 주기의 리듬을 만드는 것이 생체시계의 핵심 원리임을 밝혔다.
☞ PER 단백질: 포유류의 일주기 리듬을 통제하는 핵심 생체시계 단백질이다. 세포질에서 번역(translation)된 PER 단백질은 핵 안으로 들어가 자기 자신의 DNA 전사(transcription)를 조절한다. 이로 인해 세포 내 PER 단백질의 농도는 24시간 주기로 변화한다.
하지만 다양한 물질이 존재하는 복잡한 세포 내 환경에서 어떻게 수천 개의 PER 단백질이 핵 안으로 일정한 시간에 들어갈 수 있는지는 오랫동안 생체시계 분야의 난제로 남아있었다. 이는 서울 각지에서 출발한 수천 명의 직원이 혼잡한 도로를 통과해서 매일 같은 시간에 회사에 들어갈 수 있는 방법을 찾는 것과도 같은 문제다.
김 교수 연구팀은 난제 해결을 위해 세포 내 분자의 움직임을 묘사하는 시공간적 확률론적 모형(Spatiotemporal Stochastic model)을 자체 개발했다. 또 이를 이용해 분석한 결과, PER 단백질이 세포핵 주변에서 충분히 응축돼야만 동시에 인산화돼 핵 안으로 함께 들어간다는 사실을 알아냈다.
김 교수는 "인산화 동기화 스위치 덕분에 수천 개의 PER 단백질이 일정한 시간에 함께 핵 안으로 들어가 안정적인 일주기 리듬을 만들어낼 수 있음을 확인했다ˮ고 설명했다.
김 교수팀은 또 PER 단백질의 핵 주변 응축을 방해하는 지방 액포와 같은 물질들이 세포 내에 과도하게 많아져 세포질이 혼잡해지면 인산화 스위치가 작동하지 않아 불안정한 일주기 리듬과 수면 사이클이 유발된다는 사실도 확인했다.
김재경 교수팀의 수리 모델 예측은 미국 플로리다 주립대학 이주곤 교수 팀과 협업을 통해 실험으로 검증하는 한편 한 발짝 더 나가 비만·치매·노화가 세포질 혼잡을 일으킴으로써 수면 사이클의 불안정을 가져오는 핵심 요인임을 규명하는 데도 성공했다. 세포질 혼잡 해소가 수면 질환 치료의 핵심이기 때문에 김 교수팀의 이번 연구는 수면 질환 치료의 새로운 패러다임을 제시했다는 점에서 큰 의미가 있다.
김재경 교수는 "비만과 치매, 그리고 노화가 불안정한 수면을 유발하는 원인을 수학과 생명과학의 융합 연구를 통해 밝힌 연구ˮ라고 소개하면서 "이번 성과를 통해 수면 질환의 새로운 치료법이 개발되기를 기대한다ˮ라고 말했다.
2020.11.09 조회수 40609
수학 모델로 불안정한 수면 사이클 원인 밝혀
우리 대학 연구진이 수학적 모델을 이용해 세포질 혼잡을 유발하는 비만과 치매, 노화가 어떻게 불안정한 수면을 유발하는지를 밝히고 해결책을 제시했다.
수리과학과 김재경 교수 연구팀은 수학적 모델을 이용해 세포 내 분자 이동을 방해하는 세포질 혼잡(Cytoplasmic congestion)이 불안정한 일주기 리듬(Circadian rhythms)과 수면 사이클을 유발함을 예측하고, 미국 플로리다 주립대학 이주곤 교수 연구팀과 실험을 통해 검증하는 데 성공했다고 9일 밝혔다.
수리과학과 김대욱 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `미국국립과학원회보(PNAS)' 10월 26일 字 온라인판에 실렸다. (논문명 : Wake-sleep cycles are severely disrupted by diseases affecting cytoplasmic homeostasis)
우리 뇌 속에 있는 생체시계(Circadian clock)는 인간이 24시간 주기에 맞춰 살아갈 수 있도록 행동과 생리 작용을 조절하는 역할을 한다. 생체시계는 밤 9시경이 되면 우리 뇌 속에서 멜라토닌 호르몬의 분비를 유발해 일정 시간에 수면을 취할 수 있도록 하는 등 운동 능력이나 학습 능력에 이르기까지 거의 모든 생리 작용에 관여한다.
2017년 노벨생리의학상을 수상한 마이클 영, 제프리 홀 그리고 마이클 로스바쉬 교수는 *PER 단백질이 매일 일정한 시간에 세포핵 안으로 들어가 PER 유전자의 전사를 일정 시간에 스스로 억제하는 음성피드백 루프를 통해 24시간 주기의 리듬을 만드는 것이 생체시계의 핵심 원리임을 밝혔다.
☞ PER 단백질: 포유류의 일주기 리듬을 통제하는 핵심 생체시계 단백질이다. 세포질에서 번역(translation)된 PER 단백질은 핵 안으로 들어가 자기 자신의 DNA 전사(transcription)를 조절한다. 이로 인해 세포 내 PER 단백질의 농도는 24시간 주기로 변화한다.
하지만 다양한 물질이 존재하는 복잡한 세포 내 환경에서 어떻게 수천 개의 PER 단백질이 핵 안으로 일정한 시간에 들어갈 수 있는지는 오랫동안 생체시계 분야의 난제로 남아있었다. 이는 서울 각지에서 출발한 수천 명의 직원이 혼잡한 도로를 통과해서 매일 같은 시간에 회사에 들어갈 수 있는 방법을 찾는 것과도 같은 문제다.
김 교수 연구팀은 난제 해결을 위해 세포 내 분자의 움직임을 묘사하는 시공간적 확률론적 모형(Spatiotemporal Stochastic model)을 자체 개발했다. 또 이를 이용해 분석한 결과, PER 단백질이 세포핵 주변에서 충분히 응축돼야만 동시에 인산화돼 핵 안으로 함께 들어간다는 사실을 알아냈다.
김 교수는 "인산화 동기화 스위치 덕분에 수천 개의 PER 단백질이 일정한 시간에 함께 핵 안으로 들어가 안정적인 일주기 리듬을 만들어낼 수 있음을 확인했다ˮ고 설명했다.
김 교수팀은 또 PER 단백질의 핵 주변 응축을 방해하는 지방 액포와 같은 물질들이 세포 내에 과도하게 많아져 세포질이 혼잡해지면 인산화 스위치가 작동하지 않아 불안정한 일주기 리듬과 수면 사이클이 유발된다는 사실도 확인했다.
김재경 교수팀의 수리 모델 예측은 미국 플로리다 주립대학 이주곤 교수 팀과 협업을 통해 실험으로 검증하는 한편 한 발짝 더 나가 비만·치매·노화가 세포질 혼잡을 일으킴으로써 수면 사이클의 불안정을 가져오는 핵심 요인임을 규명하는 데도 성공했다. 세포질 혼잡 해소가 수면 질환 치료의 핵심이기 때문에 김 교수팀의 이번 연구는 수면 질환 치료의 새로운 패러다임을 제시했다는 점에서 큰 의미가 있다.
김재경 교수는 "비만과 치매, 그리고 노화가 불안정한 수면을 유발하는 원인을 수학과 생명과학의 융합 연구를 통해 밝힌 연구ˮ라고 소개하면서 "이번 성과를 통해 수면 질환의 새로운 치료법이 개발되기를 기대한다ˮ라고 말했다.
2020.11.09 조회수 40609 -
 수학 통해 생체시계 유지 원리 60여년 만에 밝혀
김 재 경 교수
우리 대학 수리과학과 김재경 교수가 미분방정식을 이용한 수학적 모델링을 통해 온도 변화에도 생체시계의 속도를 유지하는 원리를 발견했다.
이번 연구는 저명 학술지 셀(Cell) 자매지 몰라큘러 셀(Molecular Cell) 10월 1일자에 게재됐다.
우리 뇌에 위치한 생체시계는 밤 9시 경이 되면 멜라토닌 분비가 시작되게 하고 아침 7시 경에 멈추게 한다. 그로 인해 우리는 매일 일정한 시간에 잠을 자고 기상할 수 있다.
생체시계는 온도가 변화해도 빨라지거나 느려지지 않고 일정한 속도가 유지된다. 따라서 우리의 체온이 변화해도 규칙적인 삶을 살 수 있고, 이는 환경에 따라 체온이 변하는 변온 동물에게도 적용된다.
이러한 생체시계의 성질은 1954년에 발견됐지만 그 원리는 밝혀지지 않아 지난 60여 년간 생체시계 분야의 가장 큰 미스테리로 남아 있었다.
김 교수는 수학 모델링을 통해 이 원리를 밝혀냈고 모델링 결과는 듀크-싱가폴 국립 의과대학 데이빗 벌쉽(David Virshup) 교수 연구팀의 실험을 통해 검증돼 60년의 난제가 풀렸다.
생체시계에는 Period2라는 핵심 단백질이 존재한다. 이 단백질은 12시간 동안 증가하고 나머지 12시간 동안 분해되는 리듬을 평생 반복한다.
김 교수는 이 Period2 분해가 두 가지 방법으로 발생하는 것을 밝혔다. 하나는 매우 빠른 속도로 분해가 일어나는 것이고 나머지 하나는 매우 느린 속도로 분해가 이뤄지는 것이다. 그리고 두 가지 방법의 비율을 조절하는 것이 Period2에 존재하는 인산화 스위치(Phosphoryltion switch)이다.
인산화 스위치의 역할은 온도가 올라갔을 때 느리게 분해되는 Period2의 양을 늘림으로써 전체적인 분해 속도가 천천히 이뤄지게 만든다. 반대로 온도가 내려갔을 때는 빠르게 분해되는 비율을 늘려 생체시계의 속도를 조절하는 것이다.
결국 생체시계 속도 유지의 핵심은 인산화 스위치이고, 다른 생화학 반응이 빨라져도 생체시계의 속도 유지를 가능하게 만드는 요소인 것이다.
이번 연구에서 밝혀진 인산화 스위치는 생체시계의 속도를 조절할 수 있는 핵심 요소가 될 전망이다. 이 인산화 스위치를 조절할 수 있는 약을 개발한다면 잦은 해외 출장으로 인한 시차, 주야 교대 근무 등에 의한 생체 시계 고장 예방 등에 기여할 수 있을 것으로 기대된다.
김 교수는 “이번 성과를 통해 우리나라에선 아직은 부족한 생물학과 수학의 교류가 활발해지길 기대한다”며 “수학이 생물학의 난제들을 해결하는데 기여할 수 있음을 알리고 싶다”고 말했다.
이번 연구는 듀크-국립 싱가폴 의과 대학 데이빗 벌쉽 (David Virshup) 교수 연구팀, 미국 미시간 대학 (University of Michigan, Ann Arbor) 데니 폴저 (Daniel Forger) 교수와의 공동연구로 진행됐다.
□ 그림 설명
그림 1 . 이번 연구에서 밝혀진 인산화 스위치와 그 과정에서 사용된 수학 방정식의 일부
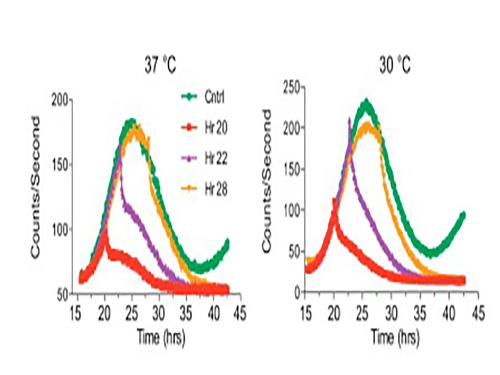
그림 2. Period2 단백질이 인산화 스위치에 의해 낮은 온도(30도) 에서 분해되는 속도가 더 빨라진다는 것을 보여주는 실험
2015.10.05 조회수 18668
수학 통해 생체시계 유지 원리 60여년 만에 밝혀
김 재 경 교수
우리 대학 수리과학과 김재경 교수가 미분방정식을 이용한 수학적 모델링을 통해 온도 변화에도 생체시계의 속도를 유지하는 원리를 발견했다.
이번 연구는 저명 학술지 셀(Cell) 자매지 몰라큘러 셀(Molecular Cell) 10월 1일자에 게재됐다.
우리 뇌에 위치한 생체시계는 밤 9시 경이 되면 멜라토닌 분비가 시작되게 하고 아침 7시 경에 멈추게 한다. 그로 인해 우리는 매일 일정한 시간에 잠을 자고 기상할 수 있다.
생체시계는 온도가 변화해도 빨라지거나 느려지지 않고 일정한 속도가 유지된다. 따라서 우리의 체온이 변화해도 규칙적인 삶을 살 수 있고, 이는 환경에 따라 체온이 변하는 변온 동물에게도 적용된다.
이러한 생체시계의 성질은 1954년에 발견됐지만 그 원리는 밝혀지지 않아 지난 60여 년간 생체시계 분야의 가장 큰 미스테리로 남아 있었다.
김 교수는 수학 모델링을 통해 이 원리를 밝혀냈고 모델링 결과는 듀크-싱가폴 국립 의과대학 데이빗 벌쉽(David Virshup) 교수 연구팀의 실험을 통해 검증돼 60년의 난제가 풀렸다.
생체시계에는 Period2라는 핵심 단백질이 존재한다. 이 단백질은 12시간 동안 증가하고 나머지 12시간 동안 분해되는 리듬을 평생 반복한다.
김 교수는 이 Period2 분해가 두 가지 방법으로 발생하는 것을 밝혔다. 하나는 매우 빠른 속도로 분해가 일어나는 것이고 나머지 하나는 매우 느린 속도로 분해가 이뤄지는 것이다. 그리고 두 가지 방법의 비율을 조절하는 것이 Period2에 존재하는 인산화 스위치(Phosphoryltion switch)이다.
인산화 스위치의 역할은 온도가 올라갔을 때 느리게 분해되는 Period2의 양을 늘림으로써 전체적인 분해 속도가 천천히 이뤄지게 만든다. 반대로 온도가 내려갔을 때는 빠르게 분해되는 비율을 늘려 생체시계의 속도를 조절하는 것이다.
결국 생체시계 속도 유지의 핵심은 인산화 스위치이고, 다른 생화학 반응이 빨라져도 생체시계의 속도 유지를 가능하게 만드는 요소인 것이다.
이번 연구에서 밝혀진 인산화 스위치는 생체시계의 속도를 조절할 수 있는 핵심 요소가 될 전망이다. 이 인산화 스위치를 조절할 수 있는 약을 개발한다면 잦은 해외 출장으로 인한 시차, 주야 교대 근무 등에 의한 생체 시계 고장 예방 등에 기여할 수 있을 것으로 기대된다.
김 교수는 “이번 성과를 통해 우리나라에선 아직은 부족한 생물학과 수학의 교류가 활발해지길 기대한다”며 “수학이 생물학의 난제들을 해결하는데 기여할 수 있음을 알리고 싶다”고 말했다.
이번 연구는 듀크-국립 싱가폴 의과 대학 데이빗 벌쉽 (David Virshup) 교수 연구팀, 미국 미시간 대학 (University of Michigan, Ann Arbor) 데니 폴저 (Daniel Forger) 교수와의 공동연구로 진행됐다.
□ 그림 설명
그림 1 . 이번 연구에서 밝혀진 인산화 스위치와 그 과정에서 사용된 수학 방정식의 일부
그림 2. Period2 단백질이 인산화 스위치에 의해 낮은 온도(30도) 에서 분해되는 속도가 더 빨라진다는 것을 보여주는 실험
2015.10.05 조회수 18668 -
 맞춤형 인산화 단백질 생합성 성공
- 사이언스誌 발표,“각종 질병원인 규명, 신약개발의 새로운 장을 열다”-
세포내 신호전달체계를 재설계하여 세균으로부터 맞춤형 인산화 단백질을 생산하는 기술이 세계 최초로 국내연구진에 의해 개발되었다.
이번 연구는 교육과학기술부의 “글로벌프론티어사업(탄소순환형 차세대 바이오매스 생산/전환 기술연구단)”의 지원을 받아 우리 학교 화학과 박희성 교수 주도로 수행되었다.
단백질 인산화는 생체 내에서 일어나는 단백질 변형의 일종으로, 세포내 신호전달과 그 결과 발생하는 세포의 생장․분열․사멸을 결정하는 중요한 역할을 한다.
예를들어, 성장세포가 성장호르몬 등 외부의 자극을 받으면 세포내 단백질에 인산이 첨가되고(단백질 인산화) 인산화된 단백질이 다른 단백질을 인산화 시키는 일련의 신호전달 과정을 거쳐 세포분열을 일으키게 된다.
인산화 과정에서 인산화 단백질에 돌연변이가 발생하면 세포의 정상적인 신호전달이 손상되고 세포의 무한 분열을 초래하여, 암을 포함한 각종 질병의 직접적인 원인이 된다.
이러한 인산화 과정은 매우 복잡하고 다이내믹하게 진행되므로, 세포내 신호전달의 극히 일부만 알려져 있고, 지금까지 단백질의 인산화를 조절할 수 없었다. 이 때문에 질병 원인 규명 연구와 신약개발에 많은 어려움을 겪고 있다.
박 교수는 예일대 Soll 교수팀과 공동연구를 통해 세균의 단백질 합성관련 인자들을 재설계하고, 진화방법으로 리모델링하여 인산화 아미노산(단백질 구성인자)을 단백질에 직접 첨가하는 기술을 개발하여 맞춤형 인산화 단백질을 생산하는데 성공했다.
연구팀은 이 기술을 이용하여 다양한 암을 유발시키는 단백질로 알려진 MEK1 인산화 단백질 합성에도 성공할 수 있었다.
박 교수는 “이번 연구를 통해서 단백질의 인산화 조절과 인산화 단백질의 대량 생산이 가능해 졌다.”며, “인산화 단백질을 통해 암을 포함한 각종 질병의 원인규명 연구와 차세대 암치료제 개발연구가 체계적이고 실질적으로 이루어질 것으로 기대된다.” 고 연구의 의의를 밝혔다.
연구결과는 생명과학분야 최고권위지인 사이언스誌 2011년 8월호 (8월26일자)에 게재됐다.
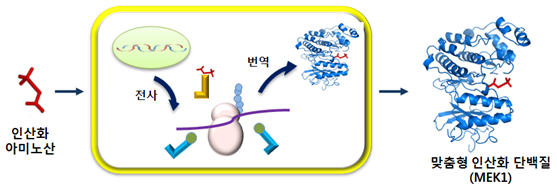
1. 세포의 단백질 생합성 기구 재설계 및 리모델링
○ 세균의 단백질 생합성 기구들(중합효소, 아미노산, tRNA)을 재설계하고, 자연계 모방 진화기술로 새로운 확장인자를 개발한 결과 얻어진 인공기능 세포의 그림이다. DNA로부터 단백질이 생합성 되는 과정이 보여주고 있으며, 특히 새롭게 설계된 단백질 합성기구와 자연계 모방 진화기술로 개발된 확장인자의 모식도가 나타나 있다.
2. 재설계된 세포를 이용한 맞춤형 인산화 단백질 생산
○ 그림1에서 제조된 재설계 인공기능 세포를 활용하여 복잡한 세포내 인산화과정 없이 인산화 아미노산을 단백질의 특정한 위치에 직접 첨가하는 방법으로 맞춤형 인산화 단백질을 생합성하는 그림이다. 세포내 신호전달에서 가장 중요한 역할을 하면서 돌연변이시 다양한 암을 유발시키는 인산화 단백질로 알려진 MEK1의 생합성을 보여주고 있다.
2011.08.26 조회수 15578
맞춤형 인산화 단백질 생합성 성공
- 사이언스誌 발표,“각종 질병원인 규명, 신약개발의 새로운 장을 열다”-
세포내 신호전달체계를 재설계하여 세균으로부터 맞춤형 인산화 단백질을 생산하는 기술이 세계 최초로 국내연구진에 의해 개발되었다.
이번 연구는 교육과학기술부의 “글로벌프론티어사업(탄소순환형 차세대 바이오매스 생산/전환 기술연구단)”의 지원을 받아 우리 학교 화학과 박희성 교수 주도로 수행되었다.
단백질 인산화는 생체 내에서 일어나는 단백질 변형의 일종으로, 세포내 신호전달과 그 결과 발생하는 세포의 생장․분열․사멸을 결정하는 중요한 역할을 한다.
예를들어, 성장세포가 성장호르몬 등 외부의 자극을 받으면 세포내 단백질에 인산이 첨가되고(단백질 인산화) 인산화된 단백질이 다른 단백질을 인산화 시키는 일련의 신호전달 과정을 거쳐 세포분열을 일으키게 된다.
인산화 과정에서 인산화 단백질에 돌연변이가 발생하면 세포의 정상적인 신호전달이 손상되고 세포의 무한 분열을 초래하여, 암을 포함한 각종 질병의 직접적인 원인이 된다.
이러한 인산화 과정은 매우 복잡하고 다이내믹하게 진행되므로, 세포내 신호전달의 극히 일부만 알려져 있고, 지금까지 단백질의 인산화를 조절할 수 없었다. 이 때문에 질병 원인 규명 연구와 신약개발에 많은 어려움을 겪고 있다.
박 교수는 예일대 Soll 교수팀과 공동연구를 통해 세균의 단백질 합성관련 인자들을 재설계하고, 진화방법으로 리모델링하여 인산화 아미노산(단백질 구성인자)을 단백질에 직접 첨가하는 기술을 개발하여 맞춤형 인산화 단백질을 생산하는데 성공했다.
연구팀은 이 기술을 이용하여 다양한 암을 유발시키는 단백질로 알려진 MEK1 인산화 단백질 합성에도 성공할 수 있었다.
박 교수는 “이번 연구를 통해서 단백질의 인산화 조절과 인산화 단백질의 대량 생산이 가능해 졌다.”며, “인산화 단백질을 통해 암을 포함한 각종 질병의 원인규명 연구와 차세대 암치료제 개발연구가 체계적이고 실질적으로 이루어질 것으로 기대된다.” 고 연구의 의의를 밝혔다.
연구결과는 생명과학분야 최고권위지인 사이언스誌 2011년 8월호 (8월26일자)에 게재됐다.
1. 세포의 단백질 생합성 기구 재설계 및 리모델링
○ 세균의 단백질 생합성 기구들(중합효소, 아미노산, tRNA)을 재설계하고, 자연계 모방 진화기술로 새로운 확장인자를 개발한 결과 얻어진 인공기능 세포의 그림이다. DNA로부터 단백질이 생합성 되는 과정이 보여주고 있으며, 특히 새롭게 설계된 단백질 합성기구와 자연계 모방 진화기술로 개발된 확장인자의 모식도가 나타나 있다.
2. 재설계된 세포를 이용한 맞춤형 인산화 단백질 생산
○ 그림1에서 제조된 재설계 인공기능 세포를 활용하여 복잡한 세포내 인산화과정 없이 인산화 아미노산을 단백질의 특정한 위치에 직접 첨가하는 방법으로 맞춤형 인산화 단백질을 생합성하는 그림이다. 세포내 신호전달에서 가장 중요한 역할을 하면서 돌연변이시 다양한 암을 유발시키는 인산화 단백질로 알려진 MEK1의 생합성을 보여주고 있다.
2011.08.26 조회수 15578 -
 홍합접착을 이용 뼈미네랄 형성 기술개발
우리학교 화학과 이해신(李海臣, 37세, 오른쪽사진), 신소재공학과 박찬범(朴燦範, 41세) 교수팀이 자연계의 홍합접착현상을 모방해 지지하는 소재에 관계없이 뼈의 미네랄성분을 고속으로 형성시킬 수 있는 원천기술개발에 성공했다. 범용성이 뛰어나 다양한 소재에 적용할 수 있다. 이 기술의 핵심은 뼈의 주요성분인 인산화칼슘 미네랄결정을 다양한 표면에서 고속 성장시키는 것이다. 뼈를 구성하는 칼슘성분의 대부분(약 99퍼센트)은 인산화칼슘으로 구성되어 있다.
기존 기술은 인산화칼슘 결정을 특정물질의 표면에서만 성장시키는 한계를 지녀왔으며, 이를 필요로 하는 인공뼈, 치아 임플란트 등 다양한 지지소재에 도입할 수 없다는 단점이 제기되어 왔다. KAIST 연구팀은 이러한 난제를 자연의 홍합접착제에서 착안하여 해결하였다. 홍합은 몸에서 내는 실 모양의 분비물인 족사를 이용해 바위, 수초표면 등에 붙어산다. 접착력이 강해 파도가 치는 해안가와 같은 다른 생물체가 살기 어려운 환경에서도 문제없이 붙어서 생존한다.
연구팀은 이러한 홍합접착제를 모방한 폴리도파민(polydopamine)이라 불리는 무독성의 화학성분을 코팅하면, 각종 금속, 산화규소, 산화철, 스테인리스, 테플론, 폴리스티렌 등과 같은 다양한 지지표면에서 인산화칼슘 결정이 손쉽게 자랄 수 있음을 입증했다. 또한 연구팀은 이번 논문에서 기존 기술로는 코팅이 불가능하였던 폴리에스터 섬유, 나일론, 셀룰로오스 등 3차원 다공성 물질 내부에도 뼈미네랄을 손쉽게 형성할 수 있음을 발견했다.
이번 연구결과는 인공뼈 재생과 같은 의료용 재료뿐만 아니라 차세대 치과용 임플란트용 표면 소재 개발과 같은 다양한 응용분야에 사용될 수 있다. 관련 연구결과는 독일에서 발간되는 재료분야 국제저명학술지인 Advanced Functional Materials지 최근호(7월 9일자 온라인판)에 인사이드 커버논문으로 게재됐으며, 최근 특허출원이 완료되었다.
KAIST 나노융합연구소, 교육과학기술부 우수연구센터 등으로부터 지원받아 수행된 이번 연구성과는 자연계를 모방하여 새로운 기능을 가진 스마트 소재를 개발하였다는 평가를 받았다.
<용어설명>
◯ 홍합모방 접착제: 홍합의 몸에서 내는 실모양의 분비물인 접착 단백질을 모방한 인공접착제◯ 족사 [足絲] : <동물>연체동물이 몸에서 내는 실 모양의 분비물. 바위 따위에 달라붙는 작용을 하며, 홍합 따위에서 볼 수 있다.
[그림] 홍합의 접착현상을 이용하여 폴리에스터 섬유에 뼈미네랄을 대량으로 형성시킨 사진 (저널표지)
2010.07.09 조회수 22237
홍합접착을 이용 뼈미네랄 형성 기술개발
우리학교 화학과 이해신(李海臣, 37세, 오른쪽사진), 신소재공학과 박찬범(朴燦範, 41세) 교수팀이 자연계의 홍합접착현상을 모방해 지지하는 소재에 관계없이 뼈의 미네랄성분을 고속으로 형성시킬 수 있는 원천기술개발에 성공했다. 범용성이 뛰어나 다양한 소재에 적용할 수 있다. 이 기술의 핵심은 뼈의 주요성분인 인산화칼슘 미네랄결정을 다양한 표면에서 고속 성장시키는 것이다. 뼈를 구성하는 칼슘성분의 대부분(약 99퍼센트)은 인산화칼슘으로 구성되어 있다.
기존 기술은 인산화칼슘 결정을 특정물질의 표면에서만 성장시키는 한계를 지녀왔으며, 이를 필요로 하는 인공뼈, 치아 임플란트 등 다양한 지지소재에 도입할 수 없다는 단점이 제기되어 왔다. KAIST 연구팀은 이러한 난제를 자연의 홍합접착제에서 착안하여 해결하였다. 홍합은 몸에서 내는 실 모양의 분비물인 족사를 이용해 바위, 수초표면 등에 붙어산다. 접착력이 강해 파도가 치는 해안가와 같은 다른 생물체가 살기 어려운 환경에서도 문제없이 붙어서 생존한다.
연구팀은 이러한 홍합접착제를 모방한 폴리도파민(polydopamine)이라 불리는 무독성의 화학성분을 코팅하면, 각종 금속, 산화규소, 산화철, 스테인리스, 테플론, 폴리스티렌 등과 같은 다양한 지지표면에서 인산화칼슘 결정이 손쉽게 자랄 수 있음을 입증했다. 또한 연구팀은 이번 논문에서 기존 기술로는 코팅이 불가능하였던 폴리에스터 섬유, 나일론, 셀룰로오스 등 3차원 다공성 물질 내부에도 뼈미네랄을 손쉽게 형성할 수 있음을 발견했다.
이번 연구결과는 인공뼈 재생과 같은 의료용 재료뿐만 아니라 차세대 치과용 임플란트용 표면 소재 개발과 같은 다양한 응용분야에 사용될 수 있다. 관련 연구결과는 독일에서 발간되는 재료분야 국제저명학술지인 Advanced Functional Materials지 최근호(7월 9일자 온라인판)에 인사이드 커버논문으로 게재됐으며, 최근 특허출원이 완료되었다.
KAIST 나노융합연구소, 교육과학기술부 우수연구센터 등으로부터 지원받아 수행된 이번 연구성과는 자연계를 모방하여 새로운 기능을 가진 스마트 소재를 개발하였다는 평가를 받았다.
<용어설명>
◯ 홍합모방 접착제: 홍합의 몸에서 내는 실모양의 분비물인 접착 단백질을 모방한 인공접착제◯ 족사 [足絲] : <동물>연체동물이 몸에서 내는 실 모양의 분비물. 바위 따위에 달라붙는 작용을 하며, 홍합 따위에서 볼 수 있다.
[그림] 홍합의 접착현상을 이용하여 폴리에스터 섬유에 뼈미네랄을 대량으로 형성시킨 사진 (저널표지)
2010.07.09 조회수 22237