%EC%A4%84%EA%B8%B0%EC%84%B8%ED%8F%AC
-
 인간 장 줄기세포 대량 배양, 재생 치료 길 열렸다
우리 연구진이 세계 최초로 화학적으로 규명되고 동물 성분이 완전히 배제된 완전 무이종 (xenogeneic-free) 환경에서 인간 장 줄기세포를 대량 배양하여 줄기세포 치료제로의 임상 적용 가능성을 입증하는데 성공했다. 이번 성과로 향후 환자 맞춤형 줄기세포를 활용한 첨단 재생 치료에 적용 이 가능할 것으로 기대된다.
우리 대학 생명화학공학과 임성갑 교수 연구팀이 한국생명공학연구원(기관장 김장성) 국가아젠다연구부 손미영 박사 연구팀과 공동 연구를 통해, 무이종(xenogeneic-free) 인간 장 줄기세포 재생 치료 플랫폼을 개발했다고 12일 밝혔다.
연구팀은 기존에 사용되던 쥐 섬유아세포, 매트리젤 코팅 없이, 기상 증착된 유기 고분자를 활용한 혁신적인 배양 및 재생 치료 플랫폼을 개발했다.
고분자 스크리닝을 통해 장 줄기세포를 동물 유래 물질 없이 배양하기에 최적인 ‘XF-DISC’ 표면을 발굴했으며, 개발된 XF-DISC는 장 줄기세포의 장기배양, 대량 배양, 동결 보관 시스템에 성공적으로 적용 가능함을 입증했다.
이 플랫폼에서 배양된 장 줄기세포는 분화 모델로 확장 가능할 뿐만 아니라, 생체 내 이식 (in vivo) 실험에 적용되어 장 상피 손상 및 염증성 모델의 쥐 대장에 성공적으로 이식되었다.
이식 이후, 인간 장 줄기세포는 쥐의 대장 조직과 효과적으로 융합되었고, 손상 부위를 재생하고 염증 반응을 완화하는데 탁월한 성능을 보였다.
특히, 사람의 세포가 동물 모델에 이종이식(xenogaft) 된 후에도 기능을 유지하고 조직 재생 효과를 발휘한 것은, 이 플랫폼이 줄기세포 치료제로서의 실질적인 임상 적용 가능성을 입증한 중요한 사례로 평가받고 있다.
이번 연구는 재생 의학 분야에서 인간 만능줄기세포(hPSC)로부터 유도된 장 줄기세포의 신뢰성 있는 대량 배양과 임상 적용 가능성을 한 단계 높일 것으로 기대된다.
향후 연구는 이 플랫폼의 상용화 가능성과 대규모 생산성을 평가하고, 환자 유래 줄기세포에 대한 적용성을 검토할 계획이다. 또한, 환자 유래 장 줄기세포가 무이종 환경에서 성공적으로 배양될 경우, 실제 환자를 대상으로 한 임상 효과를 검증하는 후속 연구가 진행될 예정이다.
임성갑 교수는 “이번 연구성과는 기존 줄기세포 배양 방식을 넘어, 동물 유래 성분을 완전히 배제한 혁신적인 무이종 배양 플랫폼을 개발한 중요한 전환점이다. 특히, 인간 장 줄기세포의 대량 배양, 장기배양 및 이식 가능성을 세계 최초로 입증함으로써 줄기세포 치료제의 신뢰성과 생산성을 획기적으로 향상시켰다. 이는 재생 의학 분야에서 중요한 진전을 의미하며, 향후 연구는 이 플랫폼의 상용화 가능성과 환자 맞춤형 임상 성능을 평가하는 데 집중될 것이다.”라고 말했다.
이번 연구 결과는 우리 대학 박성현 박사과정생, 한국생명공학연구원 권오만 박사, 이하나 박사가 제1 저자로 참여했으며, 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’지에 12월 2일 자 온라인에 게재됐다.
(논문명: Xenogeneic-free culture of human intestinal stem cells on functional polymer-coated substrates for scalable, clinical-grade stem cell therapy)
한편 과학산업통상자원부, 한국연구재단, 한국과학기술정보통신부, 한국보건복지부, 한국생명공학연구원의 지원을 받아 수행됐다.
2024.12.15 조회수 5184
인간 장 줄기세포 대량 배양, 재생 치료 길 열렸다
우리 연구진이 세계 최초로 화학적으로 규명되고 동물 성분이 완전히 배제된 완전 무이종 (xenogeneic-free) 환경에서 인간 장 줄기세포를 대량 배양하여 줄기세포 치료제로의 임상 적용 가능성을 입증하는데 성공했다. 이번 성과로 향후 환자 맞춤형 줄기세포를 활용한 첨단 재생 치료에 적용 이 가능할 것으로 기대된다.
우리 대학 생명화학공학과 임성갑 교수 연구팀이 한국생명공학연구원(기관장 김장성) 국가아젠다연구부 손미영 박사 연구팀과 공동 연구를 통해, 무이종(xenogeneic-free) 인간 장 줄기세포 재생 치료 플랫폼을 개발했다고 12일 밝혔다.
연구팀은 기존에 사용되던 쥐 섬유아세포, 매트리젤 코팅 없이, 기상 증착된 유기 고분자를 활용한 혁신적인 배양 및 재생 치료 플랫폼을 개발했다.
고분자 스크리닝을 통해 장 줄기세포를 동물 유래 물질 없이 배양하기에 최적인 ‘XF-DISC’ 표면을 발굴했으며, 개발된 XF-DISC는 장 줄기세포의 장기배양, 대량 배양, 동결 보관 시스템에 성공적으로 적용 가능함을 입증했다.
이 플랫폼에서 배양된 장 줄기세포는 분화 모델로 확장 가능할 뿐만 아니라, 생체 내 이식 (in vivo) 실험에 적용되어 장 상피 손상 및 염증성 모델의 쥐 대장에 성공적으로 이식되었다.
이식 이후, 인간 장 줄기세포는 쥐의 대장 조직과 효과적으로 융합되었고, 손상 부위를 재생하고 염증 반응을 완화하는데 탁월한 성능을 보였다.
특히, 사람의 세포가 동물 모델에 이종이식(xenogaft) 된 후에도 기능을 유지하고 조직 재생 효과를 발휘한 것은, 이 플랫폼이 줄기세포 치료제로서의 실질적인 임상 적용 가능성을 입증한 중요한 사례로 평가받고 있다.
이번 연구는 재생 의학 분야에서 인간 만능줄기세포(hPSC)로부터 유도된 장 줄기세포의 신뢰성 있는 대량 배양과 임상 적용 가능성을 한 단계 높일 것으로 기대된다.
향후 연구는 이 플랫폼의 상용화 가능성과 대규모 생산성을 평가하고, 환자 유래 줄기세포에 대한 적용성을 검토할 계획이다. 또한, 환자 유래 장 줄기세포가 무이종 환경에서 성공적으로 배양될 경우, 실제 환자를 대상으로 한 임상 효과를 검증하는 후속 연구가 진행될 예정이다.
임성갑 교수는 “이번 연구성과는 기존 줄기세포 배양 방식을 넘어, 동물 유래 성분을 완전히 배제한 혁신적인 무이종 배양 플랫폼을 개발한 중요한 전환점이다. 특히, 인간 장 줄기세포의 대량 배양, 장기배양 및 이식 가능성을 세계 최초로 입증함으로써 줄기세포 치료제의 신뢰성과 생산성을 획기적으로 향상시켰다. 이는 재생 의학 분야에서 중요한 진전을 의미하며, 향후 연구는 이 플랫폼의 상용화 가능성과 환자 맞춤형 임상 성능을 평가하는 데 집중될 것이다.”라고 말했다.
이번 연구 결과는 우리 대학 박성현 박사과정생, 한국생명공학연구원 권오만 박사, 이하나 박사가 제1 저자로 참여했으며, 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’지에 12월 2일 자 온라인에 게재됐다.
(논문명: Xenogeneic-free culture of human intestinal stem cells on functional polymer-coated substrates for scalable, clinical-grade stem cell therapy)
한편 과학산업통상자원부, 한국연구재단, 한국과학기술정보통신부, 한국보건복지부, 한국생명공학연구원의 지원을 받아 수행됐다.
2024.12.15 조회수 5184 -
 신개념 제노-프리 줄기세포 배양 플랫폼 개발
세포치료제로 이용하는 줄기세포 배양은 그동안 동물 병원체의 전파 위험이 있고, 생산공정 간 변동성이 큰 동물 유래 물질에 크게 의존해 왔다. 한국 연구진이 동물 유래 성분을 완전히 배제한 신개념 줄기세포 배양 플랫폼을 개발하고 특히 인간 유도만능줄기세포(hiPSC)의 장기 배양이 가능함을 세계 최초로 입증하여 화제다.
우리 대학 생명화학공학과 임성갑 교수 연구팀이 한국생명공학연구원(원장 김장성) 줄기세포융합연구센터 손미영 박사 연구팀과 공동 연구를 통해 화학적으로 합성된 동물 유래 물질을 완전히 배제한 (xeno-free, 이하 제노-프리) 인간 전분화능 줄기세포 배양 플랫폼을 개발했다고 31일 밝혔다.
인간 배아줄기세포(hESC)와 인간 유도만능줄기세포(hiPSC)의 배양은 마우스 섬유아세포와 매트리젤과 같은 동물 유래 성분에 크게 의존함에 따라 줄기세포 기반 치료법의 임상적 적용에서 법적, 윤리적 문제를 야기하며 줄기세포 치료제의 안전성과 효율성을 크게 제한했다.
연구팀은 이런 문제 해결을 위해 합성 고분자 스크리닝/최적화를 진행한 후 배양 기판에 코팅해 인간 전분화능 줄기세포에 장기적으로 안정적인 부착 기반을 제공할 수 있는 줄기세포 배양 플랫폼을 개발했다.
개발된 플랫폼에서 장기 배양 이후 줄기세포 성능 검증하기 위해, 해당 플랫폼에서 장기 배양된 인간 배아줄기세포와 인간 유도만능줄기세포의 성능을 확인한 결과, 기존의 표준 줄기세포 배양 코팅제인 매트리젤과 비교해 성능 손실 없이 안정적으로 배양됨을 입증했다. 이는 세계 최초로 인간 유도만능줄기세포를 동물 유래물질 배제 환경(제노-프리)에서 10회 이상 장기 계대 배양할 수 있음을 입증한 사례다.
특히 이번 연구에서 사용된 개발된 플랫폼은 매트리젤에서 배양한 세포와 비교해 세포의 분화, 자가 재생 및 줄기세포 특성 유지에 관여하는 핵심 단백질들의 발현이 변화 없이 유지됨을 확인했으며, 이는 줄기세포 치료제의 안정성과 일관성을 높이는 중요한 진전으로 평가된다.
생명화학공학과 임성갑 교수는 “이번 연구는 기존 줄기세포 배양 방식에서 벗어나 동물 유래 성분을 완전히 배제한 새로운 제노-프리 배양 플랫폼을 개발한 것으로, 특히 인간 유도만능줄기세포(hiPSC)의 장기 배양이 가능함을 세계 최초로 입증했다. 이번 연구는 줄기세포 치료제 상용화를 위한 원천 기술로 활용될 수 있을 것으로 기대되며 향후 개발된 플랫폼의 상용화 및 대규모 생산 가능하도록 후속 연구를 진행할 예정이다 ”라고 말했다.
이번 연구 결과는 조영학 박사(한국과학기술연구원), 이하나 박사(한국생명공학연구원), 정원지 학생(KAIST)이 제1 저자로 참여했으며, 국제 학술지 ‘어드벤스드 머티리얼스 (Advanced Materials)’지에 7월 17일 자 온라인 판에 게재됐다. (논문명: Long-Term Culture of Human Pluripotent Stem Cells in Xeno-Free Condition Using Functional Polymer Films)
한편, 이번 연구는 산업부 바이오산업핵심기술개발사업, 한국연구재단, 과기부 Korea Bio Grand Challenge 사업, 범부처 재생의료기술개발사업, 한국생명공학연구원 주요 사업의 지원을 받아 수행됐다.
2024.07.31 조회수 6293
신개념 제노-프리 줄기세포 배양 플랫폼 개발
세포치료제로 이용하는 줄기세포 배양은 그동안 동물 병원체의 전파 위험이 있고, 생산공정 간 변동성이 큰 동물 유래 물질에 크게 의존해 왔다. 한국 연구진이 동물 유래 성분을 완전히 배제한 신개념 줄기세포 배양 플랫폼을 개발하고 특히 인간 유도만능줄기세포(hiPSC)의 장기 배양이 가능함을 세계 최초로 입증하여 화제다.
우리 대학 생명화학공학과 임성갑 교수 연구팀이 한국생명공학연구원(원장 김장성) 줄기세포융합연구센터 손미영 박사 연구팀과 공동 연구를 통해 화학적으로 합성된 동물 유래 물질을 완전히 배제한 (xeno-free, 이하 제노-프리) 인간 전분화능 줄기세포 배양 플랫폼을 개발했다고 31일 밝혔다.
인간 배아줄기세포(hESC)와 인간 유도만능줄기세포(hiPSC)의 배양은 마우스 섬유아세포와 매트리젤과 같은 동물 유래 성분에 크게 의존함에 따라 줄기세포 기반 치료법의 임상적 적용에서 법적, 윤리적 문제를 야기하며 줄기세포 치료제의 안전성과 효율성을 크게 제한했다.
연구팀은 이런 문제 해결을 위해 합성 고분자 스크리닝/최적화를 진행한 후 배양 기판에 코팅해 인간 전분화능 줄기세포에 장기적으로 안정적인 부착 기반을 제공할 수 있는 줄기세포 배양 플랫폼을 개발했다.
개발된 플랫폼에서 장기 배양 이후 줄기세포 성능 검증하기 위해, 해당 플랫폼에서 장기 배양된 인간 배아줄기세포와 인간 유도만능줄기세포의 성능을 확인한 결과, 기존의 표준 줄기세포 배양 코팅제인 매트리젤과 비교해 성능 손실 없이 안정적으로 배양됨을 입증했다. 이는 세계 최초로 인간 유도만능줄기세포를 동물 유래물질 배제 환경(제노-프리)에서 10회 이상 장기 계대 배양할 수 있음을 입증한 사례다.
특히 이번 연구에서 사용된 개발된 플랫폼은 매트리젤에서 배양한 세포와 비교해 세포의 분화, 자가 재생 및 줄기세포 특성 유지에 관여하는 핵심 단백질들의 발현이 변화 없이 유지됨을 확인했으며, 이는 줄기세포 치료제의 안정성과 일관성을 높이는 중요한 진전으로 평가된다.
생명화학공학과 임성갑 교수는 “이번 연구는 기존 줄기세포 배양 방식에서 벗어나 동물 유래 성분을 완전히 배제한 새로운 제노-프리 배양 플랫폼을 개발한 것으로, 특히 인간 유도만능줄기세포(hiPSC)의 장기 배양이 가능함을 세계 최초로 입증했다. 이번 연구는 줄기세포 치료제 상용화를 위한 원천 기술로 활용될 수 있을 것으로 기대되며 향후 개발된 플랫폼의 상용화 및 대규모 생산 가능하도록 후속 연구를 진행할 예정이다 ”라고 말했다.
이번 연구 결과는 조영학 박사(한국과학기술연구원), 이하나 박사(한국생명공학연구원), 정원지 학생(KAIST)이 제1 저자로 참여했으며, 국제 학술지 ‘어드벤스드 머티리얼스 (Advanced Materials)’지에 7월 17일 자 온라인 판에 게재됐다. (논문명: Long-Term Culture of Human Pluripotent Stem Cells in Xeno-Free Condition Using Functional Polymer Films)
한편, 이번 연구는 산업부 바이오산업핵심기술개발사업, 한국연구재단, 과기부 Korea Bio Grand Challenge 사업, 범부처 재생의료기술개발사업, 한국생명공학연구원 주요 사업의 지원을 받아 수행됐다.
2024.07.31 조회수 6293 -
 지방세포 이용해 체중 감소 가능하다
우리 연구진이 지방세포를 지방세포 전 단계인 줄기세포로 변화(탈분화)시키며 지방조직의 물리적인 크기를 줄이는 등 체중을 감소시키고 지방세포의 활성화를 통해 체내 신진에너지 대사 변화를 통해 비만이나 당뇨 등 대사성 질환의 제어 방법을 제시하여 화제다.
의과학대학원 서재명 교수 연구팀과 생명과학과 임대식 교수 연구팀의 공동연구를 통해 대사성 질환의 새로운 치료 전략을 규명했다고 1일 밝혔다.
지방조직은 식사 후 여분의 칼로리를 지방 형태로 저장하는 저장고 역할과 호르몬을 분비하는 내분비기관의 역할을 한다. 이 두 가지의 역할 중 하나라도 이상이 생기면 우리의 대사 체계는 무너지고 당뇨 혹은 비만과 같은 대사질환이 걸리게 된다. 그러나 우리 몸이 이 두 가지의 기능을 조화롭게 관장하는지 분자 수준에서의 기전이 알려지지 않았다.
연구팀은 히포 신호전달체계*의 얍타즈(YAP/TAZ) 단백질에 주목, 이 단백질의 지방세포 관련 기능을 규명했다. 1) 식사 유무에 따라 지방조직 안에 있는 얍타즈 단백질의 활성상태가 변한다는 점, 2) 동 단백질의 활성이 지방조직의 크기를 직접적으로 조절한다는 점 3) 에너지소비 및 포만감을 관장하는 렙틴이라는 호르몬의 생성에 얍타즈가 직접적으로 관여를 한다는 점을 밝혔다.
*히포 신호전달체계: 다세포 생물의 조직, 신체 기관의 크기를 결정하는 데 중요한 역할을 하는 세포 내 신호전달체계임.
특히 생체 내에서 활성화된 얍타즈의 역할을 규명하기 위해 라츠1/라츠2(LATS1/LATS2) 유전자를 생쥐의 지방세포에서 특이적으로 결손시켰는데, 지방세포 안에 있는 얍타즈의 지속적인 활성은 지방세포를 지방세포의 전구체, 즉 줄기세포와 같은 세포로 변화(탈분화)시키며 지방조직의 물리적인 크기를 줄인다는 점을 확인할 수 있었다.
탈분화를 통한 체지방의 감소는 에너지소비에 집중된 갈색지방의 활성화 혹은 운동과 같은 기존의 방법과 차별되는 방법이다. 또한 렙틴이라는 호르몬은 지방세포에서 만들어져 식욕을 억제하고 에너지 소비를 증가시키는 핵심적인 대사체계 조절 호르몬으로 30년 전에 처음으로 유전자 서열이 밝혀졌지만, 어떻게 생성이 되는지 분자 수준에서의 기전이 알려지지 않았다.
이번 연구는 1994년 렙틴의 유전자의 서열이 밝혀진 후 최초로 렙틴 발현의 전사 조절 기전*을 밝혔다는 점에서 세계의 주목을 받고 있다. 금번 연구는 지방세포의 압타즈의 활성 증가를 통해 혁신적인 비만 대사질환 치료제 개발의 새로운 가능성을 제시하였다.
*전사 조절 기전: DNA로부터 RNA를 만들어내는 과정을 조절하는 기전을 의미한다.
우리 대학 의과학대학원/생명과학과 최성우 박사 (현 버클리 캘리포니아 주립대학) 와 생명과학과 강주경 박사가 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 `네이처 대사(Nature Metabolism)' 5월 29일 자 온라인판에 출판됐다. (논문명 : Hippo–YAP/TAZ signalling coordinates adipose plasticity and energy balance by uncoupling leptin expression from fat mass).
한편 이번 연구는 과기정통부 리더연구자 지원사업, 중견연구자 지원사업, 바이오·의료기술개발사업, 해외우수과학자 유치사업, 카이스트 국제공동연구지원사업의 지원으로 수행됐다.
2024.07.01 조회수 5535
지방세포 이용해 체중 감소 가능하다
우리 연구진이 지방세포를 지방세포 전 단계인 줄기세포로 변화(탈분화)시키며 지방조직의 물리적인 크기를 줄이는 등 체중을 감소시키고 지방세포의 활성화를 통해 체내 신진에너지 대사 변화를 통해 비만이나 당뇨 등 대사성 질환의 제어 방법을 제시하여 화제다.
의과학대학원 서재명 교수 연구팀과 생명과학과 임대식 교수 연구팀의 공동연구를 통해 대사성 질환의 새로운 치료 전략을 규명했다고 1일 밝혔다.
지방조직은 식사 후 여분의 칼로리를 지방 형태로 저장하는 저장고 역할과 호르몬을 분비하는 내분비기관의 역할을 한다. 이 두 가지의 역할 중 하나라도 이상이 생기면 우리의 대사 체계는 무너지고 당뇨 혹은 비만과 같은 대사질환이 걸리게 된다. 그러나 우리 몸이 이 두 가지의 기능을 조화롭게 관장하는지 분자 수준에서의 기전이 알려지지 않았다.
연구팀은 히포 신호전달체계*의 얍타즈(YAP/TAZ) 단백질에 주목, 이 단백질의 지방세포 관련 기능을 규명했다. 1) 식사 유무에 따라 지방조직 안에 있는 얍타즈 단백질의 활성상태가 변한다는 점, 2) 동 단백질의 활성이 지방조직의 크기를 직접적으로 조절한다는 점 3) 에너지소비 및 포만감을 관장하는 렙틴이라는 호르몬의 생성에 얍타즈가 직접적으로 관여를 한다는 점을 밝혔다.
*히포 신호전달체계: 다세포 생물의 조직, 신체 기관의 크기를 결정하는 데 중요한 역할을 하는 세포 내 신호전달체계임.
특히 생체 내에서 활성화된 얍타즈의 역할을 규명하기 위해 라츠1/라츠2(LATS1/LATS2) 유전자를 생쥐의 지방세포에서 특이적으로 결손시켰는데, 지방세포 안에 있는 얍타즈의 지속적인 활성은 지방세포를 지방세포의 전구체, 즉 줄기세포와 같은 세포로 변화(탈분화)시키며 지방조직의 물리적인 크기를 줄인다는 점을 확인할 수 있었다.
탈분화를 통한 체지방의 감소는 에너지소비에 집중된 갈색지방의 활성화 혹은 운동과 같은 기존의 방법과 차별되는 방법이다. 또한 렙틴이라는 호르몬은 지방세포에서 만들어져 식욕을 억제하고 에너지 소비를 증가시키는 핵심적인 대사체계 조절 호르몬으로 30년 전에 처음으로 유전자 서열이 밝혀졌지만, 어떻게 생성이 되는지 분자 수준에서의 기전이 알려지지 않았다.
이번 연구는 1994년 렙틴의 유전자의 서열이 밝혀진 후 최초로 렙틴 발현의 전사 조절 기전*을 밝혔다는 점에서 세계의 주목을 받고 있다. 금번 연구는 지방세포의 압타즈의 활성 증가를 통해 혁신적인 비만 대사질환 치료제 개발의 새로운 가능성을 제시하였다.
*전사 조절 기전: DNA로부터 RNA를 만들어내는 과정을 조절하는 기전을 의미한다.
우리 대학 의과학대학원/생명과학과 최성우 박사 (현 버클리 캘리포니아 주립대학) 와 생명과학과 강주경 박사가 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 `네이처 대사(Nature Metabolism)' 5월 29일 자 온라인판에 출판됐다. (논문명 : Hippo–YAP/TAZ signalling coordinates adipose plasticity and energy balance by uncoupling leptin expression from fat mass).
한편 이번 연구는 과기정통부 리더연구자 지원사업, 중견연구자 지원사업, 바이오·의료기술개발사업, 해외우수과학자 유치사업, 카이스트 국제공동연구지원사업의 지원으로 수행됐다.
2024.07.01 조회수 5535 -
 인공지능으로 파킨슨병 맞춤형 치료 가능
파킨슨병 같은 만성 퇴행성 뇌 질환의 경우, 생존 환자의 뇌세포에 직접 접근이 제한적이기 때문에, 뇌 질환 환자의 세포 데이터를 토대로 환자 질병의 메커니즘 하위 유형을 인공지능으로 예측하는 것은 시도된 바가 없다.
우리 대학 뇌인지과학과 최민이 교수 연구팀이 영국 프랜시스 크릭 연구소(Francis Crick Institute)와의 공동 연구로 파킨슨병 환자의 개인별 질병 하위 유형을 예측하는 인공지능 기반의 플랫폼을 개발했다고 15일 밝혔다.
최민이 교수 연구팀이 개발한 플랫폼은 파킨슨병 환자의 역분화 만능 줄기세포(hiPSC)에서 분화된 신경 세포의 핵, 미토콘드리아, 리보솜 이미지 정보만 학습해 파킨슨 환자의 병리적 하위 유형을 정확하게 예측한다.
이 기술을 활용하면 환자별로 다르게 나타나는 파킨슨병 양상을 겉으로 보이는 발현형이 아닌 생물학적 메커니즘별로 분류할 수 있다. 이를 통해 원인 미상의 파킨슨병 환자가 속한 분자 세포적 하위 유형별로 진단이 가능해져 환자 맞춤형 치료의 길을 열 수 있다. 또 이 플랫폼은 고속의 대량 스크리닝 시스템을 사용하기 때문에 병리적 하위 유형에 적합한 맞춤형 약물 개발 파이프라인으로도 활용될 수 있다.
지금까지 파킨슨병의 치료는 환자 개별의 병리 상태를 고려하지 않고 확률에 기댄 ‘일률적 접근’ 방식을 사용해 왔다. 이러한 접근 방식은 병리적 원인과 치료 방법 사이의 불일치로 인해 치료 효과를 향상하기 어려웠다.
최민이 교수 연구팀이 개발한 플랫폼을 사용하면 개별 환자 뇌세포의 분자 및 세포 정보를 정밀하게 프로파일링할 수 있다. 이를 토대로 환자들의 질병 하위 유형을 정확히 진단할 수 있어서 궁극적으로 ‘정밀 의학 (Precise medicine)’이 가능해진다. 이는 각 개인에게 맞춤화된 치료 (Personalized medicine)로 이어져 치료 효과를 크게 향상할 수 있을 것으로 기대된다.
이 플랫폼은 2012년 노벨의학상 수상 기술인 유도만능줄기세포(iPSC: 성인 피부세포나 혈액에서 얻은 체세포를 태아기의 미분화 상태로 리프로그래밍한 세포. 어떤 장기 세포로도 분화가 가능)를 분화시켜 얻은 뇌세포를 사용하는 ‘접시 속 질병(disease in a dish)’ 패러다임이다. 이는 퇴행성 뇌 질환처럼 병변을 직접 얻을 수 없거나, 인간의 뇌를 정확하게 모사할 수 없는 동물 모델의 한계점을 극복할 수 있는 기술 중 하나로 주목받고 있다. 특히, 접시 속에 배양한 자신의 표적 질병 세포를 순차적으로 이미징하면 일련의 병리적 사건을 추적할 수 있어 질병 진행에 따른 약물 반응 결과를 예측할 수 있다는 이점이 있다.
교신 저자인 최민이 교수는 "이번 연구는 실험실에서 얻은 생물학적 데이터를 인공지능에 효과적으로 학습시켜, 정확도가 높은 질병 하위 유형 분류 모델을 생성하는 방법을 구체적으로 소개했다”며, "이 플랫폼은 자폐 스펙트럼과 같이 환자 개인별 증상이 뚜렷하게 다른 뇌 질환의 하위 유형을 분류하는 데에도 유용할 것이며, 이를 통해 효과적인 치료법 개발도 가능해질 것이다”라고 연구의 의의를 설명했다.
이번 논문은 영국 Medical Research Council (MRC)와 대교-KAIST 인지 향상 연구센터의 지원으로 수행됐으며, 국제 학술지 ‘네이처 머신 인텔리젼스 (Nature Machine Intelligence, IF = 25.8) 8월호에 출판됐다 (논문명: Prediction of mechanistic subtypes of Parkinson’s using patient-derived stem cell model)
2023.08.16 조회수 9361
인공지능으로 파킨슨병 맞춤형 치료 가능
파킨슨병 같은 만성 퇴행성 뇌 질환의 경우, 생존 환자의 뇌세포에 직접 접근이 제한적이기 때문에, 뇌 질환 환자의 세포 데이터를 토대로 환자 질병의 메커니즘 하위 유형을 인공지능으로 예측하는 것은 시도된 바가 없다.
우리 대학 뇌인지과학과 최민이 교수 연구팀이 영국 프랜시스 크릭 연구소(Francis Crick Institute)와의 공동 연구로 파킨슨병 환자의 개인별 질병 하위 유형을 예측하는 인공지능 기반의 플랫폼을 개발했다고 15일 밝혔다.
최민이 교수 연구팀이 개발한 플랫폼은 파킨슨병 환자의 역분화 만능 줄기세포(hiPSC)에서 분화된 신경 세포의 핵, 미토콘드리아, 리보솜 이미지 정보만 학습해 파킨슨 환자의 병리적 하위 유형을 정확하게 예측한다.
이 기술을 활용하면 환자별로 다르게 나타나는 파킨슨병 양상을 겉으로 보이는 발현형이 아닌 생물학적 메커니즘별로 분류할 수 있다. 이를 통해 원인 미상의 파킨슨병 환자가 속한 분자 세포적 하위 유형별로 진단이 가능해져 환자 맞춤형 치료의 길을 열 수 있다. 또 이 플랫폼은 고속의 대량 스크리닝 시스템을 사용하기 때문에 병리적 하위 유형에 적합한 맞춤형 약물 개발 파이프라인으로도 활용될 수 있다.
지금까지 파킨슨병의 치료는 환자 개별의 병리 상태를 고려하지 않고 확률에 기댄 ‘일률적 접근’ 방식을 사용해 왔다. 이러한 접근 방식은 병리적 원인과 치료 방법 사이의 불일치로 인해 치료 효과를 향상하기 어려웠다.
최민이 교수 연구팀이 개발한 플랫폼을 사용하면 개별 환자 뇌세포의 분자 및 세포 정보를 정밀하게 프로파일링할 수 있다. 이를 토대로 환자들의 질병 하위 유형을 정확히 진단할 수 있어서 궁극적으로 ‘정밀 의학 (Precise medicine)’이 가능해진다. 이는 각 개인에게 맞춤화된 치료 (Personalized medicine)로 이어져 치료 효과를 크게 향상할 수 있을 것으로 기대된다.
이 플랫폼은 2012년 노벨의학상 수상 기술인 유도만능줄기세포(iPSC: 성인 피부세포나 혈액에서 얻은 체세포를 태아기의 미분화 상태로 리프로그래밍한 세포. 어떤 장기 세포로도 분화가 가능)를 분화시켜 얻은 뇌세포를 사용하는 ‘접시 속 질병(disease in a dish)’ 패러다임이다. 이는 퇴행성 뇌 질환처럼 병변을 직접 얻을 수 없거나, 인간의 뇌를 정확하게 모사할 수 없는 동물 모델의 한계점을 극복할 수 있는 기술 중 하나로 주목받고 있다. 특히, 접시 속에 배양한 자신의 표적 질병 세포를 순차적으로 이미징하면 일련의 병리적 사건을 추적할 수 있어 질병 진행에 따른 약물 반응 결과를 예측할 수 있다는 이점이 있다.
교신 저자인 최민이 교수는 "이번 연구는 실험실에서 얻은 생물학적 데이터를 인공지능에 효과적으로 학습시켜, 정확도가 높은 질병 하위 유형 분류 모델을 생성하는 방법을 구체적으로 소개했다”며, "이 플랫폼은 자폐 스펙트럼과 같이 환자 개인별 증상이 뚜렷하게 다른 뇌 질환의 하위 유형을 분류하는 데에도 유용할 것이며, 이를 통해 효과적인 치료법 개발도 가능해질 것이다”라고 연구의 의의를 설명했다.
이번 논문은 영국 Medical Research Council (MRC)와 대교-KAIST 인지 향상 연구센터의 지원으로 수행됐으며, 국제 학술지 ‘네이처 머신 인텔리젼스 (Nature Machine Intelligence, IF = 25.8) 8월호에 출판됐다 (논문명: Prediction of mechanistic subtypes of Parkinson’s using patient-derived stem cell model)
2023.08.16 조회수 9361 -
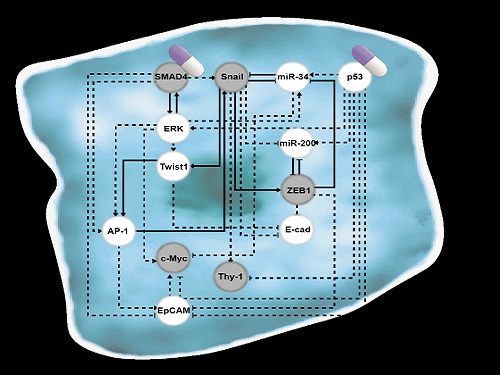 폐암 전이를 막고 치료 가능한 세포로 되돌리는 원천기술 개발
고령화에 따라 암의 발생이 늘어나면서 암은 인류의 건강수명을 위협하는 가장 치명적인 질환이 됐다. 특히 조기 발견을 놓쳐 여러 장기로 전이될 때 암의 치명률은 높아진다. 이러한 문제를 해결하기 위해 암세포의 전이 능력을 제거하거나 낮추려는 시도가 이어졌으나 오히려 중간상태의 불안정한 암세포 상태가 되면서 더욱 악성을 보이게 되어 암 치료의 난제로 남아 있었다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 폐암 세포의 성질을 변환시켜 암세포의 전이를 막고 약물에 대한 저항성을 제거할 수 있는 기술을 개발하는 데 성공했다고 30일 밝혔다.
조광현 교수 연구팀은 폐암 세포의 전이능력이 없는 상피(epithelial, 세포 방향성이 있어 유동성 없이 표면조직을 이루는 상태)세포에서 전이가 가능한 중간엽(mesenchymal, 방향성없이 개별적인 이동성을 가진 상태)세포로 변화되는 천이 과정(epithelial-to-mesenchymal transition, 이하 EMT)에서 나타나는 다양한 암세포 상태들을 나타낼 수 있는 세포의 분자 네트워크 수학모델을 만들었다. 컴퓨터 시뮬레이션 분석과 분자 세포실험을 통해 악성종양으로 증식하여 인접한 조직이나 세포로 침입하거나 약물에 내성을 가진 중간엽세포 상태에서 전이가 되지 않은 상피세포 상태로 다시 바뀔수 있도록 세포의 성질을 변환시켜주는 핵심 조절인자들을 발굴했다.
특히 이 과정에서 그동안 난제로 남아 있었던 중간과정의 불안정한 암세포 상태(EMT 하이브리드 세포 상태)를 피하는 동시에 항암 화학요법(chemotherapy) 치료가 잘 되는 상피세포 상태로 온전히 역전하는 데 성공했다.
우리 대학 김남희 박사과정, 황채영 박사, 김태영 연구원, 김현진 박사과정이 참여한 이번 연구 결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치(Cancer Research)' 1월 30일 字 온라인판 논문으로 출판됐다. (논문명: A cell fate reprogramming strategy reverses epithelial-to-mesenchymal transition of lung cancer cells while avoiding hybrid states)
암세포의 EMT 과정에서 불완전한 천이(변화과정)로 인해 발생하는 EMT 하이브리드 상태의 세포들은 상피세포와 중간엽세포의 특성을 모두 갖고 있으며, 높은 줄기세포능*을 획득해 약물저항성 및 전이 잠재성이 큰 것으로 알려져 있다. 불안정한 암세포 상태(EMT)는 매우 복잡하여 높은 전이 능력과 약물저항성을 가지는 EMT 하이브리드 세포 상태를 회피하면서 암세포를 전이 능력과 약물저항성이 제거된 상피세포 상태로 온전히 역전시키는 것은 매우 어려운 일이었다.
*줄기세포능: 줄기세포가 지속적 자가복제를 할 수 있도록 하는 세포내 신호전달체계
조광현 교수 연구팀은 복잡한 EMT를 지배하는 유전자 조절 네트워크의 수학모델을 정립한 후, 대규모 컴퓨터 시뮬레이션 분석 및 복잡계 네트워크 제어기술을 적용해 중간엽세포 상태인 폐암 세포를 EMT 하이브리드 세포 상태를 회피하면서 전이 능력이 상실된 상피세포 상태로 역전시킬 수 있는 세 개의 핵심 분자 타깃인 ‘p53 (암 억제 단백질)’, ‘SMAD4 (EMT를 조절하는 대표적 신호전달을 매개하는 중심물질로 SMAD 그룹에 포함된 단백질)’와 ‘ERK1/2 (세포의 성장 및 분화에 관여하는 조절인자)’를 발굴하고 이를 분자 세포실험을 통해 검증했다. 이러한 발견은 실제 인체 내 암 조직의 환경에서처럼 자극이 주어진 상황에서 중간엽세포 상태가 상피세포 상태로 역전될 수 있음을 증명해 그 의미가 크다.
암세포의 비정상적인 EMT는 암세포의 이동과 침윤, 화학요법 치료에 대한 반응성 변화, 강화된 줄기세포능, 암의 전이 등 다양한 악성 형질로 이어지게 된다. 특히 암세포의 전이 능력 획득은 암 환자의 예후를 결정짓는 매우 중요한 요소다. 이번에 개발된 폐암 세포의 EMT 역전 기술은 암세포를 리프로그래밍해 높은 가소성과 전이 능력을 제거하고 항암 화학치료의 반응성을 높이도록 하는 새로운 항암 치료 전략이다.
조광현 교수는 "높은 전이 능력과 약물저항성을 획득한 폐암 세포를 전이 능력이 제거되고 항암 화학요법치료에 민감한 상피세포 상태로 온전히 역전시키는 데 성공함으로써 암 환자의 예후를 증진할 수 있는 새로운 치료전략을 제시했다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역 치료원리를 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구 결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 이번 연구 결과는 전이 능력을 획득한 폐암 세포 상태를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 기술 개발의 세 번째 성과다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업 등의 지원으로 수행됐다.
2023.01.30 조회수 11496
폐암 전이를 막고 치료 가능한 세포로 되돌리는 원천기술 개발
고령화에 따라 암의 발생이 늘어나면서 암은 인류의 건강수명을 위협하는 가장 치명적인 질환이 됐다. 특히 조기 발견을 놓쳐 여러 장기로 전이될 때 암의 치명률은 높아진다. 이러한 문제를 해결하기 위해 암세포의 전이 능력을 제거하거나 낮추려는 시도가 이어졌으나 오히려 중간상태의 불안정한 암세포 상태가 되면서 더욱 악성을 보이게 되어 암 치료의 난제로 남아 있었다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 폐암 세포의 성질을 변환시켜 암세포의 전이를 막고 약물에 대한 저항성을 제거할 수 있는 기술을 개발하는 데 성공했다고 30일 밝혔다.
조광현 교수 연구팀은 폐암 세포의 전이능력이 없는 상피(epithelial, 세포 방향성이 있어 유동성 없이 표면조직을 이루는 상태)세포에서 전이가 가능한 중간엽(mesenchymal, 방향성없이 개별적인 이동성을 가진 상태)세포로 변화되는 천이 과정(epithelial-to-mesenchymal transition, 이하 EMT)에서 나타나는 다양한 암세포 상태들을 나타낼 수 있는 세포의 분자 네트워크 수학모델을 만들었다. 컴퓨터 시뮬레이션 분석과 분자 세포실험을 통해 악성종양으로 증식하여 인접한 조직이나 세포로 침입하거나 약물에 내성을 가진 중간엽세포 상태에서 전이가 되지 않은 상피세포 상태로 다시 바뀔수 있도록 세포의 성질을 변환시켜주는 핵심 조절인자들을 발굴했다.
특히 이 과정에서 그동안 난제로 남아 있었던 중간과정의 불안정한 암세포 상태(EMT 하이브리드 세포 상태)를 피하는 동시에 항암 화학요법(chemotherapy) 치료가 잘 되는 상피세포 상태로 온전히 역전하는 데 성공했다.
우리 대학 김남희 박사과정, 황채영 박사, 김태영 연구원, 김현진 박사과정이 참여한 이번 연구 결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치(Cancer Research)' 1월 30일 字 온라인판 논문으로 출판됐다. (논문명: A cell fate reprogramming strategy reverses epithelial-to-mesenchymal transition of lung cancer cells while avoiding hybrid states)
암세포의 EMT 과정에서 불완전한 천이(변화과정)로 인해 발생하는 EMT 하이브리드 상태의 세포들은 상피세포와 중간엽세포의 특성을 모두 갖고 있으며, 높은 줄기세포능*을 획득해 약물저항성 및 전이 잠재성이 큰 것으로 알려져 있다. 불안정한 암세포 상태(EMT)는 매우 복잡하여 높은 전이 능력과 약물저항성을 가지는 EMT 하이브리드 세포 상태를 회피하면서 암세포를 전이 능력과 약물저항성이 제거된 상피세포 상태로 온전히 역전시키는 것은 매우 어려운 일이었다.
*줄기세포능: 줄기세포가 지속적 자가복제를 할 수 있도록 하는 세포내 신호전달체계
조광현 교수 연구팀은 복잡한 EMT를 지배하는 유전자 조절 네트워크의 수학모델을 정립한 후, 대규모 컴퓨터 시뮬레이션 분석 및 복잡계 네트워크 제어기술을 적용해 중간엽세포 상태인 폐암 세포를 EMT 하이브리드 세포 상태를 회피하면서 전이 능력이 상실된 상피세포 상태로 역전시킬 수 있는 세 개의 핵심 분자 타깃인 ‘p53 (암 억제 단백질)’, ‘SMAD4 (EMT를 조절하는 대표적 신호전달을 매개하는 중심물질로 SMAD 그룹에 포함된 단백질)’와 ‘ERK1/2 (세포의 성장 및 분화에 관여하는 조절인자)’를 발굴하고 이를 분자 세포실험을 통해 검증했다. 이러한 발견은 실제 인체 내 암 조직의 환경에서처럼 자극이 주어진 상황에서 중간엽세포 상태가 상피세포 상태로 역전될 수 있음을 증명해 그 의미가 크다.
암세포의 비정상적인 EMT는 암세포의 이동과 침윤, 화학요법 치료에 대한 반응성 변화, 강화된 줄기세포능, 암의 전이 등 다양한 악성 형질로 이어지게 된다. 특히 암세포의 전이 능력 획득은 암 환자의 예후를 결정짓는 매우 중요한 요소다. 이번에 개발된 폐암 세포의 EMT 역전 기술은 암세포를 리프로그래밍해 높은 가소성과 전이 능력을 제거하고 항암 화학치료의 반응성을 높이도록 하는 새로운 항암 치료 전략이다.
조광현 교수는 "높은 전이 능력과 약물저항성을 획득한 폐암 세포를 전이 능력이 제거되고 항암 화학요법치료에 민감한 상피세포 상태로 온전히 역전시키는 데 성공함으로써 암 환자의 예후를 증진할 수 있는 새로운 치료전략을 제시했다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역 치료원리를 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구 결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 이번 연구 결과는 전이 능력을 획득한 폐암 세포 상태를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 기술 개발의 세 번째 성과다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업 등의 지원으로 수행됐다.
2023.01.30 조회수 11496 -
 코로나19 회복 후, 장기간 유지되는 기억 T세포 규명
우리 대학 의과학대학원 신의철 교수 연구팀이 고려대 안산병원 최원석 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 코로나19 회복자들에서 기억 T세포가 10개월 동안 잘 유지되며, 특히 줄기세포 유사 기억세포가 효율적으로 잘 발생함을 규명했다고 7일 밝혔다. 이는 중증 코로나19에 대해 방어를 하는 기억 T세포가 장기간 유지될 것을 제시하는 연구 결과다.
코로나19에 한 번 걸렸다 회복되면 이에 대항하는 방어면역이 형성된다. 그리고 이러한 방어면역의 양대 축으로 중화항체와 기억 T세포가 존재함이 알려져 왔다. 하지만 코로나19 바이러스에 대한 중화항체는 시간이 지남에 따라 감소하는 것으로 알려져, 최근에는 기억 T세포에 관한 관심이 증대되고 있다.
기억 T세포는 코로나19 감염 자체를 예방하지는 못하지만, 중증 코로나19로의 진행을 막는 것으로 알려진 중요한 면역세포다. 하지만, 코로나19 회복자에서 기억 T세포가 얼마나 오래 유지될 수 있는지, 그리고 그 기능도 오랜 기간 잘 유지되는지는 명확히 알려진 바가 없었다.
이번 연구에서 KAIST-고려대안산병원-충북대병원 공동연구팀은 한국인 코로나19 회복자들을 대상으로 10개월 동안 추적 연구를 수행해, 코로나19 바이러스에 대항하는 기억 T세포가 어떤 특성을 보이는지, 그리고 얼마나 오랫동안 유지되는지 등 지금까지 명확히 알려지지 않았던 질문들에 대한 답을 구했다. 특히 이번 연구에서는 최첨단 면역학 연구기법을 활용해, 기억 T세포의 장기 유지에 중요한 줄기세포 유사 기억 T세포의 발생을 분석하고, 한 번에 여러 가지 기능을 나타내는 다기능성 기억 T세포의 존재를 분석했다.
공동연구팀은 코로나19 회복 직후부터 나타나는 기억 T세포가 10개월의 추적관찰 동안 잘 유지됨을 밝혔다. 특히 이러한 기억 T세포 유지는 애초에 걸렸던 코로나19의 경증/중증 여부와는 상관없이 대부분의 회복자들에게서 잘 나타남을 확인했다. 그리고 10개월이 지난 후에도 다시 코로나19 바이러스 항원을 만나면 기억 T세포는 증식을 활발히 하며 한 번에 여러 가지 기능을 수행하는 다기능성을 잘 나타냄도 확인했다. 이러한 결과는 회복자가 코로나19 바이러스에 다시 노출됐을 때 기억 T세포들의 방어면역 기능이 잘 나타날 것임을 시사하는 결과다.
특히, 코로나19 회복자들에서 줄기세포 유사 기억 T세포가 잘 발생함을 규명했다. 줄기세포 유사 기억 T세포는 장기간에 걸쳐 기억 T세포들의 숫자를 유지해주는 재생기능을 가진 세포로서, 이번 연구 결과는 코로나19 회복자들의 기억 T세포가 상당히 오랜 기간 동안 잘 유지될 것임을 기대하게 하는 연구 결과다. 특히 이번 연구는 코로나19 회복 후 세계 처음으로 줄기세포 유사 기억 T세포의 발생을 보고한 것으로 세계 면역학계의 주목을 받고 있다.
삼성미래기술육성재단과 KAIST의 지원을 받아 수행한 공동연구팀의 이번 연구 결과는 국제 저명 학술지인 네이처 커뮤니케이션스(Nature Communications)誌 6월 30일 字에 게재됐다(논문명: SARS-CoV-2-specific T cell memory is sustained in COVID-19 convalescent patients for 10 months with successful development of stem cell-like memory T cells).
연구팀은 코로나19 회복자들의 장기 방어면역을 확인함과 동시에, 현재 사용되고 있는 상용화된 코로나19 백신들의 효능 평가와 추후 백신 개발의 핵심 목표 중 하나인 T세포 방어면역 장기 지속성에 대한 지표를 제시한 점에 관해 연구 의미를 부여했다.
공동연구팀은 현재 코로나19 백신을 접종받은 사람들의 기억 T세포 형성 및 기능 특성을 규명함과 동시에 코로나19 회복자들의 기억 T세포와의 비교를 통해 백신의 면역학적 효과를 파악하는 후속 연구를 진행하고 있다.
이번 연구의 제1 저자인 정재형 우리 대학 박사과정 연구원과 나민석 박사후 연구원(現 연세의대 임상강사)은 "코로나19로부터 회복 후 최대 10개월까지도 기억 T세포 면역반응이 유지됨을 확인했다ˮ며 "이러한 방어면역 지속성에 중요한 역할을 할 것으로 예측되는 줄기세포 유사 기억 T세포의 특성 및 기능 규명을 통해 재감염의 이해 및 코로나19 백신에 의한 기억 T세포 평가의 중요 지표를 마련했다ˮ고 설명했다.
신의철 교수는 "이번 연구는 코로나19 회복자의 기억 T세포 기능 및 특성을 세계에서 최장기간 연구한 결과로서 시간에 따른 방어면역 분석을 통해 향후 최적화된 차세대 백신 개발 전략을 설계할 수 있는 토대를 마련했다는 점에서 의미가 있는 연구ˮ라고 말했다.
2021.07.07 조회수 14408
코로나19 회복 후, 장기간 유지되는 기억 T세포 규명
우리 대학 의과학대학원 신의철 교수 연구팀이 고려대 안산병원 최원석 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 코로나19 회복자들에서 기억 T세포가 10개월 동안 잘 유지되며, 특히 줄기세포 유사 기억세포가 효율적으로 잘 발생함을 규명했다고 7일 밝혔다. 이는 중증 코로나19에 대해 방어를 하는 기억 T세포가 장기간 유지될 것을 제시하는 연구 결과다.
코로나19에 한 번 걸렸다 회복되면 이에 대항하는 방어면역이 형성된다. 그리고 이러한 방어면역의 양대 축으로 중화항체와 기억 T세포가 존재함이 알려져 왔다. 하지만 코로나19 바이러스에 대한 중화항체는 시간이 지남에 따라 감소하는 것으로 알려져, 최근에는 기억 T세포에 관한 관심이 증대되고 있다.
기억 T세포는 코로나19 감염 자체를 예방하지는 못하지만, 중증 코로나19로의 진행을 막는 것으로 알려진 중요한 면역세포다. 하지만, 코로나19 회복자에서 기억 T세포가 얼마나 오래 유지될 수 있는지, 그리고 그 기능도 오랜 기간 잘 유지되는지는 명확히 알려진 바가 없었다.
이번 연구에서 KAIST-고려대안산병원-충북대병원 공동연구팀은 한국인 코로나19 회복자들을 대상으로 10개월 동안 추적 연구를 수행해, 코로나19 바이러스에 대항하는 기억 T세포가 어떤 특성을 보이는지, 그리고 얼마나 오랫동안 유지되는지 등 지금까지 명확히 알려지지 않았던 질문들에 대한 답을 구했다. 특히 이번 연구에서는 최첨단 면역학 연구기법을 활용해, 기억 T세포의 장기 유지에 중요한 줄기세포 유사 기억 T세포의 발생을 분석하고, 한 번에 여러 가지 기능을 나타내는 다기능성 기억 T세포의 존재를 분석했다.
공동연구팀은 코로나19 회복 직후부터 나타나는 기억 T세포가 10개월의 추적관찰 동안 잘 유지됨을 밝혔다. 특히 이러한 기억 T세포 유지는 애초에 걸렸던 코로나19의 경증/중증 여부와는 상관없이 대부분의 회복자들에게서 잘 나타남을 확인했다. 그리고 10개월이 지난 후에도 다시 코로나19 바이러스 항원을 만나면 기억 T세포는 증식을 활발히 하며 한 번에 여러 가지 기능을 수행하는 다기능성을 잘 나타냄도 확인했다. 이러한 결과는 회복자가 코로나19 바이러스에 다시 노출됐을 때 기억 T세포들의 방어면역 기능이 잘 나타날 것임을 시사하는 결과다.
특히, 코로나19 회복자들에서 줄기세포 유사 기억 T세포가 잘 발생함을 규명했다. 줄기세포 유사 기억 T세포는 장기간에 걸쳐 기억 T세포들의 숫자를 유지해주는 재생기능을 가진 세포로서, 이번 연구 결과는 코로나19 회복자들의 기억 T세포가 상당히 오랜 기간 동안 잘 유지될 것임을 기대하게 하는 연구 결과다. 특히 이번 연구는 코로나19 회복 후 세계 처음으로 줄기세포 유사 기억 T세포의 발생을 보고한 것으로 세계 면역학계의 주목을 받고 있다.
삼성미래기술육성재단과 KAIST의 지원을 받아 수행한 공동연구팀의 이번 연구 결과는 국제 저명 학술지인 네이처 커뮤니케이션스(Nature Communications)誌 6월 30일 字에 게재됐다(논문명: SARS-CoV-2-specific T cell memory is sustained in COVID-19 convalescent patients for 10 months with successful development of stem cell-like memory T cells).
연구팀은 코로나19 회복자들의 장기 방어면역을 확인함과 동시에, 현재 사용되고 있는 상용화된 코로나19 백신들의 효능 평가와 추후 백신 개발의 핵심 목표 중 하나인 T세포 방어면역 장기 지속성에 대한 지표를 제시한 점에 관해 연구 의미를 부여했다.
공동연구팀은 현재 코로나19 백신을 접종받은 사람들의 기억 T세포 형성 및 기능 특성을 규명함과 동시에 코로나19 회복자들의 기억 T세포와의 비교를 통해 백신의 면역학적 효과를 파악하는 후속 연구를 진행하고 있다.
이번 연구의 제1 저자인 정재형 우리 대학 박사과정 연구원과 나민석 박사후 연구원(現 연세의대 임상강사)은 "코로나19로부터 회복 후 최대 10개월까지도 기억 T세포 면역반응이 유지됨을 확인했다ˮ며 "이러한 방어면역 지속성에 중요한 역할을 할 것으로 예측되는 줄기세포 유사 기억 T세포의 특성 및 기능 규명을 통해 재감염의 이해 및 코로나19 백신에 의한 기억 T세포 평가의 중요 지표를 마련했다ˮ고 설명했다.
신의철 교수는 "이번 연구는 코로나19 회복자의 기억 T세포 기능 및 특성을 세계에서 최장기간 연구한 결과로서 시간에 따른 방어면역 분석을 통해 향후 최적화된 차세대 백신 개발 전략을 설계할 수 있는 토대를 마련했다는 점에서 의미가 있는 연구ˮ라고 말했다.
2021.07.07 조회수 14408 -
 시스템생물학 이용 세계 최초 알츠하이머성 치매 환자 맞춤형 치료 효능 예측 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀 (장소영 박사과정(제1저자), 강의룡 박사과정, 장홍준 박사과정)은 서울대학교 의과대학 묵인희 교수 연구팀과 공동연구를 통해 시스템생물학*과 알츠하이머 환자 유래 뇌 오가노이드** 모델의 융합으로 환자 맞춤형 약물 효능평가 플랫폼(Drug-screening platform)을 세계 최초로 개발했다고 13일 밝혔다.
* 시스템생물학: IT의 수학모델링 및 컴퓨터시뮬레이션과 BT의 분자세포생물학 실험을 융합하여 복잡한 생명현상을 규명하고 설명하는 연구 패러다임
** 뇌 오가노이드: 환자의 역분화 줄기세포(iPSC) 유래 인공 미니 뇌
알츠하이머병은 치매의 약 70%를 차지하는 대표적 치매 질환이나 현재까지 발병 원인이 불명확하며, 근본적인 치료제도 없는 인류가 극복하지 못한 질병 중 하나다.
알츠하이머병 치료제 개발 난제 중 하나는 실제 살아있는 환자의 뇌를 직접 실험 샘플로 사용할 수 없다는 것이었다. 이는 수많은 치료제 후보군의 약물 효능을 정확히 평가하기가 어려워 치료제 개발의 걸림돌로 작용해왔다.
조광현 교수 공동 연구팀은 실제 치매환자에서 유래한 뇌 오가노이드 기반으로 생물학적 메커니즘에 대한 수학 모델링을 융합하여 약물효능 예측이 가능한 플랫폼을 세계 최초로 개발했다. 환자 혈액으로부터 역분화줄기세포(Induced-pluripotent stem cell)*를 구축 후 이를 이용하여 3D 뇌 오가노이드를 제작해 실제 환자의 뇌와 유사한 환경 구축을 통해 실험적 한계를 극복했다.
* 역분화줄기세포: 다능성이 없는 혈액 면역세포에 역분화를 일으키는 4가지 특정 유전자를 도입하여 배아 줄기세포와 같이 모든 종류의 세포로 분화할 수 있는 성질(다능성)을 가진 줄기세포
또한, 시스템생물학 기반 수학 모델링 기법으로 알츠하이머병의 신경세포 특이적 네트워크망을 구축하고, 이를 실제 알츠하이머병 환자 및 정상군 유래 뇌 오가노이드를 통하여 신경세포 컴퓨터 모델의 실효성을 검증했다.
이 연구결과는 알츠하이머병의 시스템생물학 기반 신경세포 컴퓨터 모델을 실제 환자 유래 뇌 오가노이드로 검증한 세계 최초의 사례이다. 이는 환자 맞춤형 치료(Precision medicine)의 불모지로 여겨졌던 뇌 질환분야에서도 알츠하이머병 환자의 유전형에 따른 최적의 약물 효능 예측이 가능하게 됨을 의미하며 향후 약물 타겟 발굴에 기여할 것으로 기대된다.
조광현 교수는 “이번에 개발한 시스템생물학 기반 알츠하이머성 치매환자 약물 효능평가 플랫폼을 통해 향후 치매 치료제 개발 경쟁에서 우리나라가 국가적 우위를 선점할 수 있을 것으로 기대한다”고 밝혔다.
이번 연구는 보건복지부 한국보건산업진흥원의 국가치매극복기술개발 사업 및 한국연구재단의 중견연구자지원사업으로 수행됐으며, 연구성과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)의 2021년 1월 12일자 논문으로 게재됐다.
(https://www.nature.com/articles/s41467-020-20440-5)
2021.01.13 조회수 75351
시스템생물학 이용 세계 최초 알츠하이머성 치매 환자 맞춤형 치료 효능 예측 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀 (장소영 박사과정(제1저자), 강의룡 박사과정, 장홍준 박사과정)은 서울대학교 의과대학 묵인희 교수 연구팀과 공동연구를 통해 시스템생물학*과 알츠하이머 환자 유래 뇌 오가노이드** 모델의 융합으로 환자 맞춤형 약물 효능평가 플랫폼(Drug-screening platform)을 세계 최초로 개발했다고 13일 밝혔다.
* 시스템생물학: IT의 수학모델링 및 컴퓨터시뮬레이션과 BT의 분자세포생물학 실험을 융합하여 복잡한 생명현상을 규명하고 설명하는 연구 패러다임
** 뇌 오가노이드: 환자의 역분화 줄기세포(iPSC) 유래 인공 미니 뇌
알츠하이머병은 치매의 약 70%를 차지하는 대표적 치매 질환이나 현재까지 발병 원인이 불명확하며, 근본적인 치료제도 없는 인류가 극복하지 못한 질병 중 하나다.
알츠하이머병 치료제 개발 난제 중 하나는 실제 살아있는 환자의 뇌를 직접 실험 샘플로 사용할 수 없다는 것이었다. 이는 수많은 치료제 후보군의 약물 효능을 정확히 평가하기가 어려워 치료제 개발의 걸림돌로 작용해왔다.
조광현 교수 공동 연구팀은 실제 치매환자에서 유래한 뇌 오가노이드 기반으로 생물학적 메커니즘에 대한 수학 모델링을 융합하여 약물효능 예측이 가능한 플랫폼을 세계 최초로 개발했다. 환자 혈액으로부터 역분화줄기세포(Induced-pluripotent stem cell)*를 구축 후 이를 이용하여 3D 뇌 오가노이드를 제작해 실제 환자의 뇌와 유사한 환경 구축을 통해 실험적 한계를 극복했다.
* 역분화줄기세포: 다능성이 없는 혈액 면역세포에 역분화를 일으키는 4가지 특정 유전자를 도입하여 배아 줄기세포와 같이 모든 종류의 세포로 분화할 수 있는 성질(다능성)을 가진 줄기세포
또한, 시스템생물학 기반 수학 모델링 기법으로 알츠하이머병의 신경세포 특이적 네트워크망을 구축하고, 이를 실제 알츠하이머병 환자 및 정상군 유래 뇌 오가노이드를 통하여 신경세포 컴퓨터 모델의 실효성을 검증했다.
이 연구결과는 알츠하이머병의 시스템생물학 기반 신경세포 컴퓨터 모델을 실제 환자 유래 뇌 오가노이드로 검증한 세계 최초의 사례이다. 이는 환자 맞춤형 치료(Precision medicine)의 불모지로 여겨졌던 뇌 질환분야에서도 알츠하이머병 환자의 유전형에 따른 최적의 약물 효능 예측이 가능하게 됨을 의미하며 향후 약물 타겟 발굴에 기여할 것으로 기대된다.
조광현 교수는 “이번에 개발한 시스템생물학 기반 알츠하이머성 치매환자 약물 효능평가 플랫폼을 통해 향후 치매 치료제 개발 경쟁에서 우리나라가 국가적 우위를 선점할 수 있을 것으로 기대한다”고 밝혔다.
이번 연구는 보건복지부 한국보건산업진흥원의 국가치매극복기술개발 사업 및 한국연구재단의 중견연구자지원사업으로 수행됐으며, 연구성과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)의 2021년 1월 12일자 논문으로 게재됐다.
(https://www.nature.com/articles/s41467-020-20440-5)
2021.01.13 조회수 75351 -
 우리 대학 졸업생 김광수 미 하버드 의대 교수, 맞춤형 줄기세포로 파킨슨병 임상 치료에 세계 최초로 성공
우리 대학 생명과학과 석·박사 졸업생(1983년)이면서 미국 하버드 의대 교수로 재직 중인 재미 한인 과학자가 지난 5월, 세계 최초로 파킨슨병을 앓고 있는 환자 본인의 피부세포를 도파민 신경세포로 변형해 뇌에 이식하는 방법으로 환자 맞춤형 줄기세포 임상 치료에 성공해 화제가 되고 있다.
세계 최고의 권위를 자랑하는 의학 분야 저널인 뉴잉글랜드 의학 저널(New England Journal of Medicine, 이하 NEJM, IF=70) 誌는 환자의 피부세포를 변형, 신경전달물질 도파민을 생성케 한 후 이를 파킨슨병 환자의 뇌 깊숙이 주입 시킨 결과, 면역체계의 거부반응 없이 구두끈을 다시 묶을 수 있을 뿐만 아니라 수영과 자전거를 탈 정도로 운동능력을 회복했다고 지난달 14일 소개했다. 이 파킨슨병 환자의 임상 치료 성공 소식은 뉴욕타임스, 로이터, 뉴스위크, 사이언스데일리, USNEWS 등 전 세계 유명 일간지를 통해 일제히 보도돼 큰 주목을 받았다.
화제의 주인공은 美 하버드 의대 맥린병원(McLean Hospital, Harvard Medical School) 분자신경생물학 실험실 소장 김광수 교수다. 우리 대학 대학원 석·박사 졸업생인 김광수 교수는 신경과학과 줄기세포 분야의 세계적인 석학이며, 현재 모교인 우리 대학에서 해외초빙 석좌교수와 총장 자문위원을 맡고 있다.
파킨슨병은 치매, 뇌졸중과 더불어 3대 만성 퇴행성 뇌 신경계 질환으로 꼽히는데 국내에만 11만 명에 달하는 환자가 있으며 그 수는 매년 꾸준히 증가하고 있다. 영화배우 마이클 제이 폭스, 前 세계 헤비급 챔피언 무하마드 알리와 264대 교황 요한 바오로 2세(재위 1978~2005년) 등 유명 인사들이 투병했으며 전 세계적으로 600만~1천만 명의 환자가 있다.
이 병의 발병 원인은 뇌에서 신경 전달 물질 도파민을 분비하는 신경세포가 사멸하기 때문이며 근육의 떨림, 느린 움직임, 신체의 경직, 보행 및 언어 장애 등의 증상을 가진다. 김광수 교수 연구팀은 세계 최초로 환자의 피부세포를 도파민 신경세포로 만드는 `역분화 줄기세포' 기술로 파킨슨병 환자를 임상 치료하는 데 성공했다.
2012년 노벨 생리의학상 수상자인 일본의 신야 야마나카(Shinya Yamanaka) 교수가 `유도만능 줄기세포(induced pluripotent stem cells, 이하 iPS)' 제조 기술을 개발했지만, 이 기술이 뇌 질환 환자치료에 적용돼 성공한 사례는 아직 없다. 전 세계적으로 단 한 명의 환자(황반변성증)가 자신의 iPS를 이용해 세포치료를 받은 적이 있긴 하지만(2017년 New England Journal of Medicine에 발표), 이 경우 병의 호전은 일어나지 않았다. 따라서 iPS를 사용해 피킨슨병 환자 맞춤형 치료를 시도한 것도, 성공한 사례도 김광수 교수 연구팀이 세계에서 맨 처음으로 꼽힌다.
파킨슨병의 맞춤형 줄기세포 치료를 위해서는 환자의 체세포를 안정적으로 줄기세포로 전환한 뒤 이를 다시 도파민 세포로 분화시킨 후 뇌에 이식해야 한다. 이 모든 과정은 고효율로 진행돼야 하며 유해성이나 부작용이 없어야만 가능하다. 이런 난관을 극복하기 위해 김광수 교수는 맞춤형 줄기세포 치료를 위한 연구에 오랫동안 집중해 왔다.
김광수 교수 연구팀은 지난 2009년과 2011년에 각각 바이러스를 사용하지 않고 환자의 세포로부터 유도만능 줄기세포를 제작하는 기술을 최초로 개발해 파킨슨병 동물 모델에 적용할 수 있음을 보고한 바 있다(Cell Stem Cell 2009a; Journal of Clinical Investigation, 2011).
연구팀은 또 도파민 신경의 분화 메커니즘을 밝혀 줄기세포를 효율적으로 분화하는 원리를 제시했다(Cell Sem Cell, 2009b). 이와 함께 2017년에는 역분화 과정에서 발생하는 대사 변화의 메커니즘 규명을 통해 임상 적용이 가능한 새로운 역분화 기술을 개발했다(Nature Cell Biology, 2017). 또 그간 개발한 기술을 기반으로 제조된 도파민 신경세포를 파킨슨 동물 모델에 이식했을 때 암세포 등의 부작용 없이 파킨슨 증상이 현저하게 호전되는 것을 입증하는데 성공했다(Journal of Clinical Investigation, 2020).
김 교수는 20여 년간 연구해온 기술을 활용해 까다롭기로 유명한 미국 식품의약국(FDA)의 최종 승인을 받고 FDA 요청에 의해 지난 2017년과 2018년 2차례에 걸쳐 69세 파킨슨병 환자에게 도파민 신경세포를 면역체계의 거부반응 없이 작용토록 세계 최초로 이식 수술을 진행했다. 이후 2년 동안 PET, MRI 영상 등 후속 테스트를 마친 후, 올 5월 임상 치료에 성공했음을 발표했다. 이식 수술을 받은 환자는 조지 로페즈(George Lopez) 氏로 의사이자 사업가이며 발명가다. 그는 맞춤형 줄기세포의 신속한 연구와 파킨슨병 정복을 위해 애써 달라며 김광수 교수 연구팀을 꾸준히 지원해 오고 있는 것으로 알려졌다.
뉴잉글랜드 의학 저널(New England Journal of Medicine(IF=70))이 맞춤형 줄기세포로 파킨슨병 임상 치료에 성공했다고 밝혀 화제가 된 로페즈 氏의 뇌 이식 수술을 직접 집도한 의사인 매사추세츠 제너럴 병원(Massachusetts General Hospital) 제프리 슈바이처 박사는 "매우 고무적인 임상 치료결과ˮ라고 말했다.
김광수 교수는 "향후 안정성과 효능성 입증을 위해 더 많은 환자를 대상으로 임상실험이 필요하며 FDA의 승인을 위해 필요한 절차를 밟고 있다ˮ고 말했다. 김 교수는 이어 "10여 년 정도 후속 연구를 계속 성공적으로 수행하면 맞춤형 세포치료가 파킨슨병 치료를 위한 또 하나의 보편적인 치료 방법으로 자리 잡게 될 것ˮ이라고 기대했다.
2020.06.04 조회수 24322
우리 대학 졸업생 김광수 미 하버드 의대 교수, 맞춤형 줄기세포로 파킨슨병 임상 치료에 세계 최초로 성공
우리 대학 생명과학과 석·박사 졸업생(1983년)이면서 미국 하버드 의대 교수로 재직 중인 재미 한인 과학자가 지난 5월, 세계 최초로 파킨슨병을 앓고 있는 환자 본인의 피부세포를 도파민 신경세포로 변형해 뇌에 이식하는 방법으로 환자 맞춤형 줄기세포 임상 치료에 성공해 화제가 되고 있다.
세계 최고의 권위를 자랑하는 의학 분야 저널인 뉴잉글랜드 의학 저널(New England Journal of Medicine, 이하 NEJM, IF=70) 誌는 환자의 피부세포를 변형, 신경전달물질 도파민을 생성케 한 후 이를 파킨슨병 환자의 뇌 깊숙이 주입 시킨 결과, 면역체계의 거부반응 없이 구두끈을 다시 묶을 수 있을 뿐만 아니라 수영과 자전거를 탈 정도로 운동능력을 회복했다고 지난달 14일 소개했다. 이 파킨슨병 환자의 임상 치료 성공 소식은 뉴욕타임스, 로이터, 뉴스위크, 사이언스데일리, USNEWS 등 전 세계 유명 일간지를 통해 일제히 보도돼 큰 주목을 받았다.
화제의 주인공은 美 하버드 의대 맥린병원(McLean Hospital, Harvard Medical School) 분자신경생물학 실험실 소장 김광수 교수다. 우리 대학 대학원 석·박사 졸업생인 김광수 교수는 신경과학과 줄기세포 분야의 세계적인 석학이며, 현재 모교인 우리 대학에서 해외초빙 석좌교수와 총장 자문위원을 맡고 있다.
파킨슨병은 치매, 뇌졸중과 더불어 3대 만성 퇴행성 뇌 신경계 질환으로 꼽히는데 국내에만 11만 명에 달하는 환자가 있으며 그 수는 매년 꾸준히 증가하고 있다. 영화배우 마이클 제이 폭스, 前 세계 헤비급 챔피언 무하마드 알리와 264대 교황 요한 바오로 2세(재위 1978~2005년) 등 유명 인사들이 투병했으며 전 세계적으로 600만~1천만 명의 환자가 있다.
이 병의 발병 원인은 뇌에서 신경 전달 물질 도파민을 분비하는 신경세포가 사멸하기 때문이며 근육의 떨림, 느린 움직임, 신체의 경직, 보행 및 언어 장애 등의 증상을 가진다. 김광수 교수 연구팀은 세계 최초로 환자의 피부세포를 도파민 신경세포로 만드는 `역분화 줄기세포' 기술로 파킨슨병 환자를 임상 치료하는 데 성공했다.
2012년 노벨 생리의학상 수상자인 일본의 신야 야마나카(Shinya Yamanaka) 교수가 `유도만능 줄기세포(induced pluripotent stem cells, 이하 iPS)' 제조 기술을 개발했지만, 이 기술이 뇌 질환 환자치료에 적용돼 성공한 사례는 아직 없다. 전 세계적으로 단 한 명의 환자(황반변성증)가 자신의 iPS를 이용해 세포치료를 받은 적이 있긴 하지만(2017년 New England Journal of Medicine에 발표), 이 경우 병의 호전은 일어나지 않았다. 따라서 iPS를 사용해 피킨슨병 환자 맞춤형 치료를 시도한 것도, 성공한 사례도 김광수 교수 연구팀이 세계에서 맨 처음으로 꼽힌다.
파킨슨병의 맞춤형 줄기세포 치료를 위해서는 환자의 체세포를 안정적으로 줄기세포로 전환한 뒤 이를 다시 도파민 세포로 분화시킨 후 뇌에 이식해야 한다. 이 모든 과정은 고효율로 진행돼야 하며 유해성이나 부작용이 없어야만 가능하다. 이런 난관을 극복하기 위해 김광수 교수는 맞춤형 줄기세포 치료를 위한 연구에 오랫동안 집중해 왔다.
김광수 교수 연구팀은 지난 2009년과 2011년에 각각 바이러스를 사용하지 않고 환자의 세포로부터 유도만능 줄기세포를 제작하는 기술을 최초로 개발해 파킨슨병 동물 모델에 적용할 수 있음을 보고한 바 있다(Cell Stem Cell 2009a; Journal of Clinical Investigation, 2011).
연구팀은 또 도파민 신경의 분화 메커니즘을 밝혀 줄기세포를 효율적으로 분화하는 원리를 제시했다(Cell Sem Cell, 2009b). 이와 함께 2017년에는 역분화 과정에서 발생하는 대사 변화의 메커니즘 규명을 통해 임상 적용이 가능한 새로운 역분화 기술을 개발했다(Nature Cell Biology, 2017). 또 그간 개발한 기술을 기반으로 제조된 도파민 신경세포를 파킨슨 동물 모델에 이식했을 때 암세포 등의 부작용 없이 파킨슨 증상이 현저하게 호전되는 것을 입증하는데 성공했다(Journal of Clinical Investigation, 2020).
김 교수는 20여 년간 연구해온 기술을 활용해 까다롭기로 유명한 미국 식품의약국(FDA)의 최종 승인을 받고 FDA 요청에 의해 지난 2017년과 2018년 2차례에 걸쳐 69세 파킨슨병 환자에게 도파민 신경세포를 면역체계의 거부반응 없이 작용토록 세계 최초로 이식 수술을 진행했다. 이후 2년 동안 PET, MRI 영상 등 후속 테스트를 마친 후, 올 5월 임상 치료에 성공했음을 발표했다. 이식 수술을 받은 환자는 조지 로페즈(George Lopez) 氏로 의사이자 사업가이며 발명가다. 그는 맞춤형 줄기세포의 신속한 연구와 파킨슨병 정복을 위해 애써 달라며 김광수 교수 연구팀을 꾸준히 지원해 오고 있는 것으로 알려졌다.
뉴잉글랜드 의학 저널(New England Journal of Medicine(IF=70))이 맞춤형 줄기세포로 파킨슨병 임상 치료에 성공했다고 밝혀 화제가 된 로페즈 氏의 뇌 이식 수술을 직접 집도한 의사인 매사추세츠 제너럴 병원(Massachusetts General Hospital) 제프리 슈바이처 박사는 "매우 고무적인 임상 치료결과ˮ라고 말했다.
김광수 교수는 "향후 안정성과 효능성 입증을 위해 더 많은 환자를 대상으로 임상실험이 필요하며 FDA의 승인을 위해 필요한 절차를 밟고 있다ˮ고 말했다. 김 교수는 이어 "10여 년 정도 후속 연구를 계속 성공적으로 수행하면 맞춤형 세포치료가 파킨슨병 치료를 위한 또 하나의 보편적인 치료 방법으로 자리 잡게 될 것ˮ이라고 기대했다.
2020.06.04 조회수 24322 -
 머리에 빛을 비춰 신경세포 재생과 공간기억 향상
뇌질환 상태에서 신경재생으로 일시적인 기억향상이 일어나는 기전이 밝혀졌다.
우리 대학 생명과학과 허원도 교수 연구팀은 머리에 빛을 비춰 뇌신경세포 내 Fas 수용체의 활성을 조절함으로써 신경재생과 공간기억 능력이 향상됨을 보였다.
Fas 수용체는 허혈성 뇌질환, 염증성 뇌질환, 퇴행성 신경질환 등 다양한 대뇌질환에 걸린 경우 발현이 유도되는 단백질이다. 일반적으로는 세포를 죽음에 이르게 하지만, 신경계의 다양한 세포들에서는 세포증식 관련 신호전달 경로를 활성화시켜 세포를 재생시킨다. 특히, 뇌질환에 걸린 경우 대뇌 해마의 신경재생에 Fas 수용체가 관련되어 있다는 사실이 알려져 왔으나, 연구방법의 한계로 세부적인 기전에 대해서는 아직 자세히 알려진 바가 없다. 또한, 질환이 있는 뇌에서 해마가 관장하는 공간기억이 Fas 단백질에 의해 어떻게 영향받는지에 대해서도 논란이 되어 왔다.
연구팀은 광수용체 단백질의 유전자에 Fas 수용체 단백질의 유전자를 결합시킴으로써 청색광을 쬐어주면 Fas 단백질의 활성이 유도되는 옵토파스(OptoFAS) 기술을 개발했다. 살아있는 생쥐 대뇌에 다양한 시간동안 빛을 쬐어주면서 시공간적으로 Fas 수용체 단백질의 활성을 조절함으로써 대뇌 해마에서 여러 신호전달 경로들이 순차적으로 활성화되고, 그 결과로 신경재생과 공간기억 능력이 향상된다는 것을 확인했다.
옵토파스(OptoFAS) 기술은 빛을 이용하여 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 배양시킨 세포나 살아있는 생쥐 머리에 청색광을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 하위 신호전달경로들을 활성화시킨다. 생체 내에 광섬유를 삽입하여 원하는 시간에 빛을 뇌 조직 내로 전달하는 방식으로 선택적으로 단백질을 활성화시킬 수 있다.
연구팀은 빛을 이용해 대뇌 해마의 치아이랑에 존재하는 미성숙신경세포에서 옵토파스를 활성화시키고, 빛을 쬐어주는 시간에 따라 미성숙신경세포와 신경줄기세포에서 각각 서로 다른 하위 신호전달경로가 활성화됨을 관찰했다. 또한 이 현상에 특정 뇌유래 신경성장인자가 관여함을 밝혀내었다. 반복적으로 충분한 시간동안 빛을 쬐어주면 해마 치아이랑의 신경줄기세포가 증식하는 성체 신경재생이 관찰되었으며, 실험 대상 쥐에서는 일시적으로 공간기억 능력이 향상됨을 밝혔다.
옵토파스 기술을 이용하면 약물을 처리하거나 유전자변형 쥐를 사용하였을 때 발생하는 여러 부작용이 없이 빛 자극만으로 쥐의 생리현상에 지장을 주지 않으면서 뇌신경세포에서 Fas 단백질의 활성을 실시간으로 조절할 수 있다. 질환이 있는 뇌에서 Fas 단백질이 활성화되어 질병에 맞서 대뇌의 기능을 보호하는 여러 가지 역할을 한다는 사실을 생각해볼 때, 향후 세포 수준을 물론 개체 수준까지 뇌질환 상태에서의 신경행동적인 변화를 규명하는 연구에 활용될 것으로 기대한다.
허원도 교수는 “옵토파스(OptoFAS) 기술을 이용하면 빛만으로 살아있는 개체의 신경세포 내에서 단백질의 활성과 신호전달 경로를 쉽게 조절할 수 있다”며 “이 기술이 뇌인지 과학 연구를 비롯해 향후 대뇌질환 치료제 개발 등에 다양하게 적용되길 바란다”고 말했다.
이번 연구결과는 국제 학술지 사이언스 어드밴시즈(Science Advances, IF 12.80)에 4월 23일 오전 3시(한국시간) 온라인 게재됐다.
2020.04.27 조회수 15788
머리에 빛을 비춰 신경세포 재생과 공간기억 향상
뇌질환 상태에서 신경재생으로 일시적인 기억향상이 일어나는 기전이 밝혀졌다.
우리 대학 생명과학과 허원도 교수 연구팀은 머리에 빛을 비춰 뇌신경세포 내 Fas 수용체의 활성을 조절함으로써 신경재생과 공간기억 능력이 향상됨을 보였다.
Fas 수용체는 허혈성 뇌질환, 염증성 뇌질환, 퇴행성 신경질환 등 다양한 대뇌질환에 걸린 경우 발현이 유도되는 단백질이다. 일반적으로는 세포를 죽음에 이르게 하지만, 신경계의 다양한 세포들에서는 세포증식 관련 신호전달 경로를 활성화시켜 세포를 재생시킨다. 특히, 뇌질환에 걸린 경우 대뇌 해마의 신경재생에 Fas 수용체가 관련되어 있다는 사실이 알려져 왔으나, 연구방법의 한계로 세부적인 기전에 대해서는 아직 자세히 알려진 바가 없다. 또한, 질환이 있는 뇌에서 해마가 관장하는 공간기억이 Fas 단백질에 의해 어떻게 영향받는지에 대해서도 논란이 되어 왔다.
연구팀은 광수용체 단백질의 유전자에 Fas 수용체 단백질의 유전자를 결합시킴으로써 청색광을 쬐어주면 Fas 단백질의 활성이 유도되는 옵토파스(OptoFAS) 기술을 개발했다. 살아있는 생쥐 대뇌에 다양한 시간동안 빛을 쬐어주면서 시공간적으로 Fas 수용체 단백질의 활성을 조절함으로써 대뇌 해마에서 여러 신호전달 경로들이 순차적으로 활성화되고, 그 결과로 신경재생과 공간기억 능력이 향상된다는 것을 확인했다.
옵토파스(OptoFAS) 기술은 빛을 이용하여 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 배양시킨 세포나 살아있는 생쥐 머리에 청색광을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 하위 신호전달경로들을 활성화시킨다. 생체 내에 광섬유를 삽입하여 원하는 시간에 빛을 뇌 조직 내로 전달하는 방식으로 선택적으로 단백질을 활성화시킬 수 있다.
연구팀은 빛을 이용해 대뇌 해마의 치아이랑에 존재하는 미성숙신경세포에서 옵토파스를 활성화시키고, 빛을 쬐어주는 시간에 따라 미성숙신경세포와 신경줄기세포에서 각각 서로 다른 하위 신호전달경로가 활성화됨을 관찰했다. 또한 이 현상에 특정 뇌유래 신경성장인자가 관여함을 밝혀내었다. 반복적으로 충분한 시간동안 빛을 쬐어주면 해마 치아이랑의 신경줄기세포가 증식하는 성체 신경재생이 관찰되었으며, 실험 대상 쥐에서는 일시적으로 공간기억 능력이 향상됨을 밝혔다.
옵토파스 기술을 이용하면 약물을 처리하거나 유전자변형 쥐를 사용하였을 때 발생하는 여러 부작용이 없이 빛 자극만으로 쥐의 생리현상에 지장을 주지 않으면서 뇌신경세포에서 Fas 단백질의 활성을 실시간으로 조절할 수 있다. 질환이 있는 뇌에서 Fas 단백질이 활성화되어 질병에 맞서 대뇌의 기능을 보호하는 여러 가지 역할을 한다는 사실을 생각해볼 때, 향후 세포 수준을 물론 개체 수준까지 뇌질환 상태에서의 신경행동적인 변화를 규명하는 연구에 활용될 것으로 기대한다.
허원도 교수는 “옵토파스(OptoFAS) 기술을 이용하면 빛만으로 살아있는 개체의 신경세포 내에서 단백질의 활성과 신호전달 경로를 쉽게 조절할 수 있다”며 “이 기술이 뇌인지 과학 연구를 비롯해 향후 대뇌질환 치료제 개발 등에 다양하게 적용되길 바란다”고 말했다.
이번 연구결과는 국제 학술지 사이언스 어드밴시즈(Science Advances, IF 12.80)에 4월 23일 오전 3시(한국시간) 온라인 게재됐다.
2020.04.27 조회수 15788 -
 전상용, 이대엽, 임성갑 교수, 암 줄기세포 제작 원천기술 개발
우리 대학 생명과학과 전상용, 이대엽 교수와 생명화학공학과 임성갑 교수 공동 연구팀이 특수 고분자박막을 이용해 3차원 암 줄기세포 스페로이드(spheroids)를 손쉽게 제작할 수 있는 세포배양 플랫폼을 개발했다.
연구팀은 ‘개시제를 이용한 화학 기상 증착법’을 이용한 고분자 박막을 형성해 암 줄기세포를 제작하는 데 성공했다. 이번 연구를 통해 암 줄기세포 기초 연구 및 약물 개발 플랫폼의 원천 기술을 제공할 수 있을 것으로 기대된다.
최민석, 최윤정 박사, 유승정 박사과정이 공동 1 저자로 참여한 이번 연구는 미국 암학회(AACR) 대표 국제학술지인‘암 연구(Cancer Research)’ 10월 24일자 온라인 판에 게재됐다.(논문명 : Polymer thin film-induced tumor spheroids acquire cancer stem cell-like properties)
암 줄기세포는 항암제에 대한 내재적 저항성을 가져 암의 전이와 재발에 깊이 관여하고 있다. 그러나 종양 안에 극히 일부 존재하기 때문에 지금까지는 다양한 암 줄기세포의 대량 확보가 어려워 암 연구 및 약물 개발에 제약이 있었다. 생체 내에서 암은 3차원 조직 덩어리 형태로 존재하므로 암 줄기세포를 스페로이드 형태로 배양하는 연구가 필요하다.
연구팀은 ‘개시제를 이용한 화학 기상 증착법(iCVD : initiated chemical vapor deposition)’을 이용해 세포배양 기판 위에 특정 고분자 (pV4D4)박막을 형성했다.
그 위에 다양한 암세포를 배양한 결과 암세포들이 고분자박막 표면으로부터 자극을 받아 서로 뭉치면서 3차원 스페로이드 형태를 만들었고, 이와 동시에 항암제에 대한 저항성을 가진 종양 암 줄기세포로 변화하는 것을 확인했다.
연구팀은 이러한 ‘표면자극 유도 암 줄기세포(Surface stimuli-induced cancer stem cell-like cell)’를 고효율로 손쉽게 대량 배양하는 데 성공했다.
연구팀은 이번 연구에서 특정 고분자 박막에서 배양된 표면 자극 유도 암 줄기세포 스페로이드가 약 24시간 안에 형성되며 분석결과 암 줄기세포 관련 유전자의 양이 배양시간에 따라 증가함을 발견했다.
연구팀이 개발한 플랫폼을 통해 형성된 암 줄기세포 스페로이드는 실제 항암제를 처리했을 때 뛰어난 약물저항성을 지니고 있음을 확인했다. 또한 종양 동물모델에서 비교그룹에서는 보이지 않았던 다른 장기로 암이 전이되는 것을 확인했다.
연구팀은 전체염기서열분석(Whole-genome sequencing)을 통해 표면 자극 유도 암 줄기세포와 실제 암 환자 암 줄기세포와의 유사성을 확인했다.
전상용 교수는 “이미 시판되고 있는 다양한 종류의 암 세포주들 뿐만 아니라 환자에서 유래한 생체 내 환경과 유사한 3차원 스페로이드 형태로 양질의 암 줄기세포를 고효율로 손쉽게 대량 배양할 수 있는 원천 기술을 개발했다”라며 “향후 암 줄기세포 기초 연구 및 약물 개발의 패러다임을 바꿀 수 있을 것으로 기대한다”라고 말했다.
또한 “나아가 암 줄기세포 제작용 플랫폼 소재에 대한 원천 기술 확보를 통해 거대한 암 관련 의료시장에서의 경제적인 부가가치 창출도 가능할 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성재단의 지원을 받아 수행됐다. 재단에서는 이 연구의 중요성을 높이 평가해 올해 9월부터 후속 과제 사업을 통해 3년 연장 지원을 결정했다.
□ 그림 설명
그림1. 3차원 암줄기세포 스페로이드 형성 모식도
그림2. 형성된 암줄기세포를 이용하여 약물 저항성 확인
2018.11.28 조회수 14951
전상용, 이대엽, 임성갑 교수, 암 줄기세포 제작 원천기술 개발
우리 대학 생명과학과 전상용, 이대엽 교수와 생명화학공학과 임성갑 교수 공동 연구팀이 특수 고분자박막을 이용해 3차원 암 줄기세포 스페로이드(spheroids)를 손쉽게 제작할 수 있는 세포배양 플랫폼을 개발했다.
연구팀은 ‘개시제를 이용한 화학 기상 증착법’을 이용한 고분자 박막을 형성해 암 줄기세포를 제작하는 데 성공했다. 이번 연구를 통해 암 줄기세포 기초 연구 및 약물 개발 플랫폼의 원천 기술을 제공할 수 있을 것으로 기대된다.
최민석, 최윤정 박사, 유승정 박사과정이 공동 1 저자로 참여한 이번 연구는 미국 암학회(AACR) 대표 국제학술지인‘암 연구(Cancer Research)’ 10월 24일자 온라인 판에 게재됐다.(논문명 : Polymer thin film-induced tumor spheroids acquire cancer stem cell-like properties)
암 줄기세포는 항암제에 대한 내재적 저항성을 가져 암의 전이와 재발에 깊이 관여하고 있다. 그러나 종양 안에 극히 일부 존재하기 때문에 지금까지는 다양한 암 줄기세포의 대량 확보가 어려워 암 연구 및 약물 개발에 제약이 있었다. 생체 내에서 암은 3차원 조직 덩어리 형태로 존재하므로 암 줄기세포를 스페로이드 형태로 배양하는 연구가 필요하다.
연구팀은 ‘개시제를 이용한 화학 기상 증착법(iCVD : initiated chemical vapor deposition)’을 이용해 세포배양 기판 위에 특정 고분자 (pV4D4)박막을 형성했다.
그 위에 다양한 암세포를 배양한 결과 암세포들이 고분자박막 표면으로부터 자극을 받아 서로 뭉치면서 3차원 스페로이드 형태를 만들었고, 이와 동시에 항암제에 대한 저항성을 가진 종양 암 줄기세포로 변화하는 것을 확인했다.
연구팀은 이러한 ‘표면자극 유도 암 줄기세포(Surface stimuli-induced cancer stem cell-like cell)’를 고효율로 손쉽게 대량 배양하는 데 성공했다.
연구팀은 이번 연구에서 특정 고분자 박막에서 배양된 표면 자극 유도 암 줄기세포 스페로이드가 약 24시간 안에 형성되며 분석결과 암 줄기세포 관련 유전자의 양이 배양시간에 따라 증가함을 발견했다.
연구팀이 개발한 플랫폼을 통해 형성된 암 줄기세포 스페로이드는 실제 항암제를 처리했을 때 뛰어난 약물저항성을 지니고 있음을 확인했다. 또한 종양 동물모델에서 비교그룹에서는 보이지 않았던 다른 장기로 암이 전이되는 것을 확인했다.
연구팀은 전체염기서열분석(Whole-genome sequencing)을 통해 표면 자극 유도 암 줄기세포와 실제 암 환자 암 줄기세포와의 유사성을 확인했다.
전상용 교수는 “이미 시판되고 있는 다양한 종류의 암 세포주들 뿐만 아니라 환자에서 유래한 생체 내 환경과 유사한 3차원 스페로이드 형태로 양질의 암 줄기세포를 고효율로 손쉽게 대량 배양할 수 있는 원천 기술을 개발했다”라며 “향후 암 줄기세포 기초 연구 및 약물 개발의 패러다임을 바꿀 수 있을 것으로 기대한다”라고 말했다.
또한 “나아가 암 줄기세포 제작용 플랫폼 소재에 대한 원천 기술 확보를 통해 거대한 암 관련 의료시장에서의 경제적인 부가가치 창출도 가능할 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성재단의 지원을 받아 수행됐다. 재단에서는 이 연구의 중요성을 높이 평가해 올해 9월부터 후속 과제 사업을 통해 3년 연장 지원을 결정했다.
□ 그림 설명
그림1. 3차원 암줄기세포 스페로이드 형성 모식도
그림2. 형성된 암줄기세포를 이용하여 약물 저항성 확인
2018.11.28 조회수 14951 -
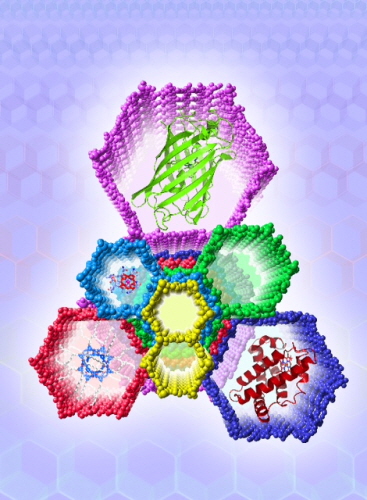 고용량 분자 저장기술 개발 성공
- KAIST EEWS 대학원 Yaghi 교수팀, 고용량의 단백질 저장체 개발 성공해 사이언스(Science)지 5월호에 실려 -
- “선택적으로 반응하는 신약 개발에 도움될 것” -
다양한 종류의 단백질 물질을 고용량으로 저장할 수 있는 기술이 KAIST 연구진에 의해 개발됐다.
우리대학 EEWS대학원 오마르 야기(Omar M. Yaghi)교수 연구팀이 커다란 크기의 기공을 갖는 금속유기골격구조체를 개발해 여러 종류의 단백질을 고용량으로 저장할 수 있는 원천기술을 확보하는데 성공했다. 이번 연구 결과는 세계적 학술지 ‘사이언스(Science)’ 5월호(25일자)에 실렸다.
이번에 개발된 기술은 다양한 종류와 크기의 단백질을 저장 할 수 있어 ▲고용량 고집적의 신약 개발 ▲특정 바이러스 분리 물질 개발 ▲인체 내에서 악성 반응을 일으키는 특정 단백질의 선택적 제거 ▲특정 부위에서 작용하는 신약 수용체 개발 ▲희귀 고분자 단백질 영구 보존 등 다양한 분야에 폭넓게 활용될 수 있을 것으로 학계는 기대하고 있다.
이와 함께 줄기세포를 포한한 모든 인체의 세포까지 선택적으로 분리하고 영구히 저장할 수 있어 난치병 치료나 생명연장을 위한 의학기반 기술 발전에도 크게 도움이 될 것으로 예상된다.
금속유기골격구조체는 분자단위에서 같은 물질들이 일정한 규칙과 간격을 가지고 배열돼 생성되는 것이기 때문에, 1그램당 축구장과 같은 크기의 표면적을 가지고 있으며 고용량의 물질 저장 능력과 빠른 물질 이동특성을 가지고 있다.
따라서 많은 양의 물질을 내부에 저장할 수 있어 최근 다양한 종류의 차세대 저장체 연구에 필수적인 장비로 사용되고 있다.
그러나 지금까지의 금속유기골격구조체는 7.0Å(옴스트롬·100억분의 1m) 크기의 아주 작은 단분자만을 사용했기 때문에 커다란 크기의 고분자 및 단백질의 저장에는 활용될 수 없었으며 고용량 가스 저장체로서의 가능성만 입증된 상태였다. 게다가 기존의 금속유기골격구조체의 경우 구조가 내부에서 서로 엇갈려 있어 큰 크기의 단백질을 저장하는 것은 사실상 불가능했다.
야기(Yaghi) 교수 연구팀은 5nm 이상의 크기를 가지는 분자체를 이용한 금속유기골격구조체를 개발해 이러한 문제들을 해결하고, 금속유기골격구조체의 주기적인 기공을 처음으로 투과전자현미경을 이용해 관찰하기도 했다.
연구팀은 커다란 크기의 분자들을 이용해 금속유기골격구조체를 만들고 단백질처럼 아주 큰 물질을 구조체 내부에 일정하게 배열시켜 효율적으로 저장하는 방법을 고안해 내 세계 최초로 규칙적 분자구조체 내부에 비타민과 미오그로빈(Myoglobin) 같은 단백질을 고용량으로 저장하는데 성공했다.
야기(Yaghi) 교수는 “이번 연구는 그동안 불가능했던 큰 크기의 단백질 및 고분자들을 규칙적 배열을 가지는 다공성 물질을 개발해 고용량으로 저장하는 원천기술”이라며 “고용량으로 집적된 단백질 약을 원하는 곳에 투여함과 동시에 제거해야 할 분자들을 선택적으로 흡수함으로써 난치병이나 희귀병 치료에 획기적인 역할을 할 수 있을 것으로 기대된다”고 말했다.
2012.05.29 조회수 17522
고용량 분자 저장기술 개발 성공
- KAIST EEWS 대학원 Yaghi 교수팀, 고용량의 단백질 저장체 개발 성공해 사이언스(Science)지 5월호에 실려 -
- “선택적으로 반응하는 신약 개발에 도움될 것” -
다양한 종류의 단백질 물질을 고용량으로 저장할 수 있는 기술이 KAIST 연구진에 의해 개발됐다.
우리대학 EEWS대학원 오마르 야기(Omar M. Yaghi)교수 연구팀이 커다란 크기의 기공을 갖는 금속유기골격구조체를 개발해 여러 종류의 단백질을 고용량으로 저장할 수 있는 원천기술을 확보하는데 성공했다. 이번 연구 결과는 세계적 학술지 ‘사이언스(Science)’ 5월호(25일자)에 실렸다.
이번에 개발된 기술은 다양한 종류와 크기의 단백질을 저장 할 수 있어 ▲고용량 고집적의 신약 개발 ▲특정 바이러스 분리 물질 개발 ▲인체 내에서 악성 반응을 일으키는 특정 단백질의 선택적 제거 ▲특정 부위에서 작용하는 신약 수용체 개발 ▲희귀 고분자 단백질 영구 보존 등 다양한 분야에 폭넓게 활용될 수 있을 것으로 학계는 기대하고 있다.
이와 함께 줄기세포를 포한한 모든 인체의 세포까지 선택적으로 분리하고 영구히 저장할 수 있어 난치병 치료나 생명연장을 위한 의학기반 기술 발전에도 크게 도움이 될 것으로 예상된다.
금속유기골격구조체는 분자단위에서 같은 물질들이 일정한 규칙과 간격을 가지고 배열돼 생성되는 것이기 때문에, 1그램당 축구장과 같은 크기의 표면적을 가지고 있으며 고용량의 물질 저장 능력과 빠른 물질 이동특성을 가지고 있다.
따라서 많은 양의 물질을 내부에 저장할 수 있어 최근 다양한 종류의 차세대 저장체 연구에 필수적인 장비로 사용되고 있다.
그러나 지금까지의 금속유기골격구조체는 7.0Å(옴스트롬·100억분의 1m) 크기의 아주 작은 단분자만을 사용했기 때문에 커다란 크기의 고분자 및 단백질의 저장에는 활용될 수 없었으며 고용량 가스 저장체로서의 가능성만 입증된 상태였다. 게다가 기존의 금속유기골격구조체의 경우 구조가 내부에서 서로 엇갈려 있어 큰 크기의 단백질을 저장하는 것은 사실상 불가능했다.
야기(Yaghi) 교수 연구팀은 5nm 이상의 크기를 가지는 분자체를 이용한 금속유기골격구조체를 개발해 이러한 문제들을 해결하고, 금속유기골격구조체의 주기적인 기공을 처음으로 투과전자현미경을 이용해 관찰하기도 했다.
연구팀은 커다란 크기의 분자들을 이용해 금속유기골격구조체를 만들고 단백질처럼 아주 큰 물질을 구조체 내부에 일정하게 배열시켜 효율적으로 저장하는 방법을 고안해 내 세계 최초로 규칙적 분자구조체 내부에 비타민과 미오그로빈(Myoglobin) 같은 단백질을 고용량으로 저장하는데 성공했다.
야기(Yaghi) 교수는 “이번 연구는 그동안 불가능했던 큰 크기의 단백질 및 고분자들을 규칙적 배열을 가지는 다공성 물질을 개발해 고용량으로 저장하는 원천기술”이라며 “고용량으로 집적된 단백질 약을 원하는 곳에 투여함과 동시에 제거해야 할 분자들을 선택적으로 흡수함으로써 난치병이나 희귀병 치료에 획기적인 역할을 할 수 있을 것으로 기대된다”고 말했다.
2012.05.29 조회수 17522 -
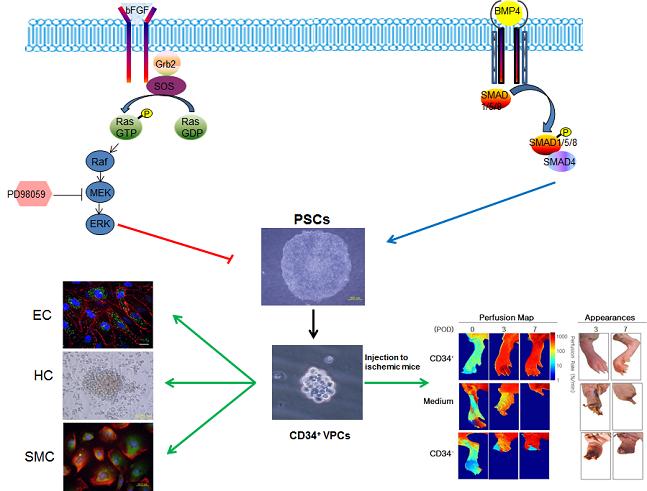 기능성 혈관전구세포 분화 성공
- 배아줄기세포 및 역분화줄기세포로 부터 기능성 혈관전구세포 분화 성공
- Blood誌 표지논문 게재, 줄기세포를 이용한 혈관질환의 세포치료 가능성 열어
우리학교 한용만 교수팀이 인간배아줄기세포 및 역분화줄기세포로부터 혈관전구세포로의 분화를 성공하였다.
이번 연구에서는 기존에 알려진 배아체형성이나 생쥐세포공배양 방식을 뛰어넘어, 인간배아줄기세포의 신호전달체계의 조절을 통해 혈관전구세포를 분화 유도하였다.
연구팀은 인간배아줄기세포를 분화하기 위해, 인간배아줄기세포의 자가재생산에 매우 중요한 역할을 하는 MEK/ERK 및 BMP 신호전달체계를 조절하여 혈관전구세포를 약 20%가량 분화 유도하였다.
이러한 방식으로 생산된 혈관전구세포는 체외에서 혈관계를 구성하는 혈관내피세포, 혈관평활근세포 및 조혈세포로의 분화가 이뤄졌고, 체내에서도 역시 혈관을 형성함을 누드마우스모델을 통해 확인하였다.
또한, 인간배아줄기세포 유래의 혈관전구세포는 하지허혈성질환동물에 주입하였을 때, 직접 혈관을 형성하거나 혈관형성에 관여하는 성장인자등을 분비하여, 하지허혈성질환동물의 혈류량이 증가한 반면 허혈성 부위의 괴사는 감소하였다.
이번 연구는 교육과학기술부(장관 이주호) 21세기프론티어연구개발사업인 세포응용연구사업단의 연구비 지원으로 수행되었으며, 고규영 교수(KAIST), 최철희 교수(KAIST), 정형민 교수(차의과대학교), 조이숙 박사(한국생명공학연구원) 등이 참여하였다.
연구결과는 올해 9월 美혈액학회지인 "Blood(IF:10.55)"에 표지논문으로 최종 게재되었으며, 국내특허 등록 및 해외 PCT출원을 마친 상태이다.
이 실험결과를 바탕으로, 향후 혈관질환분야에 줄기세포를 이용한 환자맞춤형 세포치료의 가능성을 열어줄 것으로 기대된다.
[그림] 신호전달체계의 조절을 통한 배아 및 역분화 줄기세포의 혈관전구세포의 분화
2010.12.27 조회수 19403
기능성 혈관전구세포 분화 성공
- 배아줄기세포 및 역분화줄기세포로 부터 기능성 혈관전구세포 분화 성공
- Blood誌 표지논문 게재, 줄기세포를 이용한 혈관질환의 세포치료 가능성 열어
우리학교 한용만 교수팀이 인간배아줄기세포 및 역분화줄기세포로부터 혈관전구세포로의 분화를 성공하였다.
이번 연구에서는 기존에 알려진 배아체형성이나 생쥐세포공배양 방식을 뛰어넘어, 인간배아줄기세포의 신호전달체계의 조절을 통해 혈관전구세포를 분화 유도하였다.
연구팀은 인간배아줄기세포를 분화하기 위해, 인간배아줄기세포의 자가재생산에 매우 중요한 역할을 하는 MEK/ERK 및 BMP 신호전달체계를 조절하여 혈관전구세포를 약 20%가량 분화 유도하였다.
이러한 방식으로 생산된 혈관전구세포는 체외에서 혈관계를 구성하는 혈관내피세포, 혈관평활근세포 및 조혈세포로의 분화가 이뤄졌고, 체내에서도 역시 혈관을 형성함을 누드마우스모델을 통해 확인하였다.
또한, 인간배아줄기세포 유래의 혈관전구세포는 하지허혈성질환동물에 주입하였을 때, 직접 혈관을 형성하거나 혈관형성에 관여하는 성장인자등을 분비하여, 하지허혈성질환동물의 혈류량이 증가한 반면 허혈성 부위의 괴사는 감소하였다.
이번 연구는 교육과학기술부(장관 이주호) 21세기프론티어연구개발사업인 세포응용연구사업단의 연구비 지원으로 수행되었으며, 고규영 교수(KAIST), 최철희 교수(KAIST), 정형민 교수(차의과대학교), 조이숙 박사(한국생명공학연구원) 등이 참여하였다.
연구결과는 올해 9월 美혈액학회지인 "Blood(IF:10.55)"에 표지논문으로 최종 게재되었으며, 국내특허 등록 및 해외 PCT출원을 마친 상태이다.
이 실험결과를 바탕으로, 향후 혈관질환분야에 줄기세포를 이용한 환자맞춤형 세포치료의 가능성을 열어줄 것으로 기대된다.
[그림] 신호전달체계의 조절을 통한 배아 및 역분화 줄기세포의 혈관전구세포의 분화
2010.12.27 조회수 19403