%ED%87%B4%ED%96%89%EC%84%B1
-
 손상된 시력 회복 망막 치료제 개발 성공
시각은 인간의 가장 중요한 감각으로, 현재 전 세계적으로 3억 명 이상의 인구가 다양한 망막질환으로 시력 상실의 위험에 놓여 있다. 최근 망막질환 치료제들이 개발돼 병증의 진행을 억제하는 효과를 보이고 있으나, 이미 손상된 시력 회복까지 가능하게 하는 실효적 치료제의 개발은 부재한 상황이다. 우리 연구진이 시력 회복을 위한 신약 개발에 성공했다.
우리 대학 생명과학과 김진우 교수 연구팀이 망막 신경 재생을 통해 시력을 회복할 수 있는 치료법을 개발했다고 30일 밝혔다.
김 교수 연구팀은 망막 재생을 억제하는 프록스원(PROX1) 단백질을 차단하는 물질을 질환 모델 생쥐 안구에 투여해 망막 조직의 신경 재생과 시력 회복을 유도하고, 그 효과를 6개월 이상 지속하는 데 성공했다.
이번 연구는 포유류 망막에서 장기간 신경 재생을 유도한 세계 최초의 사례로, 치료제가 전무했던 퇴행성 망막질환 환자들에게 새로운 희망을 제시한다.
전 세계적인 인구 노령화와 함께 망막질환자의 숫자가 지속적으로 증가하고 있지만, 손상된 환자의 망막과 시력을 회복할 수 있는 치료법은 존재하지 않는다. 환자 망막의 회복이 어려운 주요 원인은 손상된 망막의 재생이 되지 않는 것과 깊은 연관성이 있다.
망막 재생이 활발한 어류와 같은 변온동물에서 연구된 바에 따르면, 망막 손상 시 망막 내부에 존재하는 뮬러글리아(Müller glia)라는 세포가 신경전구세포로 역분화한 후 새로운 신경세포를 생성하는 능력을 가지고 있는데, 인간과 같은 포유류는 이 기능이 사라져 망막 재생이 이루어지지 못하고 손상이 영구적으로 남는 것으로 알려져 있다.
김 교수 연구팀은 이번 연구를 통해 포유류 뮬러글리아 세포의 역분화를 억제하는 인자로 프록스원(PROX1) 단백질을 발견하였다. 프록스원은 망막과 해마, 척추 등의 신경 조직 내 신경세포에서 생성되는 단백질로 신경줄기세포의 분열을 억제하고 신경세포로 분화를 유도하는 단백질로 알려져 있다.
연구진은 프록스원 단백질이 손상된 생쥐 망막 내 뮬러글리아에는 축적이 되지만, 재생이 활발한 어류의 뮬러글리아에는 축적이 되지 않음을 발견하였다. 또한, 뮬러글리아에 있는 프록스원은 내부에서 생성된 것이 아니라, 주변의 신경세포가 분해하지 못하고 분비한 것을 뮬러글리아가 받아들인 것이라는 것도 증명하였다.
이러한 프록스원 단백질의 이동 현상에 착안해 신경세포에서 분비된 프록스원이 뮬러글리아로 도달하기 전에, 세포 외부에서 제거하여 뮬러글리아의 신경재생 능력을 복원하는 방법을 개발하였다.
이 방법은 프록스원에 결합하는 항체를 활용하는 것으로, 김진우 교수가 연구실 벤처로 창업한 ㈜셀리아즈에서 발굴하였으며 기존 항체들보다 탁월한 결합력을 보였다. 이 프록스원 중화항체를 투여한 질환 모사 생쥐 망막에서는 신경 재생이 활발히 일어났고, 선천성망막퇴행성질환 생쥐 망막에 유전자 치료제 형태로 전달하면 지속적인 신경세포의 생성과 시력의 회복이 6개월 이상 유지되는 것을 확인하였다.
이 망막 재생 유도 치료제는 KAIST 교원 창업 기업인 (주)셀리아즈에서 현재 마땅한 치료제가 없는 여러 퇴행성망막질환에 적용하기 위해 개발하고 있으며, 2028년에는 임상시험에 돌입하는 것을 목표로 하고 있다.
이 논문의 제1 저자인 이은정 박사는 "프록스원(PROX1) 중화항체(CLZ001)의 효능을 개선하는 작업이 마무리 되어 곧 여러 동물을 이용한 시력 회복 효능과 안전성 평가를 마친 후 망막질환자에 투여하는 것을 목표로 하고 있다ˮ 라며 "적절한 치료제가 없이 실명의 위험에 노출된 환자들에게 실질적 도움이 되도록 연구를 진행하겠다ˮ 라고 말했다.
(주)셀리아즈 이은정 박사와 KAIST 김무성 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션스(Nature Communications)' 3월 26일자 온라인에 발표됐다. (논문명 : Restoration of retinal regenerative potential of Müller glia by disrupting intercellular Prox1 transfer. DOI: 10.1038/s41467-025-58290-8).
이번 연구는 한국연구재단 중견연구자지원사업 및 국가신약개발사업의 지원을 받아 수행됐다.
2025.03.31 조회수 10274
손상된 시력 회복 망막 치료제 개발 성공
시각은 인간의 가장 중요한 감각으로, 현재 전 세계적으로 3억 명 이상의 인구가 다양한 망막질환으로 시력 상실의 위험에 놓여 있다. 최근 망막질환 치료제들이 개발돼 병증의 진행을 억제하는 효과를 보이고 있으나, 이미 손상된 시력 회복까지 가능하게 하는 실효적 치료제의 개발은 부재한 상황이다. 우리 연구진이 시력 회복을 위한 신약 개발에 성공했다.
우리 대학 생명과학과 김진우 교수 연구팀이 망막 신경 재생을 통해 시력을 회복할 수 있는 치료법을 개발했다고 30일 밝혔다.
김 교수 연구팀은 망막 재생을 억제하는 프록스원(PROX1) 단백질을 차단하는 물질을 질환 모델 생쥐 안구에 투여해 망막 조직의 신경 재생과 시력 회복을 유도하고, 그 효과를 6개월 이상 지속하는 데 성공했다.
이번 연구는 포유류 망막에서 장기간 신경 재생을 유도한 세계 최초의 사례로, 치료제가 전무했던 퇴행성 망막질환 환자들에게 새로운 희망을 제시한다.
전 세계적인 인구 노령화와 함께 망막질환자의 숫자가 지속적으로 증가하고 있지만, 손상된 환자의 망막과 시력을 회복할 수 있는 치료법은 존재하지 않는다. 환자 망막의 회복이 어려운 주요 원인은 손상된 망막의 재생이 되지 않는 것과 깊은 연관성이 있다.
망막 재생이 활발한 어류와 같은 변온동물에서 연구된 바에 따르면, 망막 손상 시 망막 내부에 존재하는 뮬러글리아(Müller glia)라는 세포가 신경전구세포로 역분화한 후 새로운 신경세포를 생성하는 능력을 가지고 있는데, 인간과 같은 포유류는 이 기능이 사라져 망막 재생이 이루어지지 못하고 손상이 영구적으로 남는 것으로 알려져 있다.
김 교수 연구팀은 이번 연구를 통해 포유류 뮬러글리아 세포의 역분화를 억제하는 인자로 프록스원(PROX1) 단백질을 발견하였다. 프록스원은 망막과 해마, 척추 등의 신경 조직 내 신경세포에서 생성되는 단백질로 신경줄기세포의 분열을 억제하고 신경세포로 분화를 유도하는 단백질로 알려져 있다.
연구진은 프록스원 단백질이 손상된 생쥐 망막 내 뮬러글리아에는 축적이 되지만, 재생이 활발한 어류의 뮬러글리아에는 축적이 되지 않음을 발견하였다. 또한, 뮬러글리아에 있는 프록스원은 내부에서 생성된 것이 아니라, 주변의 신경세포가 분해하지 못하고 분비한 것을 뮬러글리아가 받아들인 것이라는 것도 증명하였다.
이러한 프록스원 단백질의 이동 현상에 착안해 신경세포에서 분비된 프록스원이 뮬러글리아로 도달하기 전에, 세포 외부에서 제거하여 뮬러글리아의 신경재생 능력을 복원하는 방법을 개발하였다.
이 방법은 프록스원에 결합하는 항체를 활용하는 것으로, 김진우 교수가 연구실 벤처로 창업한 ㈜셀리아즈에서 발굴하였으며 기존 항체들보다 탁월한 결합력을 보였다. 이 프록스원 중화항체를 투여한 질환 모사 생쥐 망막에서는 신경 재생이 활발히 일어났고, 선천성망막퇴행성질환 생쥐 망막에 유전자 치료제 형태로 전달하면 지속적인 신경세포의 생성과 시력의 회복이 6개월 이상 유지되는 것을 확인하였다.
이 망막 재생 유도 치료제는 KAIST 교원 창업 기업인 (주)셀리아즈에서 현재 마땅한 치료제가 없는 여러 퇴행성망막질환에 적용하기 위해 개발하고 있으며, 2028년에는 임상시험에 돌입하는 것을 목표로 하고 있다.
이 논문의 제1 저자인 이은정 박사는 "프록스원(PROX1) 중화항체(CLZ001)의 효능을 개선하는 작업이 마무리 되어 곧 여러 동물을 이용한 시력 회복 효능과 안전성 평가를 마친 후 망막질환자에 투여하는 것을 목표로 하고 있다ˮ 라며 "적절한 치료제가 없이 실명의 위험에 노출된 환자들에게 실질적 도움이 되도록 연구를 진행하겠다ˮ 라고 말했다.
(주)셀리아즈 이은정 박사와 KAIST 김무성 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션스(Nature Communications)' 3월 26일자 온라인에 발표됐다. (논문명 : Restoration of retinal regenerative potential of Müller glia by disrupting intercellular Prox1 transfer. DOI: 10.1038/s41467-025-58290-8).
이번 연구는 한국연구재단 중견연구자지원사업 및 국가신약개발사업의 지원을 받아 수행됐다.
2025.03.31 조회수 10274 -
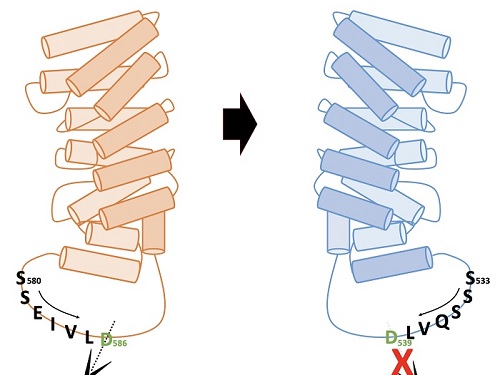 헌팅턴병 발병원인 제거를 위한 치료제 개발 방법 제시
우리 대학 생명과학과 송지준 교수 연구팀이 헌팅턴병(Huntington's disease)을 치료할 수 있는 새로운 개념의 방법을 제시했다고 2일 밝혔다.
헌팅턴병은 희귀 유전성 질환으로 근육 간 조정 능력 상실과 인지능력 저하, 정신적인 문제가 동반되는 신경계 퇴행성 질환이다. 이는 유전되는 퇴행성 뇌 질환이며 헌팅턴 단백질에 글루타민 아미노산이 여러 개가 연속적으로 확장되는 돌연변이로 인해 발병된다.
헌팅턴병은 약 1~3만 명 중 1명의 발병률을 가지고, 10여 년의 퇴행과정을 거쳐 죽음에 이르게 하는 병이다. 아미노산이 3,000개 이상 연결돼 만들어지는 거대 단백질인 헌팅틴(Huntingtin) 단백질은 질병을 일으키기는 하지만, 생체기능에 필수적인 단백질이고, 병을 일으키는 형태의 단백질만을 치료 표적으로 골라내는 것이 매우 중요하다.
송 교수 연구팀은 네델란드 프로큐알 테라퓨틱스(ProQR Therapeutics NV), 프랑스 그레노블 대학, 스웨덴 왕립 공대의 연구그룹이 참여한 국제 공동연구를 통해, 헌팅턴병을 유발하는 돌연변이 헌팅틴 단백질을 고유의 기능을 유지하면서 질병을 일으키지 않는 형태로 전환해 헌팅턴병을 치료하는 새로운 방법론을 제시했다. 이 결과는 헌팅턴병 치료제를 개발하는데 적용될 수 있을 것으로 기대된다.
우리 대학 생명과학과 김형주 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `임상연구저널(Journal of Clinical Investigation Insights)' 온라인판에 출판됐다.
(논문명 : A pathogenic proteolysis-resistant huntingtin isoform induced by an antisense oligonucleotide maintains huntingtin function) https://elifesciences.org/articles/76823
연구팀은 알엔에이(RNA)의 일종인 안티센스올리고뉴클레오타이드(antisense oligonucleotide)를 이용해 생성이 유도된 헌팅틴 델타 12의 형태가, 헌팅턴병을 유발하는 주요 원인인 단백질 아미노산 말단부위로 인해 절단되지 않으면서도 헌팅틴 단백질 고유의 기능을 유지한다는 사실 밝혔다. 연구팀이 결과는 헌팅턴병 치료제 개발의 새로운 개념으로 이용될 수 있을 것으로 기대된다.
이번 연구를 주도한 생명과학과 송지준 교수는 "이번 연구는 한국을 포함한 4개국의 공동연구를 통해 이뤄진 것으로, 질병을 유발하는 헌팅틴 단백질을 정상상태로 유도하는 방법이 헌팅턴병 치료제 개발에 새로운 길을 열어줄 것으로 기대한다ˮ이라고 설명했다.
한편 이번 연구는 한국연구재단 글로벌연구실(Global Research Laboratory) 사업의 지원을 받아 수행됐다.
2022.09.02 조회수 9054
헌팅턴병 발병원인 제거를 위한 치료제 개발 방법 제시
우리 대학 생명과학과 송지준 교수 연구팀이 헌팅턴병(Huntington's disease)을 치료할 수 있는 새로운 개념의 방법을 제시했다고 2일 밝혔다.
헌팅턴병은 희귀 유전성 질환으로 근육 간 조정 능력 상실과 인지능력 저하, 정신적인 문제가 동반되는 신경계 퇴행성 질환이다. 이는 유전되는 퇴행성 뇌 질환이며 헌팅턴 단백질에 글루타민 아미노산이 여러 개가 연속적으로 확장되는 돌연변이로 인해 발병된다.
헌팅턴병은 약 1~3만 명 중 1명의 발병률을 가지고, 10여 년의 퇴행과정을 거쳐 죽음에 이르게 하는 병이다. 아미노산이 3,000개 이상 연결돼 만들어지는 거대 단백질인 헌팅틴(Huntingtin) 단백질은 질병을 일으키기는 하지만, 생체기능에 필수적인 단백질이고, 병을 일으키는 형태의 단백질만을 치료 표적으로 골라내는 것이 매우 중요하다.
송 교수 연구팀은 네델란드 프로큐알 테라퓨틱스(ProQR Therapeutics NV), 프랑스 그레노블 대학, 스웨덴 왕립 공대의 연구그룹이 참여한 국제 공동연구를 통해, 헌팅턴병을 유발하는 돌연변이 헌팅틴 단백질을 고유의 기능을 유지하면서 질병을 일으키지 않는 형태로 전환해 헌팅턴병을 치료하는 새로운 방법론을 제시했다. 이 결과는 헌팅턴병 치료제를 개발하는데 적용될 수 있을 것으로 기대된다.
우리 대학 생명과학과 김형주 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `임상연구저널(Journal of Clinical Investigation Insights)' 온라인판에 출판됐다.
(논문명 : A pathogenic proteolysis-resistant huntingtin isoform induced by an antisense oligonucleotide maintains huntingtin function) https://elifesciences.org/articles/76823
연구팀은 알엔에이(RNA)의 일종인 안티센스올리고뉴클레오타이드(antisense oligonucleotide)를 이용해 생성이 유도된 헌팅틴 델타 12의 형태가, 헌팅턴병을 유발하는 주요 원인인 단백질 아미노산 말단부위로 인해 절단되지 않으면서도 헌팅틴 단백질 고유의 기능을 유지한다는 사실 밝혔다. 연구팀이 결과는 헌팅턴병 치료제 개발의 새로운 개념으로 이용될 수 있을 것으로 기대된다.
이번 연구를 주도한 생명과학과 송지준 교수는 "이번 연구는 한국을 포함한 4개국의 공동연구를 통해 이뤄진 것으로, 질병을 유발하는 헌팅틴 단백질을 정상상태로 유도하는 방법이 헌팅턴병 치료제 개발에 새로운 길을 열어줄 것으로 기대한다ˮ이라고 설명했다.
한편 이번 연구는 한국연구재단 글로벌연구실(Global Research Laboratory) 사업의 지원을 받아 수행됐다.
2022.09.02 조회수 9054 -
 RNA 활용해 퇴행성 관절염 획기적 조기진단 가능성 열어
우리 대학 생명화학공학과 김유식 교수와 분당서울대병원 류마티스내과 이윤종 교수 공동 연구팀이 골관절염(Osteoarthritis)을 유발하는 주요 인자를 찾아냈다고 31일 밝혔다.
골관절염은 뼈의 관절면을 감싸고 있는 관절 연골이 마모돼 연골 밑의 뼈가 노출되고, 관절 주변 활액막에 염증이 생겨서 통증과 변형이 발생하는 질환이다. 흔히 퇴행성 관절염이라고도 불리며, 관절 질환 중에서 가장 많이 발생하는 질환이다.
연구팀은 골관절염의 발병 과정 중 손상된 연골에서 염증을 일으켜 세포사멸을 촉진하는 물질이 미토콘드리아 이중나선 RNA(mitochondrial double-stranded RNA, 이하 mt-dsRNA)라는 것을 밝혔다.
이번 연구는 골관절염에서 발견되는 다양한 증상들의 원인을 mt-dsRNA라는 개념을 통해 하나로 통합함으로써 골관절염 진단 및 치료에 획기적인 방안을 제시할 것으로 기대된다.
생명화학공학과 박사과정에 재학 중인 김수진 학생과 이건용 학생이 공동 제1 저자로 참여한 이번 연구는 국제학술지 `셀 리포트(Cell Reports)' 지난 8월 9일 字에 게재됐다. (논문명 : Mitochondrial double-stranded RNAs govern the stress response in chondrocytes to promote osteoarthritis development)
골관절염은 우리나라 70세 이상의 여성 인구에서 약 50%의 유병률을 보이는 매우 흔한 질환이다. 골관절염은 일반적으로 노화와 함께 진행되기 때문에 초기에 이들을 구분하는 데 한계가 있다. 골관절염의 진행을 늦추기 위해 증상의 심각성에 따라 약물을 활용한 보존적 치료 혹은 수술을 비롯한 다양한 시도를 활발히 하고 있지만, 기존 접근방법으로 골관절염이 완치될 것이라는 기대를 하기는 어려운 상황이다. 연구팀은 질병의 발병 및 진행 메커니즘을 분석함으로써 골관절염의 조기진단과 완치에 한 걸음 다가갈 수 있는 완전히 새로운 표적 물질을 찾고자 했다.
이중나선 RNA(dsRNA)는 비정상적인 면역반응을 유발해 세포사멸 및 염증반응을 촉진한다고 알려져 있다. dsRNA의 과발현은 다양한 퇴행성 질환과 밀접한 관련이 있어 dsRNA의 조절은 건강한 세포를 유지하기 위해 필수적이다. 세포에서 dsRNA를 생성하는 대표적인 기관은 세포에 에너지를 제공한다고 알려진 미토콘드리아다. 미토콘드리아는 자체 생산하는 dsRNA를 세포질로부터 분리해 dsRNA의 노출과 이에 따른 면역반응을 막는다. 하지만 자극 혹은 세포 스트레스에 의해 mt-dsRNA가 세포질에 노출되면 RNA가 면역반응 단백질에 의해 인지돼 비정상적인 면역반응을 일으킬 수 있다.
연구팀은 골관절염에서 미토콘드리아의 손상과 원인을 알 수 없는 면역반응 단백질의 활성화가 관찰된다는 점에 착안해 mt-dsRNA가 골관절염 발병에서 중요한 기능을 할 것이라는 가설을 세웠다.
연구팀은 연골세포에서 구축한 골관절염 모사 환경에서 mt-dsRNA가 미토콘드리아 외부로 노출돼 선천성 면역반응 단백질에 의해 인지됨에 따라 면역반응을 일으킨다는 것을 확인했다. 또한 골관절염 환자들의 무릎 활막액 및 연골 조직과 골관절염 생쥐 모델의 연골에서도 mt-dsRNA가 유의미하게 증가해 있는 것을 확인했다.
특히, 다른 관절 질환인 류마티스 관절염과 통풍 환자들의 활막액과 비교했을 때 골관절염 환자들의 활막액에서 더 많은 양의 mt-dsRNA가 검출됐다. 또한 초기 골관절염을 앓고 있는 환자들의 연골에서 mt-dsRNA가 많이 증가했다. 따라서 연구팀은 골관절염을 특이적으로 조기진단 할 수 있는 바이오마커로서 mt-dsRNA의 가능성을 제시했다.
더 나아가 연구팀은 골관절염의 전도유망한 치료법 중 하나인 자가포식(Autophagy)의 치료 메커니즘에서 mt-dsRNA의 역할을 규명했다. 연구팀은 자가포식이 세포질에서 mt-dsRNA를 제거함으로써 골관절염의 증상을 완화할 수 있다는 사실을 밝힘으로써 골관절염 치료를 위한 신개념의 표적 물질로서 mt-dsRNA을 제시했다.
생명화학공학과 김유식 교수는 "이번 연구는 세포 수준의 골관절염 모사 환경에서 mt-dsRNA의 기능 규명을 넘어서 실제 골관절염 생쥐 모델의 연골 및 환자의 인체유래물에서 mt-dsRNA의 특이적인 발현 증가를 검증했다ˮ면서 "골관절염처럼 미토콘드리아 손상이 관찰되는 알츠하이머를 비롯한 퇴행성 질환의 발병 메커니즘 분석에 mt-dsRNA를 활용한다면 효과적인 치료전략을 마련하는데 유용할 것ˮ이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 박사과정생 연구장려금 지원사업의 지원을 받아 수행했다.
2022.08.31 조회수 8720
RNA 활용해 퇴행성 관절염 획기적 조기진단 가능성 열어
우리 대학 생명화학공학과 김유식 교수와 분당서울대병원 류마티스내과 이윤종 교수 공동 연구팀이 골관절염(Osteoarthritis)을 유발하는 주요 인자를 찾아냈다고 31일 밝혔다.
골관절염은 뼈의 관절면을 감싸고 있는 관절 연골이 마모돼 연골 밑의 뼈가 노출되고, 관절 주변 활액막에 염증이 생겨서 통증과 변형이 발생하는 질환이다. 흔히 퇴행성 관절염이라고도 불리며, 관절 질환 중에서 가장 많이 발생하는 질환이다.
연구팀은 골관절염의 발병 과정 중 손상된 연골에서 염증을 일으켜 세포사멸을 촉진하는 물질이 미토콘드리아 이중나선 RNA(mitochondrial double-stranded RNA, 이하 mt-dsRNA)라는 것을 밝혔다.
이번 연구는 골관절염에서 발견되는 다양한 증상들의 원인을 mt-dsRNA라는 개념을 통해 하나로 통합함으로써 골관절염 진단 및 치료에 획기적인 방안을 제시할 것으로 기대된다.
생명화학공학과 박사과정에 재학 중인 김수진 학생과 이건용 학생이 공동 제1 저자로 참여한 이번 연구는 국제학술지 `셀 리포트(Cell Reports)' 지난 8월 9일 字에 게재됐다. (논문명 : Mitochondrial double-stranded RNAs govern the stress response in chondrocytes to promote osteoarthritis development)
골관절염은 우리나라 70세 이상의 여성 인구에서 약 50%의 유병률을 보이는 매우 흔한 질환이다. 골관절염은 일반적으로 노화와 함께 진행되기 때문에 초기에 이들을 구분하는 데 한계가 있다. 골관절염의 진행을 늦추기 위해 증상의 심각성에 따라 약물을 활용한 보존적 치료 혹은 수술을 비롯한 다양한 시도를 활발히 하고 있지만, 기존 접근방법으로 골관절염이 완치될 것이라는 기대를 하기는 어려운 상황이다. 연구팀은 질병의 발병 및 진행 메커니즘을 분석함으로써 골관절염의 조기진단과 완치에 한 걸음 다가갈 수 있는 완전히 새로운 표적 물질을 찾고자 했다.
이중나선 RNA(dsRNA)는 비정상적인 면역반응을 유발해 세포사멸 및 염증반응을 촉진한다고 알려져 있다. dsRNA의 과발현은 다양한 퇴행성 질환과 밀접한 관련이 있어 dsRNA의 조절은 건강한 세포를 유지하기 위해 필수적이다. 세포에서 dsRNA를 생성하는 대표적인 기관은 세포에 에너지를 제공한다고 알려진 미토콘드리아다. 미토콘드리아는 자체 생산하는 dsRNA를 세포질로부터 분리해 dsRNA의 노출과 이에 따른 면역반응을 막는다. 하지만 자극 혹은 세포 스트레스에 의해 mt-dsRNA가 세포질에 노출되면 RNA가 면역반응 단백질에 의해 인지돼 비정상적인 면역반응을 일으킬 수 있다.
연구팀은 골관절염에서 미토콘드리아의 손상과 원인을 알 수 없는 면역반응 단백질의 활성화가 관찰된다는 점에 착안해 mt-dsRNA가 골관절염 발병에서 중요한 기능을 할 것이라는 가설을 세웠다.
연구팀은 연골세포에서 구축한 골관절염 모사 환경에서 mt-dsRNA가 미토콘드리아 외부로 노출돼 선천성 면역반응 단백질에 의해 인지됨에 따라 면역반응을 일으킨다는 것을 확인했다. 또한 골관절염 환자들의 무릎 활막액 및 연골 조직과 골관절염 생쥐 모델의 연골에서도 mt-dsRNA가 유의미하게 증가해 있는 것을 확인했다.
특히, 다른 관절 질환인 류마티스 관절염과 통풍 환자들의 활막액과 비교했을 때 골관절염 환자들의 활막액에서 더 많은 양의 mt-dsRNA가 검출됐다. 또한 초기 골관절염을 앓고 있는 환자들의 연골에서 mt-dsRNA가 많이 증가했다. 따라서 연구팀은 골관절염을 특이적으로 조기진단 할 수 있는 바이오마커로서 mt-dsRNA의 가능성을 제시했다.
더 나아가 연구팀은 골관절염의 전도유망한 치료법 중 하나인 자가포식(Autophagy)의 치료 메커니즘에서 mt-dsRNA의 역할을 규명했다. 연구팀은 자가포식이 세포질에서 mt-dsRNA를 제거함으로써 골관절염의 증상을 완화할 수 있다는 사실을 밝힘으로써 골관절염 치료를 위한 신개념의 표적 물질로서 mt-dsRNA을 제시했다.
생명화학공학과 김유식 교수는 "이번 연구는 세포 수준의 골관절염 모사 환경에서 mt-dsRNA의 기능 규명을 넘어서 실제 골관절염 생쥐 모델의 연골 및 환자의 인체유래물에서 mt-dsRNA의 특이적인 발현 증가를 검증했다ˮ면서 "골관절염처럼 미토콘드리아 손상이 관찰되는 알츠하이머를 비롯한 퇴행성 질환의 발병 메커니즘 분석에 mt-dsRNA를 활용한다면 효과적인 치료전략을 마련하는데 유용할 것ˮ이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 박사과정생 연구장려금 지원사업의 지원을 받아 수행했다.
2022.08.31 조회수 8720 -
 빛 이용해 알츠하이머 완화 가능성 열어
박 찬 범 교수
우리 대학 신소재공학과 박찬범 교수 연구팀과 한국생명공학연구원(원장 오태광) 바이오나노센터 유권 박사팀이 빛과 유기분자인 포르피린을 이용해 알츠하이머 증후군의 원인 물질로 알려진 베타-아밀로이드(beta-amyloid)의 응집 과정을 억제하는 데 성공했다.
이 기술을 통해 알츠하이머 증후군을 비롯한 여러 가지 퇴행성 뇌질환 치료에 새로운 가능성을 제시할 것으로 기대된다.
이번 연구결과는 독일의 국제 저명 학술지인 앙케반테 케미(Angewandte Chemie) 21일자 표지논문에 게재됐다.
빛을 이용한 치료는 시간과 치료 부위를 조절하기 쉽다는 장점이 있다. 암과 같은 경우에는 유기 광감응제를 투여하고 빛을 병변 부위에 조사하는 광역학 치료(photodynamic therapy)가 활용되고 있다. 하지만 광역학 치료가 알츠하이머병과 같은 퇴행성 뇌질환에 적용된 사례는 없었다.
알츠하이머 증후군은 환자의 뇌에서 생성되는 베타-아밀로이드라는 단백질이 응집돼 뇌에 침착하면서 시작된다. 이렇게 형성된 응집체는 뇌세포에 유해한 영향을 주고 손상을 일으켜 치매와 같은 뇌 기능 저하를 일으킨다.
이 과정에서 베타-아밀로이드의 응집 과정을 억제하면 아밀로이드 퇴적물의 형성을 막을 수 있고, 따라서 알츠하이머 증후군을 예방하거나 완화시킬 수 있다.
연구팀은 생체 친화적 유기 화합물인 포르피린 유도체와 청색 LED 광을 이용해 베타-아밀로이드 응집을 효과적으로 억제했다.
포르피린과 같은 광감응제는 빛 에너지를 흡수해 여기 상태가 된 후 바닥상태로 돌아가며 활성 산소를 생성한다. 생성된 활성 산소가 베타-아밀로이드 단량체와 결합해 산화시킴으로써 베타-아밀로이드의 응집을 방해하는 원리이다.
연구팀은 이를 무척추 동물에 적용해 알츠하이머 초파리 모델에서 신경 및 근육 접합부의 손상, 뇌 신경세포의 사멸, 운동성 및 수명 감소 등 알츠하이머 증후군에서 발견되는 증상의 완화를 확인했다.
빛을 이용한 치료법은 기존 약물 치료에 비해 적은 양의 약물로도 높은 치료효과를 볼 수 있고 부작용이 적다는 장점이 있다. 뇌질환에 적용할 수 있는 기술 개발이 완료된다면 그 활용도가 높을 것으로 예상된다.
박 교수는 “빛과 광감응화합물을 사용해 무척추 동물(초파리)에서 베타-아밀로이드 응집과 독성을 막는 것을 세계 최초로 확인한 것에 의의가 있다”며 “향후 다양한 유기 및 무기 광감응소재들의 적용가능성을 알아보고, 알츠하이머 마우스 등 척추동물을 대상으로 알츠하이머병의 광역학적 치료 가능성을 연구하고 싶다"고 말했다.
□ 그림 설명
그림 1. 포르피린과 빛을 이용해 알츠하이머 원인 물질의 응집을 제어한 모식도
그림2. 앙케반테 케미에 게재된 표지논문
2015.09.21 조회수 13833
빛 이용해 알츠하이머 완화 가능성 열어
박 찬 범 교수
우리 대학 신소재공학과 박찬범 교수 연구팀과 한국생명공학연구원(원장 오태광) 바이오나노센터 유권 박사팀이 빛과 유기분자인 포르피린을 이용해 알츠하이머 증후군의 원인 물질로 알려진 베타-아밀로이드(beta-amyloid)의 응집 과정을 억제하는 데 성공했다.
이 기술을 통해 알츠하이머 증후군을 비롯한 여러 가지 퇴행성 뇌질환 치료에 새로운 가능성을 제시할 것으로 기대된다.
이번 연구결과는 독일의 국제 저명 학술지인 앙케반테 케미(Angewandte Chemie) 21일자 표지논문에 게재됐다.
빛을 이용한 치료는 시간과 치료 부위를 조절하기 쉽다는 장점이 있다. 암과 같은 경우에는 유기 광감응제를 투여하고 빛을 병변 부위에 조사하는 광역학 치료(photodynamic therapy)가 활용되고 있다. 하지만 광역학 치료가 알츠하이머병과 같은 퇴행성 뇌질환에 적용된 사례는 없었다.
알츠하이머 증후군은 환자의 뇌에서 생성되는 베타-아밀로이드라는 단백질이 응집돼 뇌에 침착하면서 시작된다. 이렇게 형성된 응집체는 뇌세포에 유해한 영향을 주고 손상을 일으켜 치매와 같은 뇌 기능 저하를 일으킨다.
이 과정에서 베타-아밀로이드의 응집 과정을 억제하면 아밀로이드 퇴적물의 형성을 막을 수 있고, 따라서 알츠하이머 증후군을 예방하거나 완화시킬 수 있다.
연구팀은 생체 친화적 유기 화합물인 포르피린 유도체와 청색 LED 광을 이용해 베타-아밀로이드 응집을 효과적으로 억제했다.
포르피린과 같은 광감응제는 빛 에너지를 흡수해 여기 상태가 된 후 바닥상태로 돌아가며 활성 산소를 생성한다. 생성된 활성 산소가 베타-아밀로이드 단량체와 결합해 산화시킴으로써 베타-아밀로이드의 응집을 방해하는 원리이다.
연구팀은 이를 무척추 동물에 적용해 알츠하이머 초파리 모델에서 신경 및 근육 접합부의 손상, 뇌 신경세포의 사멸, 운동성 및 수명 감소 등 알츠하이머 증후군에서 발견되는 증상의 완화를 확인했다.
빛을 이용한 치료법은 기존 약물 치료에 비해 적은 양의 약물로도 높은 치료효과를 볼 수 있고 부작용이 적다는 장점이 있다. 뇌질환에 적용할 수 있는 기술 개발이 완료된다면 그 활용도가 높을 것으로 예상된다.
박 교수는 “빛과 광감응화합물을 사용해 무척추 동물(초파리)에서 베타-아밀로이드 응집과 독성을 막는 것을 세계 최초로 확인한 것에 의의가 있다”며 “향후 다양한 유기 및 무기 광감응소재들의 적용가능성을 알아보고, 알츠하이머 마우스 등 척추동물을 대상으로 알츠하이머병의 광역학적 치료 가능성을 연구하고 싶다"고 말했다.
□ 그림 설명
그림 1. 포르피린과 빛을 이용해 알츠하이머 원인 물질의 응집을 제어한 모식도
그림2. 앙케반테 케미에 게재된 표지논문
2015.09.21 조회수 13833