%ED%95%A9%EC%84%B1%EC%97%B0%EA%B5%AC%EB%8B%A8
-
 박희성 교수, 맞춤형 단백질 변형기술 동물 모델 적용에 성공
우리 대학 화학과 박희성 교수 연구팀이 아주대 의과대학 박찬배 교수와의 공동 연구를 통해 동물 모델에서 단백질의 아세틸화 변형을 조절할 수 있는 기술을 개발했다.
인간의 질병 연구에 대표적으로 쓰이는 쥐 모델에서 단백질 아세틸화를 조절할 수 있게 돼 다양한 질병의 원인을 밝힐 수 있을 것으로 기대된다.
이번 연구는 미래창조과학부의 글로벌프런티어사업(의약바이오컨버젼스연구단, 단장 김성훈)과 지능형 바이오시스템 설계 및 합성연구단(단장 김선창), 식약처의 미래 맞춤형 모델동물개발 연구사업단(단장 이한웅)의 지원을 받아 수행됐다.
이번 연구 결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 21일자 온라인 판에 게재됐다.
우리 몸의 세포에서 만들어지는 2만 여종의 단백질은 생합성 이후 인산화, 아세틸화, 당화 등 200여 종의 다양한 변형(post-translational modification)이 발생하게 된다.
세포 내 단백질들은 다양한 변형을 통해 기능과 활성이 조절되며 이러한 변형은 생체 내에서 세포 신호 전달 및 성장 등 우리 몸의 정상적인 신진대사 활동을 조절하는 매우 중요한 역할을 한다.
하지만 유전적 또는 환경적 요인으로 인해 단백질 변형이 비정상적으로 일어나면 세포의 신호 전달, 대사 활동 등이 손상돼 암, 치매, 당뇨를 포함한 다양한 중증 질환을 유발한다.
기존에는 이러한 비정상적 단백질 변형을 동물 모델에서 인위적으로 유발시키고 제어하는 기술이 존재하지 않아 질병의 원인 규명 및 신약 개발 연구에 어려움이 있었다.
박 교수팀은 2016년 9월 다양한 비정상 변형 단백질을 합성할 수 있는 맞춤형 단백질 변형 기술을 개발해 사이언스(Science)지에 발표한 바 있다.
연구팀은 기존 연구를 더 발전시켜 각종 암과 치매 등의 이유가 되는 퇴행성 신경질환의 원인인 비정상적인 단백질 아세틸화를 동물 모델에서 직접 구현하는 기술을 개발했다.
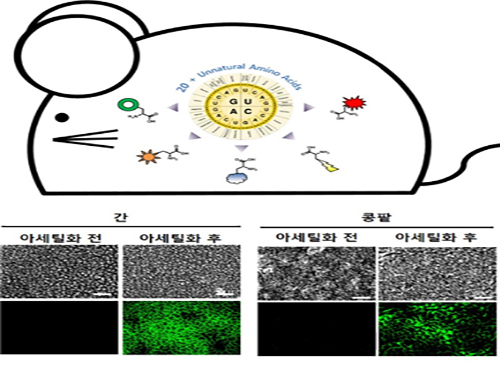
연구팀은 이 기술을 바탕으로 실험용 쥐의 특정한 발달 단계나 시기에 표적 단백질의 특정 위치에서 아세틸화 변형을 조절할 수 있음을 증명했다.
또한 다른 조직에 영향을 주지 않고 간이나 콩팥 등 특정 조직이나 기관에서만 표적 단백질의 아세틸화 변형 제어가 가능함을 확인했다.
연구팀은 “이 기술은 암과 치매 등 단백질의 비정상적 변형으로 발생하는 각종 질병의 바이오마커 발굴 등 질병 원인 규명 연구의 획기적인 전기를 마련할 것으로 기대된다”고 말했다.
박희성 교수는 “실용화 될 경우 지금까지 실현이 어려웠던 다양한 질병에 대한 실질적 동물 모델을 제조할 수 있을 것으로 전망된다”며 “향후 맞춤형 표적 항암제 및 뇌신경 치료제 개발 등 글로벌 신약 연구에 새 패러다임을 열 것이다”고 말했다.
□ 그림 설명
그림1. 아세틸화 변형 조절 마우스 개발 및 아세틸화 제어 결과
그림2. 비정상적인 단백질 변형 및 각종 질병의 모식도
2017.03.06 조회수 22809
박희성 교수, 맞춤형 단백질 변형기술 동물 모델 적용에 성공
우리 대학 화학과 박희성 교수 연구팀이 아주대 의과대학 박찬배 교수와의 공동 연구를 통해 동물 모델에서 단백질의 아세틸화 변형을 조절할 수 있는 기술을 개발했다.
인간의 질병 연구에 대표적으로 쓰이는 쥐 모델에서 단백질 아세틸화를 조절할 수 있게 돼 다양한 질병의 원인을 밝힐 수 있을 것으로 기대된다.
이번 연구는 미래창조과학부의 글로벌프런티어사업(의약바이오컨버젼스연구단, 단장 김성훈)과 지능형 바이오시스템 설계 및 합성연구단(단장 김선창), 식약처의 미래 맞춤형 모델동물개발 연구사업단(단장 이한웅)의 지원을 받아 수행됐다.
이번 연구 결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 21일자 온라인 판에 게재됐다.
우리 몸의 세포에서 만들어지는 2만 여종의 단백질은 생합성 이후 인산화, 아세틸화, 당화 등 200여 종의 다양한 변형(post-translational modification)이 발생하게 된다.
세포 내 단백질들은 다양한 변형을 통해 기능과 활성이 조절되며 이러한 변형은 생체 내에서 세포 신호 전달 및 성장 등 우리 몸의 정상적인 신진대사 활동을 조절하는 매우 중요한 역할을 한다.
하지만 유전적 또는 환경적 요인으로 인해 단백질 변형이 비정상적으로 일어나면 세포의 신호 전달, 대사 활동 등이 손상돼 암, 치매, 당뇨를 포함한 다양한 중증 질환을 유발한다.
기존에는 이러한 비정상적 단백질 변형을 동물 모델에서 인위적으로 유발시키고 제어하는 기술이 존재하지 않아 질병의 원인 규명 및 신약 개발 연구에 어려움이 있었다.
박 교수팀은 2016년 9월 다양한 비정상 변형 단백질을 합성할 수 있는 맞춤형 단백질 변형 기술을 개발해 사이언스(Science)지에 발표한 바 있다.
연구팀은 기존 연구를 더 발전시켜 각종 암과 치매 등의 이유가 되는 퇴행성 신경질환의 원인인 비정상적인 단백질 아세틸화를 동물 모델에서 직접 구현하는 기술을 개발했다.
연구팀은 이 기술을 바탕으로 실험용 쥐의 특정한 발달 단계나 시기에 표적 단백질의 특정 위치에서 아세틸화 변형을 조절할 수 있음을 증명했다.
또한 다른 조직에 영향을 주지 않고 간이나 콩팥 등 특정 조직이나 기관에서만 표적 단백질의 아세틸화 변형 제어가 가능함을 확인했다.
연구팀은 “이 기술은 암과 치매 등 단백질의 비정상적 변형으로 발생하는 각종 질병의 바이오마커 발굴 등 질병 원인 규명 연구의 획기적인 전기를 마련할 것으로 기대된다”고 말했다.
박희성 교수는 “실용화 될 경우 지금까지 실현이 어려웠던 다양한 질병에 대한 실질적 동물 모델을 제조할 수 있을 것으로 전망된다”며 “향후 맞춤형 표적 항암제 및 뇌신경 치료제 개발 등 글로벌 신약 연구에 새 패러다임을 열 것이다”고 말했다.
□ 그림 설명
그림1. 아세틸화 변형 조절 마우스 개발 및 아세틸화 제어 결과
그림2. 비정상적인 단백질 변형 및 각종 질병의 모식도
2017.03.06 조회수 22809 -
 효모 사용해 종양에 항암제 전달한다
〈 전 상 용 교수 〉
우리 대학 생명과학과 전상용 교수 연구팀과 GIST 생명과학부 전영수 교수 공동연구팀이 효모 기반의 바이오소재를 이용해 항암제를 표적 암에 효과적으로 전달할 수 있는 원천기술을 개발했다.
이번 연구결과는 지난해 12월 28일 미국학술원회보인 PNAS 온라인 판에 게재됐다.
이번 기술은 효모(yeast)에 존재하는 천연 소포체(vesicle)인 액포(vacuole)를 항암제를 전달하는 약물전달체로 이용했다. 동물 실험에서 높은 생체 적합성과 항암효능을 보여 기존 치료법의 대안이 될 것으로 기대된다.
약물전달시스템은 기존의 합성의약품 기반 항암 치료에 비해 독성을 크게 낮출 수 있다. 현재 美 식약청의 허가를 받아 치료에 사용되는 약물전달시스템은 리포좀(liposome) 제제와 알부민 나노입자(Abraxane)가 있다.
이러한 나노입자 기반 약물전달시스템은 특정 암을 표적해 치료하는 기술은 아니다. 따라서 최근에는 특정 암을 표적해 부작용을 낮추고 치료 효능은 개선시키는 표적형 약물전달시스템에 대한 연구가 활발히 진행 중이다.
그러나 대부분의 표적형 약물전달시스템은 고분자, 무기 나노입자같은 인공소재 기반이다. 인공소재들은 생체 적합성이 낮고 몸속에 장기간 남아 잠재적 독성을 유발할 수 있다는 한계를 갖는다.
연구팀은 문제 해결을 위해 빵, 맥주의 발효에 사용되는 효모를 이용했다. 효모 안의 소포체인 액포를 항암제 전달 소재로 사용했다.
연구팀은 기존 효모를 유전자변형 시켰다. 유방암에 결합가능한 표적 리간드(ligand)가 도입된 표적형 효모액포로 제조한 것이다.
여기에 항암제로 사용되는 독소루비신(Doxorubicin)을 표적형 효모액포에 선적해 약 100나노미터 직경을 갖는 암 치료용 표적형 약물전달시스템을 구축했다.
이 액포의 구성성분은 인간의 세포막에 존재하는 지질 성분들과 비슷해 암 세포와의 막융합이 수월하게 이뤄진다. 따라서 항암제를 암 세포 안으로 효과적으로 전달할 수 있고, 생체 적합성이 높아 안전한 약물전달시스템이 될 수 있다.
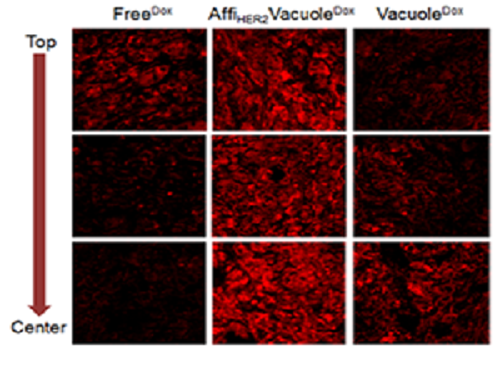
실제로 유방암 동물실험에서 표적형 효모액포 약물전달시스템은 기존 독소루비신 치료 그룹에 비해 약 3배 이상의 항암제를 암 조직에 전달해 우수한 치료 효능을 보였다.
이 기술을 통해 다른 생물체 기반의 나노 소포체를 이용한 약물전달시스템 개발에도 활용 가능할 것으로 기대된다.
전 교수는 “이 기술을 통해 생물체 유래 천연 나노 소포체가 약물전달시스템으로 개발될 것으로 보인다”며 “전임상 연구 및 임상 적용 가능성을 평가해 궁극적인 암 치료 방안 중 하나가 되기를 기대한다”고 말했다.
이번 연구는 한국연구재단의 글로벌프론티어 사업인 지능형바이오시스템 및 합성연구단과 광주과학기술원 실버헬스바이오연구센터의 실버헬스바이오기술개발사업의 지원으로 수행됐다.
□ 그림 설명
그림1. 표적형 효모액포를 정맥주사 한 후 6시간 뒤 암 조직으로의 약물분포 결과
그림2. 유방암 생쥐모델에서 독소루비신 항암제가 선적된 표적형 효모액포 약물전달시스템의 항암 결과
그림3. 최종 항암 치료용 표적형 약물전달시스템을 제조하는 모식도
2016.01.12 조회수 23126
효모 사용해 종양에 항암제 전달한다
〈 전 상 용 교수 〉
우리 대학 생명과학과 전상용 교수 연구팀과 GIST 생명과학부 전영수 교수 공동연구팀이 효모 기반의 바이오소재를 이용해 항암제를 표적 암에 효과적으로 전달할 수 있는 원천기술을 개발했다.
이번 연구결과는 지난해 12월 28일 미국학술원회보인 PNAS 온라인 판에 게재됐다.
이번 기술은 효모(yeast)에 존재하는 천연 소포체(vesicle)인 액포(vacuole)를 항암제를 전달하는 약물전달체로 이용했다. 동물 실험에서 높은 생체 적합성과 항암효능을 보여 기존 치료법의 대안이 될 것으로 기대된다.
약물전달시스템은 기존의 합성의약품 기반 항암 치료에 비해 독성을 크게 낮출 수 있다. 현재 美 식약청의 허가를 받아 치료에 사용되는 약물전달시스템은 리포좀(liposome) 제제와 알부민 나노입자(Abraxane)가 있다.
이러한 나노입자 기반 약물전달시스템은 특정 암을 표적해 치료하는 기술은 아니다. 따라서 최근에는 특정 암을 표적해 부작용을 낮추고 치료 효능은 개선시키는 표적형 약물전달시스템에 대한 연구가 활발히 진행 중이다.
그러나 대부분의 표적형 약물전달시스템은 고분자, 무기 나노입자같은 인공소재 기반이다. 인공소재들은 생체 적합성이 낮고 몸속에 장기간 남아 잠재적 독성을 유발할 수 있다는 한계를 갖는다.
연구팀은 문제 해결을 위해 빵, 맥주의 발효에 사용되는 효모를 이용했다. 효모 안의 소포체인 액포를 항암제 전달 소재로 사용했다.
연구팀은 기존 효모를 유전자변형 시켰다. 유방암에 결합가능한 표적 리간드(ligand)가 도입된 표적형 효모액포로 제조한 것이다.
여기에 항암제로 사용되는 독소루비신(Doxorubicin)을 표적형 효모액포에 선적해 약 100나노미터 직경을 갖는 암 치료용 표적형 약물전달시스템을 구축했다.
이 액포의 구성성분은 인간의 세포막에 존재하는 지질 성분들과 비슷해 암 세포와의 막융합이 수월하게 이뤄진다. 따라서 항암제를 암 세포 안으로 효과적으로 전달할 수 있고, 생체 적합성이 높아 안전한 약물전달시스템이 될 수 있다.
실제로 유방암 동물실험에서 표적형 효모액포 약물전달시스템은 기존 독소루비신 치료 그룹에 비해 약 3배 이상의 항암제를 암 조직에 전달해 우수한 치료 효능을 보였다.
이 기술을 통해 다른 생물체 기반의 나노 소포체를 이용한 약물전달시스템 개발에도 활용 가능할 것으로 기대된다.
전 교수는 “이 기술을 통해 생물체 유래 천연 나노 소포체가 약물전달시스템으로 개발될 것으로 보인다”며 “전임상 연구 및 임상 적용 가능성을 평가해 궁극적인 암 치료 방안 중 하나가 되기를 기대한다”고 말했다.
이번 연구는 한국연구재단의 글로벌프론티어 사업인 지능형바이오시스템 및 합성연구단과 광주과학기술원 실버헬스바이오연구센터의 실버헬스바이오기술개발사업의 지원으로 수행됐다.
□ 그림 설명
그림1. 표적형 효모액포를 정맥주사 한 후 6시간 뒤 암 조직으로의 약물분포 결과
그림2. 유방암 생쥐모델에서 독소루비신 항암제가 선적된 표적형 효모액포 약물전달시스템의 항암 결과
그림3. 최종 항암 치료용 표적형 약물전달시스템을 제조하는 모식도
2016.01.12 조회수 23126 -
 대장균 이용한 페놀 생산 성공
- 세계 최초로 대장균 이용해 리터당 3.8g의 페놀을 24시간 내 생산 성공 -
우리 학교 이상엽 특훈교수팀은 대장균을 이용해 재생 가능한 바이오매스로부터 페놀(phenol)을 생산하는 원천기술을 개발해 바이오테크놀로지(Biotechnology) 11일자 온라인판에 게재됐다.
이 기술은 친환경적인 미생물 발효 공정을 통해 화학물질을 생산하는 대사공학·공정 기술을 기반으로 개발돼 국내·외 생명공학 및 산업기술 발전에 크게 기여할 것으로 기대된다.
페놀은 석유화학공정을 통해 연간 800만 톤 이상 생산돼 폴리카보네이트, 에폭시, 제초제 등 다양한 산업에 폭넓게 사용되는 화학물질이다.
페놀이 갖고 있는 미생물에 대한 독성으로 인해 미생물을 이용한 페놀의 생산에 대한 연구는 그동안 어려움이 많아 생산량이 리터당 1g 미만 수준으로 더 이상의 향상이 이루어지지 못하고 있는 실정이었다.
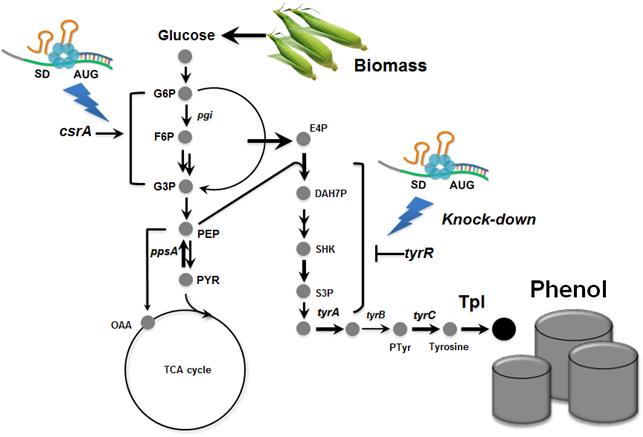
최근 다양한 대장균들의 유전적, 생리·대사적 차이점이 보고되고 있는데 이 교수 연구팀은 이에 주목해 18종의 다양한 대장균 균주에 대해 동시에 대사공학을 적용해 그 중 ‘BL21’ 이라는 대장균 균주가 페놀생산에 가장 적합하다는 것을 발견했다.
연구팀이 적용한 기술 중 ‘합성 조절 RNA 기술’은 기존의 유전자 결실 방법보다 월등히 빠른 시간에 대사흐름의 조절을 가능하게 하는 기술로써 이번 연구에서도 18종의 대장균에 대한 대사공학을 동시에 진행하는데 중요한 역할을 했다.
또 미생물을 이용한 페놀의 생산에 있어 가장 큰 걸림돌이 페놀의 독성인데 연구팀은 발효공정에서 페놀의 대장균에 대한 독성을 최소화 할 수 있는 이상발효 공정(biphasic fermentation)을 이용해 페놀의 생산량을 증가시킬 수 있었다.
이렇게 개발된 대장균 균주는 기존 균주에 비해 월등히 높은 생산량과 생산능력을 보였으며 이상 유가식 발효(biphasic fed-batch fermentation)에서 리터당 3.8g의 페놀을 24시간 내에 생산할 수 있었다.
즉, 대장균을 이용해 재생 가능한 바이오매스로부터 쉽게 얻어질 수 있는 포도당을 이용해 페놀을 생산할 수 있는 균주를 개발해 세계 최고의 페놀 생산능력을 보이는 균주를 개발했다.
김병진 박사는 “다양한 합성생물학 기술들을 기반으로 대장균을 개량해 페놀을 처음으로 생산했으며 가장 높은 농도와 생산성을 기록했다”며 “발효 공정의 개량을 통해 미생물에 독성을 지니는 화합물의 생산가능성을 보여줬다는데 커다란 의미가 있다”고 말했다.
KAIST 생명화학공학과 이상엽 특훈교수 지도하에 김병진 박사, 박혜권 연구원이 공동 1저자로 참여한 이번 연구는 미래창조과학부와 한국연구재단의 글로벌 프론티어사업 지능형 바이오시스템설계 및 합성연구단의 지원을 받아 수행됐다.
2013.10.30 조회수 21483
대장균 이용한 페놀 생산 성공
- 세계 최초로 대장균 이용해 리터당 3.8g의 페놀을 24시간 내 생산 성공 -
우리 학교 이상엽 특훈교수팀은 대장균을 이용해 재생 가능한 바이오매스로부터 페놀(phenol)을 생산하는 원천기술을 개발해 바이오테크놀로지(Biotechnology) 11일자 온라인판에 게재됐다.
이 기술은 친환경적인 미생물 발효 공정을 통해 화학물질을 생산하는 대사공학·공정 기술을 기반으로 개발돼 국내·외 생명공학 및 산업기술 발전에 크게 기여할 것으로 기대된다.
페놀은 석유화학공정을 통해 연간 800만 톤 이상 생산돼 폴리카보네이트, 에폭시, 제초제 등 다양한 산업에 폭넓게 사용되는 화학물질이다.
페놀이 갖고 있는 미생물에 대한 독성으로 인해 미생물을 이용한 페놀의 생산에 대한 연구는 그동안 어려움이 많아 생산량이 리터당 1g 미만 수준으로 더 이상의 향상이 이루어지지 못하고 있는 실정이었다.
최근 다양한 대장균들의 유전적, 생리·대사적 차이점이 보고되고 있는데 이 교수 연구팀은 이에 주목해 18종의 다양한 대장균 균주에 대해 동시에 대사공학을 적용해 그 중 ‘BL21’ 이라는 대장균 균주가 페놀생산에 가장 적합하다는 것을 발견했다.
연구팀이 적용한 기술 중 ‘합성 조절 RNA 기술’은 기존의 유전자 결실 방법보다 월등히 빠른 시간에 대사흐름의 조절을 가능하게 하는 기술로써 이번 연구에서도 18종의 대장균에 대한 대사공학을 동시에 진행하는데 중요한 역할을 했다.
또 미생물을 이용한 페놀의 생산에 있어 가장 큰 걸림돌이 페놀의 독성인데 연구팀은 발효공정에서 페놀의 대장균에 대한 독성을 최소화 할 수 있는 이상발효 공정(biphasic fermentation)을 이용해 페놀의 생산량을 증가시킬 수 있었다.
이렇게 개발된 대장균 균주는 기존 균주에 비해 월등히 높은 생산량과 생산능력을 보였으며 이상 유가식 발효(biphasic fed-batch fermentation)에서 리터당 3.8g의 페놀을 24시간 내에 생산할 수 있었다.
즉, 대장균을 이용해 재생 가능한 바이오매스로부터 쉽게 얻어질 수 있는 포도당을 이용해 페놀을 생산할 수 있는 균주를 개발해 세계 최고의 페놀 생산능력을 보이는 균주를 개발했다.
김병진 박사는 “다양한 합성생물학 기술들을 기반으로 대장균을 개량해 페놀을 처음으로 생산했으며 가장 높은 농도와 생산성을 기록했다”며 “발효 공정의 개량을 통해 미생물에 독성을 지니는 화합물의 생산가능성을 보여줬다는데 커다란 의미가 있다”고 말했다.
KAIST 생명화학공학과 이상엽 특훈교수 지도하에 김병진 박사, 박혜권 연구원이 공동 1저자로 참여한 이번 연구는 미래창조과학부와 한국연구재단의 글로벌 프론티어사업 지능형 바이오시스템설계 및 합성연구단의 지원을 받아 수행됐다.
2013.10.30 조회수 21483