-
 장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.07.01
조회수 355
-
 면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
2025.04.08
조회수 2864
-
 ‘카이랄 나노 페인트’ 기술로 항암, 코로나 치료 혁신
기존의 의료용 나노 소재는 체내에서 잘 전달되지 않거나 쉽게 분해되는 문제가 있었다. 우리 연구진은 카이랄 나노 페인트 기술로 의료용 나노 소재에 카이랄성을 부여한 자성 나노 입자를 개발했다. 그 결과 항암 온열 치료 효과가 기존보다 4배 이상 향상됐고, 약물 전달 시스템에도 적용하여 코로나 19 백신 등 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다.
신소재공학과 염지현 교수 연구팀이 바이오 나노 소재의 표면에 카이랄성*을 부여할 수 있는 ‘카이랄 나노 페인트’기술을 최초로 개발했고 후속 연구로 생명과학과 정현정 교수팀과 함께 mRNA를 전달하는 지질전달체** 표면에도 성공적으로 도입했다고 19일 밝혔다. 이 연구들은 각각 국제 학술지 ACS Nano와 ACS Applied Materials & Interfaces 에 게재됐다.
*카이랄성(Chirality): 카이랄성은 물체가 거울에 비친 모습과 겹치지 않는 성질을 의미함. 우리 몸에서도 카이랄성을 가진 분자들이 특정한 방식으로 작용하는데, 연구팀은 이를 활용해 나노 소재의 성능을 개선함
**지질전달체(Lipid Nanoparticle, LNP): mRNA, 유전자, 약물 등의 생체물질을 감싸서 세포 내부로 안전하게 전달하는 나노입자임. mRNA 백신(예: 코로나19 백신)과 같은 유전자 치료제에서 중요한 역할을 함.
염지현 교수 연구팀은 우리 몸은 왼손잡이(L-형)와 오른손잡이(D-형) 구조를 가진 분자들이 서로 다르게 작용하는 카이랄 선택성(Chiral Selectivity)에 주목하고 나노 소재의 표면에 ‘카이랄 나노 페인트’를 적용해 카이랄성을 부여하는 기술을 개발했다. 이를 통해 십수 나노미터(nm) 크기의 작은 나노 입자부터 수 마이크로미터 (μm) 크기의 큰 마이크로 구조체까지 다양한 크기의 소재에 카이랄성을 입히는 데 성공했다.
연구팀은 더 나아가 카이랄 나노 페인트 기술을 활용해 카이랄 자성 나노 입자를 합성하고, 이를 종양에 주입한 뒤 자기장 처리로 생성되는 열을 통해 종양 조직을 괴사시키는 항암 온열 치료 기술을 선보였다.
이 과정에서 D-카이랄성을 가진 자성 나노 입자가 L-카이랄성을 가진 자성 나노 입자보다 암세포에 더 많이 흡수되고, 그 결과 4배 이상 향상된 항암 치료 효과가 있음을 증명했다.
이와 같은 암세포 내부로의 흡수 효율 및 항암 치료 효율의 차이가 나노 입자 표면에 처리된 카이랄 나노 페인트와 세포 표면의 수용체 간의 ‘카이랄 선택적 상호작용’에 의한 것임을 컴퓨터 시뮬레이션과 세포 실험을 통해 밝혔다.
향후, 카이랄 나노 페인트 기술은 의료용 바이오 소재를 비롯해 차세대 약물 전달 시스템, 바이오 센서, 촉매 및 나노 효소 등 다양한 분야에 응용될 것으로 기대된다.
신소재공학과 정욱진 석박사통합과정 학생이 제1 저자인 이번 연구 결과는 지난 3월 2일 국제 학술지 ‘에이씨에스 나노(ACS Nano)’에 온라인 게재됐다. (논문명: Universal Chiral Nanopaint for Metal Oxide Biomaterials) DOI: 10.1021/acsnano.4c14460
후속 연구로 mRNA를 전달하는 지질전달체 표면에 카이랄 페인트 기술을 도입했다. mRNA 기반 치료제는 세포 내에서 단백질을 직접 합성할 수 있도록 유전 정보를 전달하는 방식이지만, 전달체의 불안정성으로 인해 치료 효과가 제한적이었다.
카이랄 나노 페인트 기술은 이러한 문제를 해결하여 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다. 그 결과, D-카이랄성 페인트를 도입한 지질전달체를 사용한 경우 mRNA의 세포 내 발현을 2배 이상 안정적으로 증가시켰다.
이 연구는 생명과학과 이주희 연구원과 신소재공학과 정욱진 박사과정 학생이 공동 1 저자로 국제 학술지 ‘에이씨에스 응용 재료 및 인터페이스(ACS Applied Materials & Interfaces)’에 3월 17일 게재됐다. (논문명: Chirality-controlled Lipid Nanoparticles for mRNA Delivery, DOI: https://doi.org/10.1021/acsami.5c00920)
염지현 교수는 “이번 연구를 통해 바이오 나노 소재의 성능을 크게 향상시키고 다양한 크기 및 모양을 가진 혁신적 나노 소재 합성 방법론을 제시했다. 앞으로는 이러한 카이랄 나노 소재를 활용해 암, 코로나 등 다양한 질병을 예방하는 백신부터 진단 및 치료하는 차세대 바이오 플랫폼 개발 및 연구를 지속할 계획”이라고 설명했다.
이번 연구는 과학기술정보통신부의 재원으로 범부처전주기의료기기연구개발사업단, 연구재단 우수신진사업 등의 지원을 받아 수행됐다.
‘카이랄 나노 페인트’ 기술로 항암, 코로나 치료 혁신
기존의 의료용 나노 소재는 체내에서 잘 전달되지 않거나 쉽게 분해되는 문제가 있었다. 우리 연구진은 카이랄 나노 페인트 기술로 의료용 나노 소재에 카이랄성을 부여한 자성 나노 입자를 개발했다. 그 결과 항암 온열 치료 효과가 기존보다 4배 이상 향상됐고, 약물 전달 시스템에도 적용하여 코로나 19 백신 등 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다.
신소재공학과 염지현 교수 연구팀이 바이오 나노 소재의 표면에 카이랄성*을 부여할 수 있는 ‘카이랄 나노 페인트’기술을 최초로 개발했고 후속 연구로 생명과학과 정현정 교수팀과 함께 mRNA를 전달하는 지질전달체** 표면에도 성공적으로 도입했다고 19일 밝혔다. 이 연구들은 각각 국제 학술지 ACS Nano와 ACS Applied Materials & Interfaces 에 게재됐다.
*카이랄성(Chirality): 카이랄성은 물체가 거울에 비친 모습과 겹치지 않는 성질을 의미함. 우리 몸에서도 카이랄성을 가진 분자들이 특정한 방식으로 작용하는데, 연구팀은 이를 활용해 나노 소재의 성능을 개선함
**지질전달체(Lipid Nanoparticle, LNP): mRNA, 유전자, 약물 등의 생체물질을 감싸서 세포 내부로 안전하게 전달하는 나노입자임. mRNA 백신(예: 코로나19 백신)과 같은 유전자 치료제에서 중요한 역할을 함.
염지현 교수 연구팀은 우리 몸은 왼손잡이(L-형)와 오른손잡이(D-형) 구조를 가진 분자들이 서로 다르게 작용하는 카이랄 선택성(Chiral Selectivity)에 주목하고 나노 소재의 표면에 ‘카이랄 나노 페인트’를 적용해 카이랄성을 부여하는 기술을 개발했다. 이를 통해 십수 나노미터(nm) 크기의 작은 나노 입자부터 수 마이크로미터 (μm) 크기의 큰 마이크로 구조체까지 다양한 크기의 소재에 카이랄성을 입히는 데 성공했다.
연구팀은 더 나아가 카이랄 나노 페인트 기술을 활용해 카이랄 자성 나노 입자를 합성하고, 이를 종양에 주입한 뒤 자기장 처리로 생성되는 열을 통해 종양 조직을 괴사시키는 항암 온열 치료 기술을 선보였다.
이 과정에서 D-카이랄성을 가진 자성 나노 입자가 L-카이랄성을 가진 자성 나노 입자보다 암세포에 더 많이 흡수되고, 그 결과 4배 이상 향상된 항암 치료 효과가 있음을 증명했다.
이와 같은 암세포 내부로의 흡수 효율 및 항암 치료 효율의 차이가 나노 입자 표면에 처리된 카이랄 나노 페인트와 세포 표면의 수용체 간의 ‘카이랄 선택적 상호작용’에 의한 것임을 컴퓨터 시뮬레이션과 세포 실험을 통해 밝혔다.
향후, 카이랄 나노 페인트 기술은 의료용 바이오 소재를 비롯해 차세대 약물 전달 시스템, 바이오 센서, 촉매 및 나노 효소 등 다양한 분야에 응용될 것으로 기대된다.
신소재공학과 정욱진 석박사통합과정 학생이 제1 저자인 이번 연구 결과는 지난 3월 2일 국제 학술지 ‘에이씨에스 나노(ACS Nano)’에 온라인 게재됐다. (논문명: Universal Chiral Nanopaint for Metal Oxide Biomaterials) DOI: 10.1021/acsnano.4c14460
후속 연구로 mRNA를 전달하는 지질전달체 표면에 카이랄 페인트 기술을 도입했다. mRNA 기반 치료제는 세포 내에서 단백질을 직접 합성할 수 있도록 유전 정보를 전달하는 방식이지만, 전달체의 불안정성으로 인해 치료 효과가 제한적이었다.
카이랄 나노 페인트 기술은 이러한 문제를 해결하여 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다. 그 결과, D-카이랄성 페인트를 도입한 지질전달체를 사용한 경우 mRNA의 세포 내 발현을 2배 이상 안정적으로 증가시켰다.
이 연구는 생명과학과 이주희 연구원과 신소재공학과 정욱진 박사과정 학생이 공동 1 저자로 국제 학술지 ‘에이씨에스 응용 재료 및 인터페이스(ACS Applied Materials & Interfaces)’에 3월 17일 게재됐다. (논문명: Chirality-controlled Lipid Nanoparticles for mRNA Delivery, DOI: https://doi.org/10.1021/acsami.5c00920)
염지현 교수는 “이번 연구를 통해 바이오 나노 소재의 성능을 크게 향상시키고 다양한 크기 및 모양을 가진 혁신적 나노 소재 합성 방법론을 제시했다. 앞으로는 이러한 카이랄 나노 소재를 활용해 암, 코로나 등 다양한 질병을 예방하는 백신부터 진단 및 치료하는 차세대 바이오 플랫폼 개발 및 연구를 지속할 계획”이라고 설명했다.
이번 연구는 과학기술정보통신부의 재원으로 범부처전주기의료기기연구개발사업단, 연구재단 우수신진사업 등의 지원을 받아 수행됐다.
2025.03.19
조회수 4620
-
 항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.12.11
조회수 4839
-
 난치성 뇌종양 치료의 새로운 가능성 열다
면역항암제는 암세포를 제거하는 T세포의 항암 면역작용을 강화하는 가장 주목받는 항암치료 요법이다. 하지만 난치성 뇌종양인 교모세포종의 경우 면역관문억제제를 활용한 수차례 임상시험에서 그 효과를 확인할 수 없었다. 우리 연구진이 난치성 암종에서 T세포가 만성적 항원에 노출되어 기능이 상실되거나 약화된 원인을 분석하여 T세포 활성 제어 인자를 발굴하고 치료 효능 증진 원리를 규명했다.
우리 대학 생명과학과 이흥규 교수 연구팀이 한국화학연구원(원장 이영국) 감염병예방진단기술연구센터와 협력하여, 교모세포종 실험 쥐 모델에서 억제성 Fc 감마수용체(FcγRIIB)의 결손을 통한 면역관문억제제의 세포독성 T세포 불응성을 회복해, 항암 작용 증대를 유도함으로 생존율 개선 효능을 확인했다고 6일 밝혔다.
연구팀은 최근 세포독성 T세포에서 발견된 억제 수용체(FcγRIIB)가 종양 침윤 세포독성 T세포의 특성과 면역관문억제제(항 PD-1)의 치료 효능에 미치는 영향을 확인했다.
연구 결과, 억제 수용체(FcγRIIB)가 결손되었을때 종양항원 특이적 기억 T세포의 증가를 유도했다. 이 같은 T세포 아형은 탈진화를 억제하고 줄기세포 특성을 강화했고, 이를 통한 항 PD-1 치료의 회복된 T세포 항암 면역반응을 이끌었다. 또한, 연구팀은 항원 특이적 기억 T세포가 FcγRIIB 결손 시 상대적으로 높은 수의 증가와 함께 지속적인 종양 조직 내 T세포 침투를 이끈다는 결과를 확인했다.
해당 연구는 면역관문억제제에 불응성을 보이는 종양에 대한 새로운 치료 타깃을 제시했으며, 특히 교모세포종과 같은 항 PD-1 치료에 반응하지 않는 종양에 FcγRIIB 억제와 항 PD-1 치료를 병행함으로써 시너지 효과를 발휘할 수 있음을 증명했다.
연구팀은 이러한 FcγRIIB 억제를 통한 항암 면역작용 증진 전략이 면역관문억제제의 효능을 높이는 데 중요한 기여를 할 것으로 기대하고 있다.
생명과학과 이흥규 교수는 “면역관문 치료제를 이용한 뇌종양 치료 임상 실패를 극복할 가능성과 다른 난치성 종양으로의 범용적 적용 가능성을 제시한 결과로 추후 세포독성 T 세포의 종양 세포치료 활용과 접근 가능성도 확인한 결과”라고 소개했다.
우리 대학 구근본 박사(現, 한국화학연구원 감염병예방진단기술연구센터 선임연구원)가 제1 저자로 참여한 이번 연구는 암 면역치료 학회(Society for Immunotherapy of Cancer)에서 발간하는 종양면역 및 치료 분야 국제 학술지 `Journal for ImmunoTherapy of Cancer'에 10월 26일 온라인판에 게재됐다. (논문명: Inhibitory Fcγ receptor deletion enhances CD8 T cell stemness increasing anti-PD-1 therapy responsiveness against glioblastoma, http://dx.doi.org/10.1136/jitc-2024-009449)
한편 이번 연구는 한국연구재단 개인기초연구사업, 바이오의료기술개발사업 및 삼성미래육성재단의 지원을 받아 수행됐다.
난치성 뇌종양 치료의 새로운 가능성 열다
면역항암제는 암세포를 제거하는 T세포의 항암 면역작용을 강화하는 가장 주목받는 항암치료 요법이다. 하지만 난치성 뇌종양인 교모세포종의 경우 면역관문억제제를 활용한 수차례 임상시험에서 그 효과를 확인할 수 없었다. 우리 연구진이 난치성 암종에서 T세포가 만성적 항원에 노출되어 기능이 상실되거나 약화된 원인을 분석하여 T세포 활성 제어 인자를 발굴하고 치료 효능 증진 원리를 규명했다.
우리 대학 생명과학과 이흥규 교수 연구팀이 한국화학연구원(원장 이영국) 감염병예방진단기술연구센터와 협력하여, 교모세포종 실험 쥐 모델에서 억제성 Fc 감마수용체(FcγRIIB)의 결손을 통한 면역관문억제제의 세포독성 T세포 불응성을 회복해, 항암 작용 증대를 유도함으로 생존율 개선 효능을 확인했다고 6일 밝혔다.
연구팀은 최근 세포독성 T세포에서 발견된 억제 수용체(FcγRIIB)가 종양 침윤 세포독성 T세포의 특성과 면역관문억제제(항 PD-1)의 치료 효능에 미치는 영향을 확인했다.
연구 결과, 억제 수용체(FcγRIIB)가 결손되었을때 종양항원 특이적 기억 T세포의 증가를 유도했다. 이 같은 T세포 아형은 탈진화를 억제하고 줄기세포 특성을 강화했고, 이를 통한 항 PD-1 치료의 회복된 T세포 항암 면역반응을 이끌었다. 또한, 연구팀은 항원 특이적 기억 T세포가 FcγRIIB 결손 시 상대적으로 높은 수의 증가와 함께 지속적인 종양 조직 내 T세포 침투를 이끈다는 결과를 확인했다.
해당 연구는 면역관문억제제에 불응성을 보이는 종양에 대한 새로운 치료 타깃을 제시했으며, 특히 교모세포종과 같은 항 PD-1 치료에 반응하지 않는 종양에 FcγRIIB 억제와 항 PD-1 치료를 병행함으로써 시너지 효과를 발휘할 수 있음을 증명했다.
연구팀은 이러한 FcγRIIB 억제를 통한 항암 면역작용 증진 전략이 면역관문억제제의 효능을 높이는 데 중요한 기여를 할 것으로 기대하고 있다.
생명과학과 이흥규 교수는 “면역관문 치료제를 이용한 뇌종양 치료 임상 실패를 극복할 가능성과 다른 난치성 종양으로의 범용적 적용 가능성을 제시한 결과로 추후 세포독성 T 세포의 종양 세포치료 활용과 접근 가능성도 확인한 결과”라고 소개했다.
우리 대학 구근본 박사(現, 한국화학연구원 감염병예방진단기술연구센터 선임연구원)가 제1 저자로 참여한 이번 연구는 암 면역치료 학회(Society for Immunotherapy of Cancer)에서 발간하는 종양면역 및 치료 분야 국제 학술지 `Journal for ImmunoTherapy of Cancer'에 10월 26일 온라인판에 게재됐다. (논문명: Inhibitory Fcγ receptor deletion enhances CD8 T cell stemness increasing anti-PD-1 therapy responsiveness against glioblastoma, http://dx.doi.org/10.1136/jitc-2024-009449)
한편 이번 연구는 한국연구재단 개인기초연구사업, 바이오의료기술개발사업 및 삼성미래육성재단의 지원을 받아 수행됐다.
2024.11.06
조회수 5839
-
 간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
2024.08.08
조회수 5305
-
 종양모델 칩으로 다조건 항암제 동시 평가
실제 인체에 항암제가 투여되면 약물 분자는 혈류를 따라 수송된다. 이 약물 분자들은 혈관 벽을 투과하고 확산한다. 확산한 분자는 종양 덩어리 내부까지 점차 침투해 약물 효능이 나타나게 된다. 우리 연구진이 바이오프린팅 기술로 36가지의 종양 미세환경을 유체채널 내부에 모사하여 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는데 성공하여 화제다.
우리 대학 바이오및뇌공학과 박제균 교수 연구팀이 기존 바이오프린팅* 및 랩온어칩** 기술의 한계점을 극복하고 장점을 극대화하여 복잡한 종양 미세환경이 구현된 랩온어칩을 개발하여 여러 분석 변수가 반영된 약물 스크리닝을 수행하는 데 성공했다고 16일 밝혔다.
* 바이오프린팅(bioprinting): 세포와 생체재료로 구성된 바이오 잉크를 활용하여 생체조직 및 기관과 유사한 기능적 구조물을 제작하는 3D 프린팅 기술
** 랩온어칩(lab-on-a-chip): “칩 위의 실험실”이란 개념을 갖고 있으며 각종 시료분석에 필요한 전처리, 분리, 희석, 혼합, 반응, 검출 기능 등을 미세유체 회로로 이루어진 채널 내에서 일괄적으로 수행할 수 있도록 만들어진 미세유체 소자 및 시스템
바이오프린팅은 조직이나 장기의 복잡한 형상과 조성을 체외환경에서 재현할 수 있는 생체모사 기술이지만, 제작된 생체모델의 배양 환경 제어와 분석이 어렵다. 반면, 랩온어칩은 미세 유체채널 내에서의 유체 제어 기술에 기반해 배양 환경의 정교한 제어와 다양한 분석 수행이 가능하지만, 미세한 유체 통로 내부에 생체 환경을 모사하는 데 한계가 있었다.
연구진은 바이오프린팅 기술로 서로 다른 조성으로 구성된 총 36개의 종양 모델을 랩온어칩 내에 형성한 후, 동일한 소자 내에서 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는 데 성공했다.
연구팀은 바이오프린팅의 우수한 공간적 자유도와 다양한 생체재료를 활용할 수 있다는 장점을 이용해, 세 가지 서로 다른 조성으로 이루어진 36개의 종양 모델을 하나의 미세 유체소자에 집적시켰다. 세포를 유동 배양해 물질 수송에 핵심 구조물인 혈관 벽과 종양 덩어리를 모사하여 네 가지 농도의 항암제를 종양 모델에 유입함으로써, 하나의 소자에서 12가지 실험 조건의 약물 평가를 수행했다.
또한 연구팀은 혈관 벽에 의해 약물 분자의 수송이 저해되고 종양 덩어리 내부까지 침투되는 현상을 관찰할 수 있었고, 체내 수송 과정을 모사하지 못했던 기존 종양 모델과 약물 효능에 큰 차이를 보인다는 것을 확인했다.
이처럼 바이오프린팅-랩온어칩 통합기술을 활용해 모델 복잡성, 모델 수, 모델 처리량 등 다양한 변수를 고려한 체외 종양 모델을 제작할 수 있었고, 더욱 신뢰성 있는 약물 평가를 수행할 수 있었다.
연구를 주도한 박제균 교수는 “바이오프린팅과 랩온어칩의 통합기술로 제작된 미세 유체 세포배양 및 분석 플랫폼의 개발에 따른 신뢰성 있는 약물 평가 모델에 대한 성과”임을 강조하며, “향후 다양한 조직 및 장기 특성을 모사하고 생물학적 분석과 약물 효능 평가를 고효율로 수행할 수 있는 동물실험 대체용 차세대 체외 세포배양 및 분석 기술로 활용될 수 있을 것”이라고 말했다.
바이오및뇌공학과 이기현 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 '어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)'에 2024년 6월 3일 자로 온라인판에 게재됐다.
(https://doi.org/10.1002/adhm.202303716. 논문명: Bioprinted multi-composition array mimicking tumor microenvironment to evaluate drug efficacy with multivariable analysis).
또한, 이번 논문은 와일리-VCH(Wiley-VCH) 출판사의 ‘핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)’세션과 ‘핫 토픽: 미세유체공학(Hot Topic: Microfluidics)’세션에 동시 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
종양모델 칩으로 다조건 항암제 동시 평가
실제 인체에 항암제가 투여되면 약물 분자는 혈류를 따라 수송된다. 이 약물 분자들은 혈관 벽을 투과하고 확산한다. 확산한 분자는 종양 덩어리 내부까지 점차 침투해 약물 효능이 나타나게 된다. 우리 연구진이 바이오프린팅 기술로 36가지의 종양 미세환경을 유체채널 내부에 모사하여 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는데 성공하여 화제다.
우리 대학 바이오및뇌공학과 박제균 교수 연구팀이 기존 바이오프린팅* 및 랩온어칩** 기술의 한계점을 극복하고 장점을 극대화하여 복잡한 종양 미세환경이 구현된 랩온어칩을 개발하여 여러 분석 변수가 반영된 약물 스크리닝을 수행하는 데 성공했다고 16일 밝혔다.
* 바이오프린팅(bioprinting): 세포와 생체재료로 구성된 바이오 잉크를 활용하여 생체조직 및 기관과 유사한 기능적 구조물을 제작하는 3D 프린팅 기술
** 랩온어칩(lab-on-a-chip): “칩 위의 실험실”이란 개념을 갖고 있으며 각종 시료분석에 필요한 전처리, 분리, 희석, 혼합, 반응, 검출 기능 등을 미세유체 회로로 이루어진 채널 내에서 일괄적으로 수행할 수 있도록 만들어진 미세유체 소자 및 시스템
바이오프린팅은 조직이나 장기의 복잡한 형상과 조성을 체외환경에서 재현할 수 있는 생체모사 기술이지만, 제작된 생체모델의 배양 환경 제어와 분석이 어렵다. 반면, 랩온어칩은 미세 유체채널 내에서의 유체 제어 기술에 기반해 배양 환경의 정교한 제어와 다양한 분석 수행이 가능하지만, 미세한 유체 통로 내부에 생체 환경을 모사하는 데 한계가 있었다.
연구진은 바이오프린팅 기술로 서로 다른 조성으로 구성된 총 36개의 종양 모델을 랩온어칩 내에 형성한 후, 동일한 소자 내에서 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는 데 성공했다.
연구팀은 바이오프린팅의 우수한 공간적 자유도와 다양한 생체재료를 활용할 수 있다는 장점을 이용해, 세 가지 서로 다른 조성으로 이루어진 36개의 종양 모델을 하나의 미세 유체소자에 집적시켰다. 세포를 유동 배양해 물질 수송에 핵심 구조물인 혈관 벽과 종양 덩어리를 모사하여 네 가지 농도의 항암제를 종양 모델에 유입함으로써, 하나의 소자에서 12가지 실험 조건의 약물 평가를 수행했다.
또한 연구팀은 혈관 벽에 의해 약물 분자의 수송이 저해되고 종양 덩어리 내부까지 침투되는 현상을 관찰할 수 있었고, 체내 수송 과정을 모사하지 못했던 기존 종양 모델과 약물 효능에 큰 차이를 보인다는 것을 확인했다.
이처럼 바이오프린팅-랩온어칩 통합기술을 활용해 모델 복잡성, 모델 수, 모델 처리량 등 다양한 변수를 고려한 체외 종양 모델을 제작할 수 있었고, 더욱 신뢰성 있는 약물 평가를 수행할 수 있었다.
연구를 주도한 박제균 교수는 “바이오프린팅과 랩온어칩의 통합기술로 제작된 미세 유체 세포배양 및 분석 플랫폼의 개발에 따른 신뢰성 있는 약물 평가 모델에 대한 성과”임을 강조하며, “향후 다양한 조직 및 장기 특성을 모사하고 생물학적 분석과 약물 효능 평가를 고효율로 수행할 수 있는 동물실험 대체용 차세대 체외 세포배양 및 분석 기술로 활용될 수 있을 것”이라고 말했다.
바이오및뇌공학과 이기현 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 '어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)'에 2024년 6월 3일 자로 온라인판에 게재됐다.
(https://doi.org/10.1002/adhm.202303716. 논문명: Bioprinted multi-composition array mimicking tumor microenvironment to evaluate drug efficacy with multivariable analysis).
또한, 이번 논문은 와일리-VCH(Wiley-VCH) 출판사의 ‘핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)’세션과 ‘핫 토픽: 미세유체공학(Hot Topic: Microfluidics)’세션에 동시 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
2024.07.16
조회수 6210
-
 암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
2024.04.08
조회수 9528
-
 항암 효과 낮추는 ‘세포 간 이질성’ 극복 전략 찾았다
효과가 높은 신약 및 치료법 개발을 위한 단서가 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원(IBS) 수리 및 계산 과학 연구단 의생명 수학 그룹 CI(Chief Investigator)) 연구팀은 인공지능(AI)을 이용해 동일 외부 자극에 개별 세포마다 반응하는 정도가 다른 ‘세포 간 이질성’의 근본적인 원인을 찾아내고, 이질성을 최소화할 수 있는 전략을 제시했다.
우리 몸속 세포는 약물, 삼투압 변화 등 다양한 외부 자극에 반응하는 신호 전달 체계(signaling pathway)가 있다. 신호 전달 체계는 세포가 외부 환경과 상호작용하며 생존하는 데 핵심적인 역할을 한다. 세포의 신호 전달 체계는 노벨생리의학상의 단골 주제일 정도로 중요하지만, 규명을 위해서는 수십 년에 걸친 연구가 필요하다.
신호 전달 체계는 세포 간 이질성에도 영향을 미친다. 세포 간 이질성은 똑같은 유전자를 가진 세포들이 동일 외부 자극에 다르게 반응하는 정도를 뜻한다. 하지만 복잡한 신호 전달 체계의 전 과정을 직접 관측하는 일이 현재 기술로는 어렵기 때문에 지금까지는 신호 전달 체계와 세포 간 이질성의 명확한 연결고리를 알지 못했다.
세포 간 이질성은 질병 치료에 있어 더욱 중요한 고려 요소다. 가령, 항암제를 투여했을 때 세포 간 이질성으로 인해 일부 암세포만 사멸되고, 일부는 살아남는다면 완치가 되지 않는다. 세포 간 이질성의 근본적인 원인을 찾고, 이질성을 최소화할 수 있는 전략을 도출해야 치료 효과를 높인 신약 설계가 가능해진다.
제1 저자인 홍혁표 IBS 전(前) 학생연수원(現 미국 위스콘신 메디슨대 방문조교수)은 “우리 연구진은 선행 연구(Science Advances, 2022)에서 세포 내 신호 전달 체계를 묘사한 수리 모델을 개발한 바 있다”며 “당시엔 신호 전달 체계의 중간 과정이 한 개의 경로만 있다고 가정해 얻을 수 있는 정보도 한계가 있었지만, 이번 연구에서는 AI를 활용해 중간 과정의 비밀까지 풀어냈다”고 말했다.
연구진은 기계 학습 방법론인 ‘Density-PINNs(Density Physics-Informed Neural Networks)’를 개발해 신호 전달 체계와 세포 간 이질성의 연결고리를 찾았다. 세포가 외부 자극에 노출되면 신호 전달 체계를 거쳐 반응 단백질이 생성된다. 시간에 따라 축적된 반응 단백질의 양을 이용하면 신호 전달 소요 시간의 분포를 추론할 수 있다. 이 분포는 신호 전달 체계가 몇 개의 경로로 구성됐는지를 알려준다. 즉, Density-PINNs를 이용하면 쉽게 관측할 수 있는 반응 단백질의 시계열 데이터로부터 직접 관찰하기 어려운 신호 전달 체계에 대한 정보를 추정할 수 있다는 의미다.
이어 연구진은 실제 대장균의 항생제에 대한 반응 실험 데이터에 Density-PINNs를 적용하여 세포 간 이질성의 원인도 찾았다. 신호 전달 체계가 단일 경로로 이뤄진 때(직렬)에 비해 여러 경로로 이뤄졌을 때(병렬)가 세포 간 이질성이 적다는 것을 알아냈다.
제1 저자인 조현태 연구원은 “추가 연구가 필요하지만, 신호 전달 체계가 병렬 구조일 경우 극단적인 신호가 서로 상쇄되어서 세포 간 이질성이 적어지는 것으로 보인다”며 “신호 전달 체계가 병렬 구조를 보이도록 약물이나 화학 요법 치료 전략을 세우면 치료 효과를 높일 수 있다는 의미”라고 설명했다.
연구를 이끈 김재경 교수는 “복잡한 세포 신호 전달 체계의 전 과정을 파악하려면 수십 년의 연구가 필요하지만, 우리 연구진이 제시한 방법론은 수 시간 내에 치료에 필요한 핵심 정보만 알아내 치료에 활용할 수 있다”며 “이번 연구를 실제 현장에서 사용되는 약물에 적용하여 치료 효과를 개선할 수 있기를 기대한다”고 말했다.
연구 결과는 지난해 12월 26일 국제학술지 셀(Cell)의 자매지인 ‘패턴스(Patterns)’에 실렸다.
※ 논문명: Density physics-informed neural networks reveal sources of cell heterogeneity in signal transduction
항암 효과 낮추는 ‘세포 간 이질성’ 극복 전략 찾았다
효과가 높은 신약 및 치료법 개발을 위한 단서가 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원(IBS) 수리 및 계산 과학 연구단 의생명 수학 그룹 CI(Chief Investigator)) 연구팀은 인공지능(AI)을 이용해 동일 외부 자극에 개별 세포마다 반응하는 정도가 다른 ‘세포 간 이질성’의 근본적인 원인을 찾아내고, 이질성을 최소화할 수 있는 전략을 제시했다.
우리 몸속 세포는 약물, 삼투압 변화 등 다양한 외부 자극에 반응하는 신호 전달 체계(signaling pathway)가 있다. 신호 전달 체계는 세포가 외부 환경과 상호작용하며 생존하는 데 핵심적인 역할을 한다. 세포의 신호 전달 체계는 노벨생리의학상의 단골 주제일 정도로 중요하지만, 규명을 위해서는 수십 년에 걸친 연구가 필요하다.
신호 전달 체계는 세포 간 이질성에도 영향을 미친다. 세포 간 이질성은 똑같은 유전자를 가진 세포들이 동일 외부 자극에 다르게 반응하는 정도를 뜻한다. 하지만 복잡한 신호 전달 체계의 전 과정을 직접 관측하는 일이 현재 기술로는 어렵기 때문에 지금까지는 신호 전달 체계와 세포 간 이질성의 명확한 연결고리를 알지 못했다.
세포 간 이질성은 질병 치료에 있어 더욱 중요한 고려 요소다. 가령, 항암제를 투여했을 때 세포 간 이질성으로 인해 일부 암세포만 사멸되고, 일부는 살아남는다면 완치가 되지 않는다. 세포 간 이질성의 근본적인 원인을 찾고, 이질성을 최소화할 수 있는 전략을 도출해야 치료 효과를 높인 신약 설계가 가능해진다.
제1 저자인 홍혁표 IBS 전(前) 학생연수원(現 미국 위스콘신 메디슨대 방문조교수)은 “우리 연구진은 선행 연구(Science Advances, 2022)에서 세포 내 신호 전달 체계를 묘사한 수리 모델을 개발한 바 있다”며 “당시엔 신호 전달 체계의 중간 과정이 한 개의 경로만 있다고 가정해 얻을 수 있는 정보도 한계가 있었지만, 이번 연구에서는 AI를 활용해 중간 과정의 비밀까지 풀어냈다”고 말했다.
연구진은 기계 학습 방법론인 ‘Density-PINNs(Density Physics-Informed Neural Networks)’를 개발해 신호 전달 체계와 세포 간 이질성의 연결고리를 찾았다. 세포가 외부 자극에 노출되면 신호 전달 체계를 거쳐 반응 단백질이 생성된다. 시간에 따라 축적된 반응 단백질의 양을 이용하면 신호 전달 소요 시간의 분포를 추론할 수 있다. 이 분포는 신호 전달 체계가 몇 개의 경로로 구성됐는지를 알려준다. 즉, Density-PINNs를 이용하면 쉽게 관측할 수 있는 반응 단백질의 시계열 데이터로부터 직접 관찰하기 어려운 신호 전달 체계에 대한 정보를 추정할 수 있다는 의미다.
이어 연구진은 실제 대장균의 항생제에 대한 반응 실험 데이터에 Density-PINNs를 적용하여 세포 간 이질성의 원인도 찾았다. 신호 전달 체계가 단일 경로로 이뤄진 때(직렬)에 비해 여러 경로로 이뤄졌을 때(병렬)가 세포 간 이질성이 적다는 것을 알아냈다.
제1 저자인 조현태 연구원은 “추가 연구가 필요하지만, 신호 전달 체계가 병렬 구조일 경우 극단적인 신호가 서로 상쇄되어서 세포 간 이질성이 적어지는 것으로 보인다”며 “신호 전달 체계가 병렬 구조를 보이도록 약물이나 화학 요법 치료 전략을 세우면 치료 효과를 높일 수 있다는 의미”라고 설명했다.
연구를 이끈 김재경 교수는 “복잡한 세포 신호 전달 체계의 전 과정을 파악하려면 수십 년의 연구가 필요하지만, 우리 연구진이 제시한 방법론은 수 시간 내에 치료에 필요한 핵심 정보만 알아내 치료에 활용할 수 있다”며 “이번 연구를 실제 현장에서 사용되는 약물에 적용하여 치료 효과를 개선할 수 있기를 기대한다”고 말했다.
연구 결과는 지난해 12월 26일 국제학술지 셀(Cell)의 자매지인 ‘패턴스(Patterns)’에 실렸다.
※ 논문명: Density physics-informed neural networks reveal sources of cell heterogeneity in signal transduction
2024.01.17
조회수 5946
-
 면역항암치료 부작용 인공지능으로 예측
면역항암치료는 환자의 면역 시스템을 활성화해 암을 치료하는 혁신적인 3세대 항암 치료 방법으로 알려져 있다. 하지만 면역항암 치료제는 면역활성화에 의해 기존 항암제와는 구분되는 자가면역질환과 유사한 부작용을 유발할 수 있다는 새로운 문제가 제기됐다. 이러한 부작용은 심각한 경우 환자를 죽음에까지 이르게 할 수 있기에 부작용에 대한 연구가 절실한 상황에 놓여있다.
우리 대학 바이오및뇌공학과 최정균 교수팀과 서울아산병원 종양내과 박숙련 교수팀은 면역항암제 치료를 받은 고형암 환자에 대한 대규모 전향적 코호트를 구축하고, 다차원적 분석을 통해 면역항암제 부작용의 위험요인을 규명했다고 22일 밝혔다. 또한 인공지능 딥러닝을 이용해 치료 전 환자에게서 부작용이 나타날지를 예측할 수 있는 모델까지도 개발했다고 알렸다.
기존의 관련 연구들은 소규모로 진행이 되거나, 적은 수의 지표로 국한된 범위에 대해서만 행해졌다. 또한 수행된 연구들은 면역 관련 부작용을 위해 디자인된 연구 설계가 아닌, 다른 목적을 위해 모집된 환자군을 모아 수행하는 후향적 연구 설계로 진행됐다는 한계점이 있었다.
연구팀은 이러한 한계점을 극복하기 위해, 서울아산병원을 필두로 국내 9개 기관과 협력하여 면역 관련 부작용의 포괄적인 위험요인을 밝히기 위한 대규모 전향적 코호트를 구축했다. 또한 환자의 유전체, 전사체, 혈액 지표 등 폭넓은 범위에서 면역 관련 부작용에 대한 위험요인을 밝혀냄으로써, 궁극적으로는 치료 전 미리 환자가 면역항암치료에 대한 부작용을 보일지 알아낼 수 있는 딥러닝 예측 모델을 개발했다. 해당 연구 결과는 다양한 고형암 환자의 임상데이터와 혈액 유전체 데이터에 기반했기에, 향후 환자의 암종과 상관없이 폭넓게 적용될 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 성창환 박사(現 : 서울아산병원 핵의학과)와 안진현 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 캔서(Nature Cancer)’ 에 게재됐다. (논문명 : Integrative analysis of risk factors for immune-related adverse events of checkpoint blockade therapy in cancer).
이번 연구에는 고려대학교 안암병원, 인제대학교 해운대백병원, 국립암센터, 서울삼성병원, 분당서울대학교병원, 고려대학교 구로병원, 연세대학교 세브란스병원, 서울대학교병원의 연구자들도 참여했다.
최정균 교수는 “이번 연구를 통해 면역항암 치료의 아킬레스건이라고 할 수 있는 면역관련 부작용에 대한 폭넓은 분석과 예측모델의 제시를 통해 향후 전세계 연구진이 사용할 수 있는 대규모 면역관련 부작용 리소스를 제공할 수 있을 것이라 기대한다”라고 말했다.
임상연구를 총괄한 서울아산병원 박숙련 교수는 “현재 면역항암제가 임상에서 광범위하게 사용되고 있고 그 치료 영역을 완치적 세팅으로까지 확장하고 있어 치료 효과뿐 아니라 환자 안전성이 더욱 중요한데 그동안 치료 부작용을 예측할 수 있는 좋은 지표가 없던 상황에서, 이번 연구 결과는 개별 환자의 임상데이터와 유전체 데이터에 기반해 면역항암제의 부작용 발생을 예측할 수 있어 암 환자의 정밀 의료 치료를 실현할 수 있는 기반이 될 것으로 기대한다”고 전했다.
이번 연구는 과학기술정보통신부 인공지능 신약개발 플랫폼 구축 사업의 지원을 받아 수행됐다.
면역항암치료 부작용 인공지능으로 예측
면역항암치료는 환자의 면역 시스템을 활성화해 암을 치료하는 혁신적인 3세대 항암 치료 방법으로 알려져 있다. 하지만 면역항암 치료제는 면역활성화에 의해 기존 항암제와는 구분되는 자가면역질환과 유사한 부작용을 유발할 수 있다는 새로운 문제가 제기됐다. 이러한 부작용은 심각한 경우 환자를 죽음에까지 이르게 할 수 있기에 부작용에 대한 연구가 절실한 상황에 놓여있다.
우리 대학 바이오및뇌공학과 최정균 교수팀과 서울아산병원 종양내과 박숙련 교수팀은 면역항암제 치료를 받은 고형암 환자에 대한 대규모 전향적 코호트를 구축하고, 다차원적 분석을 통해 면역항암제 부작용의 위험요인을 규명했다고 22일 밝혔다. 또한 인공지능 딥러닝을 이용해 치료 전 환자에게서 부작용이 나타날지를 예측할 수 있는 모델까지도 개발했다고 알렸다.
기존의 관련 연구들은 소규모로 진행이 되거나, 적은 수의 지표로 국한된 범위에 대해서만 행해졌다. 또한 수행된 연구들은 면역 관련 부작용을 위해 디자인된 연구 설계가 아닌, 다른 목적을 위해 모집된 환자군을 모아 수행하는 후향적 연구 설계로 진행됐다는 한계점이 있었다.
연구팀은 이러한 한계점을 극복하기 위해, 서울아산병원을 필두로 국내 9개 기관과 협력하여 면역 관련 부작용의 포괄적인 위험요인을 밝히기 위한 대규모 전향적 코호트를 구축했다. 또한 환자의 유전체, 전사체, 혈액 지표 등 폭넓은 범위에서 면역 관련 부작용에 대한 위험요인을 밝혀냄으로써, 궁극적으로는 치료 전 미리 환자가 면역항암치료에 대한 부작용을 보일지 알아낼 수 있는 딥러닝 예측 모델을 개발했다. 해당 연구 결과는 다양한 고형암 환자의 임상데이터와 혈액 유전체 데이터에 기반했기에, 향후 환자의 암종과 상관없이 폭넓게 적용될 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 성창환 박사(現 : 서울아산병원 핵의학과)와 안진현 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 캔서(Nature Cancer)’ 에 게재됐다. (논문명 : Integrative analysis of risk factors for immune-related adverse events of checkpoint blockade therapy in cancer).
이번 연구에는 고려대학교 안암병원, 인제대학교 해운대백병원, 국립암센터, 서울삼성병원, 분당서울대학교병원, 고려대학교 구로병원, 연세대학교 세브란스병원, 서울대학교병원의 연구자들도 참여했다.
최정균 교수는 “이번 연구를 통해 면역항암 치료의 아킬레스건이라고 할 수 있는 면역관련 부작용에 대한 폭넓은 분석과 예측모델의 제시를 통해 향후 전세계 연구진이 사용할 수 있는 대규모 면역관련 부작용 리소스를 제공할 수 있을 것이라 기대한다”라고 말했다.
임상연구를 총괄한 서울아산병원 박숙련 교수는 “현재 면역항암제가 임상에서 광범위하게 사용되고 있고 그 치료 영역을 완치적 세팅으로까지 확장하고 있어 치료 효과뿐 아니라 환자 안전성이 더욱 중요한데 그동안 치료 부작용을 예측할 수 있는 좋은 지표가 없던 상황에서, 이번 연구 결과는 개별 환자의 임상데이터와 유전체 데이터에 기반해 면역항암제의 부작용 발생을 예측할 수 있어 암 환자의 정밀 의료 치료를 실현할 수 있는 기반이 될 것으로 기대한다”고 전했다.
이번 연구는 과학기술정보통신부 인공지능 신약개발 플랫폼 구축 사업의 지원을 받아 수행됐다.
2023.06.22
조회수 8265
-
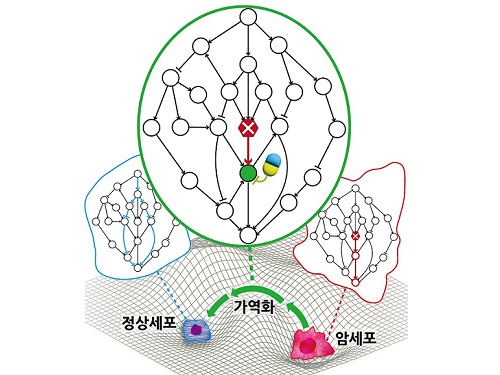 암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다.
조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것에 주목하였다. 컴퓨터 시뮬레이션 분석을 통해 특정 조건에서 유전자 돌연변이에 의해 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복(가역화)될 수 있음을 발견했으며, 분자세포실험을 통해 이와 같은 입출력 관계의 회복이 실제 암세포에서 나타난다는 것을 입증했다.
우리 대학 주재일 박사, 박화정 박사가 참여한 이번 연구결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 6월 2일 字 온라인판 논문으로 출판됐다. (논문명: Normalizing input-output relationships of cancer networks for reversion therapy)
조광현 교수 연구팀은 암세포의 왜곡된 입출력 관계가 정상세포의 정상적인 입출력 관계로 회복될 수 있는 이유는 생명체의 오랜 진화과정에서 획득된 세포내 유전자 조절 네트워크의 견실성(robustness)과 중복성(redundancy)에 기인한다는 것을 규명했다. 또한 암 가역화를 위한 조절 타겟으로 유력한 유전자들이 존재한다는 것을 발견했고 이 유전자들을 조절하면 실제로 암세포의 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복된다는 것을 암세포 분자세포실험을 통해 증명했다.
이번 연구성과는 실제 암세포가 정상세포로 가역화 될 수 있는 현상이 우연한 것이 아니며, 암세포 가역화를 유도할 수 있는 타겟을 체계적으로 탐색하고 이를 조절하는 약물을 개발함으로써 혁신 항암제의 개발이 가능함을 보여준 것이어서 그 의미가 크다.
조광현 교수는 "현행 항암치료의 한계를 극복할 수 있는 새로운 암 가역치료 전략에 대한 근본적인 원리를 밝히는 데 성공함으로써 암 환자의 예후와 삶의 질을 모두 증진시킬 수 있는 혁신 신약 개발의 가능성을 높이게 되었다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역치료 개념을 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장세포로 되돌리는 연구결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 그리고 2023년 1월에는 전이 능력을 획득한 폐암 세포를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 연구에 성공한 바 있다. 하지만 이와 같은 성과들은 서로 다른 암종에서 개별적으로 연구되어진 사례연구였기 때문에, 어떠한 공통된 원리로 암가역화가 여러 암종에서 발생가능한지는 밝히지 못했다. 이번 연구 결과는 이러한 암가역화의 보편적인 원리와 진화적 기원을 밝힌 최초의 연구다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다.
조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것에 주목하였다. 컴퓨터 시뮬레이션 분석을 통해 특정 조건에서 유전자 돌연변이에 의해 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복(가역화)될 수 있음을 발견했으며, 분자세포실험을 통해 이와 같은 입출력 관계의 회복이 실제 암세포에서 나타난다는 것을 입증했다.
우리 대학 주재일 박사, 박화정 박사가 참여한 이번 연구결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 6월 2일 字 온라인판 논문으로 출판됐다. (논문명: Normalizing input-output relationships of cancer networks for reversion therapy)
조광현 교수 연구팀은 암세포의 왜곡된 입출력 관계가 정상세포의 정상적인 입출력 관계로 회복될 수 있는 이유는 생명체의 오랜 진화과정에서 획득된 세포내 유전자 조절 네트워크의 견실성(robustness)과 중복성(redundancy)에 기인한다는 것을 규명했다. 또한 암 가역화를 위한 조절 타겟으로 유력한 유전자들이 존재한다는 것을 발견했고 이 유전자들을 조절하면 실제로 암세포의 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복된다는 것을 암세포 분자세포실험을 통해 증명했다.
이번 연구성과는 실제 암세포가 정상세포로 가역화 될 수 있는 현상이 우연한 것이 아니며, 암세포 가역화를 유도할 수 있는 타겟을 체계적으로 탐색하고 이를 조절하는 약물을 개발함으로써 혁신 항암제의 개발이 가능함을 보여준 것이어서 그 의미가 크다.
조광현 교수는 "현행 항암치료의 한계를 극복할 수 있는 새로운 암 가역치료 전략에 대한 근본적인 원리를 밝히는 데 성공함으로써 암 환자의 예후와 삶의 질을 모두 증진시킬 수 있는 혁신 신약 개발의 가능성을 높이게 되었다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역치료 개념을 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장세포로 되돌리는 연구결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 그리고 2023년 1월에는 전이 능력을 획득한 폐암 세포를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 연구에 성공한 바 있다. 하지만 이와 같은 성과들은 서로 다른 암종에서 개별적으로 연구되어진 사례연구였기 때문에, 어떠한 공통된 원리로 암가역화가 여러 암종에서 발생가능한지는 밝히지 못했다. 이번 연구 결과는 이러한 암가역화의 보편적인 원리와 진화적 기원을 밝힌 최초의 연구다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2023.06.08
조회수 10359
-
 항암 백신 찾는 ‘딥네오(DeepNeo)’ 개발
신생항원이란 암세포의 돌연변이에서 나온 단백질 조각 중 면역반응을 유도할 수 있는 항원들로서 항암 백신 개발의 이상적인 대상으로 주목받고 있다. 모더나 및 바이오엔텍은 암 치료를 위한 신생항원 백신용으로 개발하던 mRNA 플랫폼을 사용해 COVID-19 백신을 성공적으로 개발한 바 있으며, 현재 대규모 제약회사들과 함께 신생항원 암 백신 임상시험을 진행하고 있다. 이런 암 백신 개발을 위해 핵심적인 단계인 환자 맞춤형 신생항원 발굴에 활용될 인공지능 플랫폼이 개발되어 화제다.
우리 대학 바이오및뇌공학과 최정균 교수가 ㈜펜타메딕스와의 공동연구를 통해 개인 맞춤 치료용 암 백신에 사용될 수 있는 신생항원을 예측하는 인공지능(AI) 모델을 개발하고 웹서비스를 구축했다고 17일 밝혔다.
최정균 교수 연구팀은 딥러닝을 이용해 실제로 T 세포 면역반응을 유도할 수 있는 신생항원을 발굴하는 AI 모델을 개발했으며, 연구자들이 손쉽게 활용할 수 있는 웹서비스를 구축해 DeepNeo라는 이름으로 공개했다 (https://deepneo.net).
기존의 신생항원 발굴 방법론은 MHC* 단백질과 결합할 수 있는 돌연변이를 예측하는 데에 한정되어 있었다. 그러나 암 백신이 효과가 있으려면 돌연변이가 MHC와 결합할 뿐만 아니라 그 결합체가 실제로 T 세포 면역반응을 유발할 수 있어야 하는데, 기존 기술로는 그것이 불가능했다. 따라서 현재 암 백신 임상시험들은 이 결합체들이 실제로 면역반응을 자극할 수 있는지를 알 수 없는 상태로 진행되고 있다.
*MHC란 외부에서 들어온 병원균이나 암세포에서 발생한 항원과 결합하여 우리 몸의 면역세포에 제시해 줌으로써 면역반응을 활성화시키는 역할을 하는 단백질을 일컬음
연구팀은 이러한 문제를 해결하기 위해 새로운 개념의 딥러닝 모델을 구축했고, 여러 빅데이터 분석을 통하여 면역성 및 항암 반응성이 뛰어난 신생항원을 발굴할 수 있음을 확인했다. 따라서 이번에 웹서비스 형태로 구축한 방법론은T 세포 반응을 효과적으로 유도할 수 있는 항암 백신 개발에 활용될 수 있다.
우리 대학 바이오및뇌공학과 김정연 박사과정이 제1 저자로 개발한 핵심 알고리즘은 지난 1월 국제 학술지 ‘네이처 지네틱스(Nature Genetics)’ 에 출판됐으며, 이후 ㈜펜타메딕스의 노승재 박사, 방효은 연구원과의 공동연구를 통해 딥러닝 성능이 더욱 개선된 AI 모델이 웹서비스 형태로 개발돼 이번 4월 국제 학술지 ‘핵산 연구(Nucleic Acids Research)’를 통해 공개됐다.
최정균 교수는 “코로나 백신에서 mRNA 플랫폼이 검증된 만큼 이번에 개발된 AI 기술이 암 백신의 상용화에도 도움이 되기를 희망한다.”고 밝혔다. ㈜펜타메딕스 조대연 대표는 “이번 공동연구를 통해 개발된 플랫폼을 적용한 개인맞춤형 암 백신의 사업화에 박차를 가하겠다”고 전했다.
이번 연구는 한국연구재단 기초연구실지원사업의 지원을 받아 수행됐다.
항암 백신 찾는 ‘딥네오(DeepNeo)’ 개발
신생항원이란 암세포의 돌연변이에서 나온 단백질 조각 중 면역반응을 유도할 수 있는 항원들로서 항암 백신 개발의 이상적인 대상으로 주목받고 있다. 모더나 및 바이오엔텍은 암 치료를 위한 신생항원 백신용으로 개발하던 mRNA 플랫폼을 사용해 COVID-19 백신을 성공적으로 개발한 바 있으며, 현재 대규모 제약회사들과 함께 신생항원 암 백신 임상시험을 진행하고 있다. 이런 암 백신 개발을 위해 핵심적인 단계인 환자 맞춤형 신생항원 발굴에 활용될 인공지능 플랫폼이 개발되어 화제다.
우리 대학 바이오및뇌공학과 최정균 교수가 ㈜펜타메딕스와의 공동연구를 통해 개인 맞춤 치료용 암 백신에 사용될 수 있는 신생항원을 예측하는 인공지능(AI) 모델을 개발하고 웹서비스를 구축했다고 17일 밝혔다.
최정균 교수 연구팀은 딥러닝을 이용해 실제로 T 세포 면역반응을 유도할 수 있는 신생항원을 발굴하는 AI 모델을 개발했으며, 연구자들이 손쉽게 활용할 수 있는 웹서비스를 구축해 DeepNeo라는 이름으로 공개했다 (https://deepneo.net).
기존의 신생항원 발굴 방법론은 MHC* 단백질과 결합할 수 있는 돌연변이를 예측하는 데에 한정되어 있었다. 그러나 암 백신이 효과가 있으려면 돌연변이가 MHC와 결합할 뿐만 아니라 그 결합체가 실제로 T 세포 면역반응을 유발할 수 있어야 하는데, 기존 기술로는 그것이 불가능했다. 따라서 현재 암 백신 임상시험들은 이 결합체들이 실제로 면역반응을 자극할 수 있는지를 알 수 없는 상태로 진행되고 있다.
*MHC란 외부에서 들어온 병원균이나 암세포에서 발생한 항원과 결합하여 우리 몸의 면역세포에 제시해 줌으로써 면역반응을 활성화시키는 역할을 하는 단백질을 일컬음
연구팀은 이러한 문제를 해결하기 위해 새로운 개념의 딥러닝 모델을 구축했고, 여러 빅데이터 분석을 통하여 면역성 및 항암 반응성이 뛰어난 신생항원을 발굴할 수 있음을 확인했다. 따라서 이번에 웹서비스 형태로 구축한 방법론은T 세포 반응을 효과적으로 유도할 수 있는 항암 백신 개발에 활용될 수 있다.
우리 대학 바이오및뇌공학과 김정연 박사과정이 제1 저자로 개발한 핵심 알고리즘은 지난 1월 국제 학술지 ‘네이처 지네틱스(Nature Genetics)’ 에 출판됐으며, 이후 ㈜펜타메딕스의 노승재 박사, 방효은 연구원과의 공동연구를 통해 딥러닝 성능이 더욱 개선된 AI 모델이 웹서비스 형태로 개발돼 이번 4월 국제 학술지 ‘핵산 연구(Nucleic Acids Research)’를 통해 공개됐다.
최정균 교수는 “코로나 백신에서 mRNA 플랫폼이 검증된 만큼 이번에 개발된 AI 기술이 암 백신의 상용화에도 도움이 되기를 희망한다.”고 밝혔다. ㈜펜타메딕스 조대연 대표는 “이번 공동연구를 통해 개발된 플랫폼을 적용한 개인맞춤형 암 백신의 사업화에 박차를 가하겠다”고 전했다.
이번 연구는 한국연구재단 기초연구실지원사업의 지원을 받아 수행됐다.
2023.05.17
조회수 10219
 장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.07.01 조회수 355
장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.07.01 조회수 355 면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
2025.04.08 조회수 2864
면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
2025.04.08 조회수 2864 ‘카이랄 나노 페인트’ 기술로 항암, 코로나 치료 혁신
기존의 의료용 나노 소재는 체내에서 잘 전달되지 않거나 쉽게 분해되는 문제가 있었다. 우리 연구진은 카이랄 나노 페인트 기술로 의료용 나노 소재에 카이랄성을 부여한 자성 나노 입자를 개발했다. 그 결과 항암 온열 치료 효과가 기존보다 4배 이상 향상됐고, 약물 전달 시스템에도 적용하여 코로나 19 백신 등 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다.
신소재공학과 염지현 교수 연구팀이 바이오 나노 소재의 표면에 카이랄성*을 부여할 수 있는 ‘카이랄 나노 페인트’기술을 최초로 개발했고 후속 연구로 생명과학과 정현정 교수팀과 함께 mRNA를 전달하는 지질전달체** 표면에도 성공적으로 도입했다고 19일 밝혔다. 이 연구들은 각각 국제 학술지 ACS Nano와 ACS Applied Materials & Interfaces 에 게재됐다.
*카이랄성(Chirality): 카이랄성은 물체가 거울에 비친 모습과 겹치지 않는 성질을 의미함. 우리 몸에서도 카이랄성을 가진 분자들이 특정한 방식으로 작용하는데, 연구팀은 이를 활용해 나노 소재의 성능을 개선함
**지질전달체(Lipid Nanoparticle, LNP): mRNA, 유전자, 약물 등의 생체물질을 감싸서 세포 내부로 안전하게 전달하는 나노입자임. mRNA 백신(예: 코로나19 백신)과 같은 유전자 치료제에서 중요한 역할을 함.
염지현 교수 연구팀은 우리 몸은 왼손잡이(L-형)와 오른손잡이(D-형) 구조를 가진 분자들이 서로 다르게 작용하는 카이랄 선택성(Chiral Selectivity)에 주목하고 나노 소재의 표면에 ‘카이랄 나노 페인트’를 적용해 카이랄성을 부여하는 기술을 개발했다. 이를 통해 십수 나노미터(nm) 크기의 작은 나노 입자부터 수 마이크로미터 (μm) 크기의 큰 마이크로 구조체까지 다양한 크기의 소재에 카이랄성을 입히는 데 성공했다.
연구팀은 더 나아가 카이랄 나노 페인트 기술을 활용해 카이랄 자성 나노 입자를 합성하고, 이를 종양에 주입한 뒤 자기장 처리로 생성되는 열을 통해 종양 조직을 괴사시키는 항암 온열 치료 기술을 선보였다.
이 과정에서 D-카이랄성을 가진 자성 나노 입자가 L-카이랄성을 가진 자성 나노 입자보다 암세포에 더 많이 흡수되고, 그 결과 4배 이상 향상된 항암 치료 효과가 있음을 증명했다.
이와 같은 암세포 내부로의 흡수 효율 및 항암 치료 효율의 차이가 나노 입자 표면에 처리된 카이랄 나노 페인트와 세포 표면의 수용체 간의 ‘카이랄 선택적 상호작용’에 의한 것임을 컴퓨터 시뮬레이션과 세포 실험을 통해 밝혔다.
향후, 카이랄 나노 페인트 기술은 의료용 바이오 소재를 비롯해 차세대 약물 전달 시스템, 바이오 센서, 촉매 및 나노 효소 등 다양한 분야에 응용될 것으로 기대된다.
신소재공학과 정욱진 석박사통합과정 학생이 제1 저자인 이번 연구 결과는 지난 3월 2일 국제 학술지 ‘에이씨에스 나노(ACS Nano)’에 온라인 게재됐다. (논문명: Universal Chiral Nanopaint for Metal Oxide Biomaterials) DOI: 10.1021/acsnano.4c14460
후속 연구로 mRNA를 전달하는 지질전달체 표면에 카이랄 페인트 기술을 도입했다. mRNA 기반 치료제는 세포 내에서 단백질을 직접 합성할 수 있도록 유전 정보를 전달하는 방식이지만, 전달체의 불안정성으로 인해 치료 효과가 제한적이었다.
카이랄 나노 페인트 기술은 이러한 문제를 해결하여 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다. 그 결과, D-카이랄성 페인트를 도입한 지질전달체를 사용한 경우 mRNA의 세포 내 발현을 2배 이상 안정적으로 증가시켰다.
이 연구는 생명과학과 이주희 연구원과 신소재공학과 정욱진 박사과정 학생이 공동 1 저자로 국제 학술지 ‘에이씨에스 응용 재료 및 인터페이스(ACS Applied Materials & Interfaces)’에 3월 17일 게재됐다. (논문명: Chirality-controlled Lipid Nanoparticles for mRNA Delivery, DOI: https://doi.org/10.1021/acsami.5c00920)
염지현 교수는 “이번 연구를 통해 바이오 나노 소재의 성능을 크게 향상시키고 다양한 크기 및 모양을 가진 혁신적 나노 소재 합성 방법론을 제시했다. 앞으로는 이러한 카이랄 나노 소재를 활용해 암, 코로나 등 다양한 질병을 예방하는 백신부터 진단 및 치료하는 차세대 바이오 플랫폼 개발 및 연구를 지속할 계획”이라고 설명했다.
이번 연구는 과학기술정보통신부의 재원으로 범부처전주기의료기기연구개발사업단, 연구재단 우수신진사업 등의 지원을 받아 수행됐다.
2025.03.19 조회수 4620
‘카이랄 나노 페인트’ 기술로 항암, 코로나 치료 혁신
기존의 의료용 나노 소재는 체내에서 잘 전달되지 않거나 쉽게 분해되는 문제가 있었다. 우리 연구진은 카이랄 나노 페인트 기술로 의료용 나노 소재에 카이랄성을 부여한 자성 나노 입자를 개발했다. 그 결과 항암 온열 치료 효과가 기존보다 4배 이상 향상됐고, 약물 전달 시스템에도 적용하여 코로나 19 백신 등 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다.
신소재공학과 염지현 교수 연구팀이 바이오 나노 소재의 표면에 카이랄성*을 부여할 수 있는 ‘카이랄 나노 페인트’기술을 최초로 개발했고 후속 연구로 생명과학과 정현정 교수팀과 함께 mRNA를 전달하는 지질전달체** 표면에도 성공적으로 도입했다고 19일 밝혔다. 이 연구들은 각각 국제 학술지 ACS Nano와 ACS Applied Materials & Interfaces 에 게재됐다.
*카이랄성(Chirality): 카이랄성은 물체가 거울에 비친 모습과 겹치지 않는 성질을 의미함. 우리 몸에서도 카이랄성을 가진 분자들이 특정한 방식으로 작용하는데, 연구팀은 이를 활용해 나노 소재의 성능을 개선함
**지질전달체(Lipid Nanoparticle, LNP): mRNA, 유전자, 약물 등의 생체물질을 감싸서 세포 내부로 안전하게 전달하는 나노입자임. mRNA 백신(예: 코로나19 백신)과 같은 유전자 치료제에서 중요한 역할을 함.
염지현 교수 연구팀은 우리 몸은 왼손잡이(L-형)와 오른손잡이(D-형) 구조를 가진 분자들이 서로 다르게 작용하는 카이랄 선택성(Chiral Selectivity)에 주목하고 나노 소재의 표면에 ‘카이랄 나노 페인트’를 적용해 카이랄성을 부여하는 기술을 개발했다. 이를 통해 십수 나노미터(nm) 크기의 작은 나노 입자부터 수 마이크로미터 (μm) 크기의 큰 마이크로 구조체까지 다양한 크기의 소재에 카이랄성을 입히는 데 성공했다.
연구팀은 더 나아가 카이랄 나노 페인트 기술을 활용해 카이랄 자성 나노 입자를 합성하고, 이를 종양에 주입한 뒤 자기장 처리로 생성되는 열을 통해 종양 조직을 괴사시키는 항암 온열 치료 기술을 선보였다.
이 과정에서 D-카이랄성을 가진 자성 나노 입자가 L-카이랄성을 가진 자성 나노 입자보다 암세포에 더 많이 흡수되고, 그 결과 4배 이상 향상된 항암 치료 효과가 있음을 증명했다.
이와 같은 암세포 내부로의 흡수 효율 및 항암 치료 효율의 차이가 나노 입자 표면에 처리된 카이랄 나노 페인트와 세포 표면의 수용체 간의 ‘카이랄 선택적 상호작용’에 의한 것임을 컴퓨터 시뮬레이션과 세포 실험을 통해 밝혔다.
향후, 카이랄 나노 페인트 기술은 의료용 바이오 소재를 비롯해 차세대 약물 전달 시스템, 바이오 센서, 촉매 및 나노 효소 등 다양한 분야에 응용될 것으로 기대된다.
신소재공학과 정욱진 석박사통합과정 학생이 제1 저자인 이번 연구 결과는 지난 3월 2일 국제 학술지 ‘에이씨에스 나노(ACS Nano)’에 온라인 게재됐다. (논문명: Universal Chiral Nanopaint for Metal Oxide Biomaterials) DOI: 10.1021/acsnano.4c14460
후속 연구로 mRNA를 전달하는 지질전달체 표면에 카이랄 페인트 기술을 도입했다. mRNA 기반 치료제는 세포 내에서 단백질을 직접 합성할 수 있도록 유전 정보를 전달하는 방식이지만, 전달체의 불안정성으로 인해 치료 효과가 제한적이었다.
카이랄 나노 페인트 기술은 이러한 문제를 해결하여 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다. 그 결과, D-카이랄성 페인트를 도입한 지질전달체를 사용한 경우 mRNA의 세포 내 발현을 2배 이상 안정적으로 증가시켰다.
이 연구는 생명과학과 이주희 연구원과 신소재공학과 정욱진 박사과정 학생이 공동 1 저자로 국제 학술지 ‘에이씨에스 응용 재료 및 인터페이스(ACS Applied Materials & Interfaces)’에 3월 17일 게재됐다. (논문명: Chirality-controlled Lipid Nanoparticles for mRNA Delivery, DOI: https://doi.org/10.1021/acsami.5c00920)
염지현 교수는 “이번 연구를 통해 바이오 나노 소재의 성능을 크게 향상시키고 다양한 크기 및 모양을 가진 혁신적 나노 소재 합성 방법론을 제시했다. 앞으로는 이러한 카이랄 나노 소재를 활용해 암, 코로나 등 다양한 질병을 예방하는 백신부터 진단 및 치료하는 차세대 바이오 플랫폼 개발 및 연구를 지속할 계획”이라고 설명했다.
이번 연구는 과학기술정보통신부의 재원으로 범부처전주기의료기기연구개발사업단, 연구재단 우수신진사업 등의 지원을 받아 수행됐다.
2025.03.19 조회수 4620 항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.12.11 조회수 4839
항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.12.11 조회수 4839 난치성 뇌종양 치료의 새로운 가능성 열다
면역항암제는 암세포를 제거하는 T세포의 항암 면역작용을 강화하는 가장 주목받는 항암치료 요법이다. 하지만 난치성 뇌종양인 교모세포종의 경우 면역관문억제제를 활용한 수차례 임상시험에서 그 효과를 확인할 수 없었다. 우리 연구진이 난치성 암종에서 T세포가 만성적 항원에 노출되어 기능이 상실되거나 약화된 원인을 분석하여 T세포 활성 제어 인자를 발굴하고 치료 효능 증진 원리를 규명했다.
우리 대학 생명과학과 이흥규 교수 연구팀이 한국화학연구원(원장 이영국) 감염병예방진단기술연구센터와 협력하여, 교모세포종 실험 쥐 모델에서 억제성 Fc 감마수용체(FcγRIIB)의 결손을 통한 면역관문억제제의 세포독성 T세포 불응성을 회복해, 항암 작용 증대를 유도함으로 생존율 개선 효능을 확인했다고 6일 밝혔다.
연구팀은 최근 세포독성 T세포에서 발견된 억제 수용체(FcγRIIB)가 종양 침윤 세포독성 T세포의 특성과 면역관문억제제(항 PD-1)의 치료 효능에 미치는 영향을 확인했다.
연구 결과, 억제 수용체(FcγRIIB)가 결손되었을때 종양항원 특이적 기억 T세포의 증가를 유도했다. 이 같은 T세포 아형은 탈진화를 억제하고 줄기세포 특성을 강화했고, 이를 통한 항 PD-1 치료의 회복된 T세포 항암 면역반응을 이끌었다. 또한, 연구팀은 항원 특이적 기억 T세포가 FcγRIIB 결손 시 상대적으로 높은 수의 증가와 함께 지속적인 종양 조직 내 T세포 침투를 이끈다는 결과를 확인했다.
해당 연구는 면역관문억제제에 불응성을 보이는 종양에 대한 새로운 치료 타깃을 제시했으며, 특히 교모세포종과 같은 항 PD-1 치료에 반응하지 않는 종양에 FcγRIIB 억제와 항 PD-1 치료를 병행함으로써 시너지 효과를 발휘할 수 있음을 증명했다.
연구팀은 이러한 FcγRIIB 억제를 통한 항암 면역작용 증진 전략이 면역관문억제제의 효능을 높이는 데 중요한 기여를 할 것으로 기대하고 있다.
생명과학과 이흥규 교수는 “면역관문 치료제를 이용한 뇌종양 치료 임상 실패를 극복할 가능성과 다른 난치성 종양으로의 범용적 적용 가능성을 제시한 결과로 추후 세포독성 T 세포의 종양 세포치료 활용과 접근 가능성도 확인한 결과”라고 소개했다.
우리 대학 구근본 박사(現, 한국화학연구원 감염병예방진단기술연구센터 선임연구원)가 제1 저자로 참여한 이번 연구는 암 면역치료 학회(Society for Immunotherapy of Cancer)에서 발간하는 종양면역 및 치료 분야 국제 학술지 `Journal for ImmunoTherapy of Cancer'에 10월 26일 온라인판에 게재됐다. (논문명: Inhibitory Fcγ receptor deletion enhances CD8 T cell stemness increasing anti-PD-1 therapy responsiveness against glioblastoma, http://dx.doi.org/10.1136/jitc-2024-009449)
한편 이번 연구는 한국연구재단 개인기초연구사업, 바이오의료기술개발사업 및 삼성미래육성재단의 지원을 받아 수행됐다.
2024.11.06 조회수 5839
난치성 뇌종양 치료의 새로운 가능성 열다
면역항암제는 암세포를 제거하는 T세포의 항암 면역작용을 강화하는 가장 주목받는 항암치료 요법이다. 하지만 난치성 뇌종양인 교모세포종의 경우 면역관문억제제를 활용한 수차례 임상시험에서 그 효과를 확인할 수 없었다. 우리 연구진이 난치성 암종에서 T세포가 만성적 항원에 노출되어 기능이 상실되거나 약화된 원인을 분석하여 T세포 활성 제어 인자를 발굴하고 치료 효능 증진 원리를 규명했다.
우리 대학 생명과학과 이흥규 교수 연구팀이 한국화학연구원(원장 이영국) 감염병예방진단기술연구센터와 협력하여, 교모세포종 실험 쥐 모델에서 억제성 Fc 감마수용체(FcγRIIB)의 결손을 통한 면역관문억제제의 세포독성 T세포 불응성을 회복해, 항암 작용 증대를 유도함으로 생존율 개선 효능을 확인했다고 6일 밝혔다.
연구팀은 최근 세포독성 T세포에서 발견된 억제 수용체(FcγRIIB)가 종양 침윤 세포독성 T세포의 특성과 면역관문억제제(항 PD-1)의 치료 효능에 미치는 영향을 확인했다.
연구 결과, 억제 수용체(FcγRIIB)가 결손되었을때 종양항원 특이적 기억 T세포의 증가를 유도했다. 이 같은 T세포 아형은 탈진화를 억제하고 줄기세포 특성을 강화했고, 이를 통한 항 PD-1 치료의 회복된 T세포 항암 면역반응을 이끌었다. 또한, 연구팀은 항원 특이적 기억 T세포가 FcγRIIB 결손 시 상대적으로 높은 수의 증가와 함께 지속적인 종양 조직 내 T세포 침투를 이끈다는 결과를 확인했다.
해당 연구는 면역관문억제제에 불응성을 보이는 종양에 대한 새로운 치료 타깃을 제시했으며, 특히 교모세포종과 같은 항 PD-1 치료에 반응하지 않는 종양에 FcγRIIB 억제와 항 PD-1 치료를 병행함으로써 시너지 효과를 발휘할 수 있음을 증명했다.
연구팀은 이러한 FcγRIIB 억제를 통한 항암 면역작용 증진 전략이 면역관문억제제의 효능을 높이는 데 중요한 기여를 할 것으로 기대하고 있다.
생명과학과 이흥규 교수는 “면역관문 치료제를 이용한 뇌종양 치료 임상 실패를 극복할 가능성과 다른 난치성 종양으로의 범용적 적용 가능성을 제시한 결과로 추후 세포독성 T 세포의 종양 세포치료 활용과 접근 가능성도 확인한 결과”라고 소개했다.
우리 대학 구근본 박사(現, 한국화학연구원 감염병예방진단기술연구센터 선임연구원)가 제1 저자로 참여한 이번 연구는 암 면역치료 학회(Society for Immunotherapy of Cancer)에서 발간하는 종양면역 및 치료 분야 국제 학술지 `Journal for ImmunoTherapy of Cancer'에 10월 26일 온라인판에 게재됐다. (논문명: Inhibitory Fcγ receptor deletion enhances CD8 T cell stemness increasing anti-PD-1 therapy responsiveness against glioblastoma, http://dx.doi.org/10.1136/jitc-2024-009449)
한편 이번 연구는 한국연구재단 개인기초연구사업, 바이오의료기술개발사업 및 삼성미래육성재단의 지원을 받아 수행됐다.
2024.11.06 조회수 5839 간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
2024.08.08 조회수 5305
간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
2024.08.08 조회수 5305 종양모델 칩으로 다조건 항암제 동시 평가
실제 인체에 항암제가 투여되면 약물 분자는 혈류를 따라 수송된다. 이 약물 분자들은 혈관 벽을 투과하고 확산한다. 확산한 분자는 종양 덩어리 내부까지 점차 침투해 약물 효능이 나타나게 된다. 우리 연구진이 바이오프린팅 기술로 36가지의 종양 미세환경을 유체채널 내부에 모사하여 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는데 성공하여 화제다.
우리 대학 바이오및뇌공학과 박제균 교수 연구팀이 기존 바이오프린팅* 및 랩온어칩** 기술의 한계점을 극복하고 장점을 극대화하여 복잡한 종양 미세환경이 구현된 랩온어칩을 개발하여 여러 분석 변수가 반영된 약물 스크리닝을 수행하는 데 성공했다고 16일 밝혔다.
* 바이오프린팅(bioprinting): 세포와 생체재료로 구성된 바이오 잉크를 활용하여 생체조직 및 기관과 유사한 기능적 구조물을 제작하는 3D 프린팅 기술
** 랩온어칩(lab-on-a-chip): “칩 위의 실험실”이란 개념을 갖고 있으며 각종 시료분석에 필요한 전처리, 분리, 희석, 혼합, 반응, 검출 기능 등을 미세유체 회로로 이루어진 채널 내에서 일괄적으로 수행할 수 있도록 만들어진 미세유체 소자 및 시스템
바이오프린팅은 조직이나 장기의 복잡한 형상과 조성을 체외환경에서 재현할 수 있는 생체모사 기술이지만, 제작된 생체모델의 배양 환경 제어와 분석이 어렵다. 반면, 랩온어칩은 미세 유체채널 내에서의 유체 제어 기술에 기반해 배양 환경의 정교한 제어와 다양한 분석 수행이 가능하지만, 미세한 유체 통로 내부에 생체 환경을 모사하는 데 한계가 있었다.
연구진은 바이오프린팅 기술로 서로 다른 조성으로 구성된 총 36개의 종양 모델을 랩온어칩 내에 형성한 후, 동일한 소자 내에서 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는 데 성공했다.
연구팀은 바이오프린팅의 우수한 공간적 자유도와 다양한 생체재료를 활용할 수 있다는 장점을 이용해, 세 가지 서로 다른 조성으로 이루어진 36개의 종양 모델을 하나의 미세 유체소자에 집적시켰다. 세포를 유동 배양해 물질 수송에 핵심 구조물인 혈관 벽과 종양 덩어리를 모사하여 네 가지 농도의 항암제를 종양 모델에 유입함으로써, 하나의 소자에서 12가지 실험 조건의 약물 평가를 수행했다.
또한 연구팀은 혈관 벽에 의해 약물 분자의 수송이 저해되고 종양 덩어리 내부까지 침투되는 현상을 관찰할 수 있었고, 체내 수송 과정을 모사하지 못했던 기존 종양 모델과 약물 효능에 큰 차이를 보인다는 것을 확인했다.
이처럼 바이오프린팅-랩온어칩 통합기술을 활용해 모델 복잡성, 모델 수, 모델 처리량 등 다양한 변수를 고려한 체외 종양 모델을 제작할 수 있었고, 더욱 신뢰성 있는 약물 평가를 수행할 수 있었다.
연구를 주도한 박제균 교수는 “바이오프린팅과 랩온어칩의 통합기술로 제작된 미세 유체 세포배양 및 분석 플랫폼의 개발에 따른 신뢰성 있는 약물 평가 모델에 대한 성과”임을 강조하며, “향후 다양한 조직 및 장기 특성을 모사하고 생물학적 분석과 약물 효능 평가를 고효율로 수행할 수 있는 동물실험 대체용 차세대 체외 세포배양 및 분석 기술로 활용될 수 있을 것”이라고 말했다.
바이오및뇌공학과 이기현 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 '어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)'에 2024년 6월 3일 자로 온라인판에 게재됐다.
(https://doi.org/10.1002/adhm.202303716. 논문명: Bioprinted multi-composition array mimicking tumor microenvironment to evaluate drug efficacy with multivariable analysis).
또한, 이번 논문은 와일리-VCH(Wiley-VCH) 출판사의 ‘핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)’세션과 ‘핫 토픽: 미세유체공학(Hot Topic: Microfluidics)’세션에 동시 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
2024.07.16 조회수 6210
종양모델 칩으로 다조건 항암제 동시 평가
실제 인체에 항암제가 투여되면 약물 분자는 혈류를 따라 수송된다. 이 약물 분자들은 혈관 벽을 투과하고 확산한다. 확산한 분자는 종양 덩어리 내부까지 점차 침투해 약물 효능이 나타나게 된다. 우리 연구진이 바이오프린팅 기술로 36가지의 종양 미세환경을 유체채널 내부에 모사하여 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는데 성공하여 화제다.
우리 대학 바이오및뇌공학과 박제균 교수 연구팀이 기존 바이오프린팅* 및 랩온어칩** 기술의 한계점을 극복하고 장점을 극대화하여 복잡한 종양 미세환경이 구현된 랩온어칩을 개발하여 여러 분석 변수가 반영된 약물 스크리닝을 수행하는 데 성공했다고 16일 밝혔다.
* 바이오프린팅(bioprinting): 세포와 생체재료로 구성된 바이오 잉크를 활용하여 생체조직 및 기관과 유사한 기능적 구조물을 제작하는 3D 프린팅 기술
** 랩온어칩(lab-on-a-chip): “칩 위의 실험실”이란 개념을 갖고 있으며 각종 시료분석에 필요한 전처리, 분리, 희석, 혼합, 반응, 검출 기능 등을 미세유체 회로로 이루어진 채널 내에서 일괄적으로 수행할 수 있도록 만들어진 미세유체 소자 및 시스템
바이오프린팅은 조직이나 장기의 복잡한 형상과 조성을 체외환경에서 재현할 수 있는 생체모사 기술이지만, 제작된 생체모델의 배양 환경 제어와 분석이 어렵다. 반면, 랩온어칩은 미세 유체채널 내에서의 유체 제어 기술에 기반해 배양 환경의 정교한 제어와 다양한 분석 수행이 가능하지만, 미세한 유체 통로 내부에 생체 환경을 모사하는 데 한계가 있었다.
연구진은 바이오프린팅 기술로 서로 다른 조성으로 구성된 총 36개의 종양 모델을 랩온어칩 내에 형성한 후, 동일한 소자 내에서 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는 데 성공했다.
연구팀은 바이오프린팅의 우수한 공간적 자유도와 다양한 생체재료를 활용할 수 있다는 장점을 이용해, 세 가지 서로 다른 조성으로 이루어진 36개의 종양 모델을 하나의 미세 유체소자에 집적시켰다. 세포를 유동 배양해 물질 수송에 핵심 구조물인 혈관 벽과 종양 덩어리를 모사하여 네 가지 농도의 항암제를 종양 모델에 유입함으로써, 하나의 소자에서 12가지 실험 조건의 약물 평가를 수행했다.
또한 연구팀은 혈관 벽에 의해 약물 분자의 수송이 저해되고 종양 덩어리 내부까지 침투되는 현상을 관찰할 수 있었고, 체내 수송 과정을 모사하지 못했던 기존 종양 모델과 약물 효능에 큰 차이를 보인다는 것을 확인했다.
이처럼 바이오프린팅-랩온어칩 통합기술을 활용해 모델 복잡성, 모델 수, 모델 처리량 등 다양한 변수를 고려한 체외 종양 모델을 제작할 수 있었고, 더욱 신뢰성 있는 약물 평가를 수행할 수 있었다.
연구를 주도한 박제균 교수는 “바이오프린팅과 랩온어칩의 통합기술로 제작된 미세 유체 세포배양 및 분석 플랫폼의 개발에 따른 신뢰성 있는 약물 평가 모델에 대한 성과”임을 강조하며, “향후 다양한 조직 및 장기 특성을 모사하고 생물학적 분석과 약물 효능 평가를 고효율로 수행할 수 있는 동물실험 대체용 차세대 체외 세포배양 및 분석 기술로 활용될 수 있을 것”이라고 말했다.
바이오및뇌공학과 이기현 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 '어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)'에 2024년 6월 3일 자로 온라인판에 게재됐다.
(https://doi.org/10.1002/adhm.202303716. 논문명: Bioprinted multi-composition array mimicking tumor microenvironment to evaluate drug efficacy with multivariable analysis).
또한, 이번 논문은 와일리-VCH(Wiley-VCH) 출판사의 ‘핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)’세션과 ‘핫 토픽: 미세유체공학(Hot Topic: Microfluidics)’세션에 동시 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
2024.07.16 조회수 6210 암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
2024.04.08 조회수 9528
암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
2024.04.08 조회수 9528 항암 효과 낮추는 ‘세포 간 이질성’ 극복 전략 찾았다
효과가 높은 신약 및 치료법 개발을 위한 단서가 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원(IBS) 수리 및 계산 과학 연구단 의생명 수학 그룹 CI(Chief Investigator)) 연구팀은 인공지능(AI)을 이용해 동일 외부 자극에 개별 세포마다 반응하는 정도가 다른 ‘세포 간 이질성’의 근본적인 원인을 찾아내고, 이질성을 최소화할 수 있는 전략을 제시했다.
우리 몸속 세포는 약물, 삼투압 변화 등 다양한 외부 자극에 반응하는 신호 전달 체계(signaling pathway)가 있다. 신호 전달 체계는 세포가 외부 환경과 상호작용하며 생존하는 데 핵심적인 역할을 한다. 세포의 신호 전달 체계는 노벨생리의학상의 단골 주제일 정도로 중요하지만, 규명을 위해서는 수십 년에 걸친 연구가 필요하다.
신호 전달 체계는 세포 간 이질성에도 영향을 미친다. 세포 간 이질성은 똑같은 유전자를 가진 세포들이 동일 외부 자극에 다르게 반응하는 정도를 뜻한다. 하지만 복잡한 신호 전달 체계의 전 과정을 직접 관측하는 일이 현재 기술로는 어렵기 때문에 지금까지는 신호 전달 체계와 세포 간 이질성의 명확한 연결고리를 알지 못했다.
세포 간 이질성은 질병 치료에 있어 더욱 중요한 고려 요소다. 가령, 항암제를 투여했을 때 세포 간 이질성으로 인해 일부 암세포만 사멸되고, 일부는 살아남는다면 완치가 되지 않는다. 세포 간 이질성의 근본적인 원인을 찾고, 이질성을 최소화할 수 있는 전략을 도출해야 치료 효과를 높인 신약 설계가 가능해진다.
제1 저자인 홍혁표 IBS 전(前) 학생연수원(現 미국 위스콘신 메디슨대 방문조교수)은 “우리 연구진은 선행 연구(Science Advances, 2022)에서 세포 내 신호 전달 체계를 묘사한 수리 모델을 개발한 바 있다”며 “당시엔 신호 전달 체계의 중간 과정이 한 개의 경로만 있다고 가정해 얻을 수 있는 정보도 한계가 있었지만, 이번 연구에서는 AI를 활용해 중간 과정의 비밀까지 풀어냈다”고 말했다.
연구진은 기계 학습 방법론인 ‘Density-PINNs(Density Physics-Informed Neural Networks)’를 개발해 신호 전달 체계와 세포 간 이질성의 연결고리를 찾았다. 세포가 외부 자극에 노출되면 신호 전달 체계를 거쳐 반응 단백질이 생성된다. 시간에 따라 축적된 반응 단백질의 양을 이용하면 신호 전달 소요 시간의 분포를 추론할 수 있다. 이 분포는 신호 전달 체계가 몇 개의 경로로 구성됐는지를 알려준다. 즉, Density-PINNs를 이용하면 쉽게 관측할 수 있는 반응 단백질의 시계열 데이터로부터 직접 관찰하기 어려운 신호 전달 체계에 대한 정보를 추정할 수 있다는 의미다.
이어 연구진은 실제 대장균의 항생제에 대한 반응 실험 데이터에 Density-PINNs를 적용하여 세포 간 이질성의 원인도 찾았다. 신호 전달 체계가 단일 경로로 이뤄진 때(직렬)에 비해 여러 경로로 이뤄졌을 때(병렬)가 세포 간 이질성이 적다는 것을 알아냈다.
제1 저자인 조현태 연구원은 “추가 연구가 필요하지만, 신호 전달 체계가 병렬 구조일 경우 극단적인 신호가 서로 상쇄되어서 세포 간 이질성이 적어지는 것으로 보인다”며 “신호 전달 체계가 병렬 구조를 보이도록 약물이나 화학 요법 치료 전략을 세우면 치료 효과를 높일 수 있다는 의미”라고 설명했다.
연구를 이끈 김재경 교수는 “복잡한 세포 신호 전달 체계의 전 과정을 파악하려면 수십 년의 연구가 필요하지만, 우리 연구진이 제시한 방법론은 수 시간 내에 치료에 필요한 핵심 정보만 알아내 치료에 활용할 수 있다”며 “이번 연구를 실제 현장에서 사용되는 약물에 적용하여 치료 효과를 개선할 수 있기를 기대한다”고 말했다.
연구 결과는 지난해 12월 26일 국제학술지 셀(Cell)의 자매지인 ‘패턴스(Patterns)’에 실렸다.
※ 논문명: Density physics-informed neural networks reveal sources of cell heterogeneity in signal transduction
2024.01.17 조회수 5946
항암 효과 낮추는 ‘세포 간 이질성’ 극복 전략 찾았다
효과가 높은 신약 및 치료법 개발을 위한 단서가 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원(IBS) 수리 및 계산 과학 연구단 의생명 수학 그룹 CI(Chief Investigator)) 연구팀은 인공지능(AI)을 이용해 동일 외부 자극에 개별 세포마다 반응하는 정도가 다른 ‘세포 간 이질성’의 근본적인 원인을 찾아내고, 이질성을 최소화할 수 있는 전략을 제시했다.
우리 몸속 세포는 약물, 삼투압 변화 등 다양한 외부 자극에 반응하는 신호 전달 체계(signaling pathway)가 있다. 신호 전달 체계는 세포가 외부 환경과 상호작용하며 생존하는 데 핵심적인 역할을 한다. 세포의 신호 전달 체계는 노벨생리의학상의 단골 주제일 정도로 중요하지만, 규명을 위해서는 수십 년에 걸친 연구가 필요하다.
신호 전달 체계는 세포 간 이질성에도 영향을 미친다. 세포 간 이질성은 똑같은 유전자를 가진 세포들이 동일 외부 자극에 다르게 반응하는 정도를 뜻한다. 하지만 복잡한 신호 전달 체계의 전 과정을 직접 관측하는 일이 현재 기술로는 어렵기 때문에 지금까지는 신호 전달 체계와 세포 간 이질성의 명확한 연결고리를 알지 못했다.
세포 간 이질성은 질병 치료에 있어 더욱 중요한 고려 요소다. 가령, 항암제를 투여했을 때 세포 간 이질성으로 인해 일부 암세포만 사멸되고, 일부는 살아남는다면 완치가 되지 않는다. 세포 간 이질성의 근본적인 원인을 찾고, 이질성을 최소화할 수 있는 전략을 도출해야 치료 효과를 높인 신약 설계가 가능해진다.
제1 저자인 홍혁표 IBS 전(前) 학생연수원(現 미국 위스콘신 메디슨대 방문조교수)은 “우리 연구진은 선행 연구(Science Advances, 2022)에서 세포 내 신호 전달 체계를 묘사한 수리 모델을 개발한 바 있다”며 “당시엔 신호 전달 체계의 중간 과정이 한 개의 경로만 있다고 가정해 얻을 수 있는 정보도 한계가 있었지만, 이번 연구에서는 AI를 활용해 중간 과정의 비밀까지 풀어냈다”고 말했다.
연구진은 기계 학습 방법론인 ‘Density-PINNs(Density Physics-Informed Neural Networks)’를 개발해 신호 전달 체계와 세포 간 이질성의 연결고리를 찾았다. 세포가 외부 자극에 노출되면 신호 전달 체계를 거쳐 반응 단백질이 생성된다. 시간에 따라 축적된 반응 단백질의 양을 이용하면 신호 전달 소요 시간의 분포를 추론할 수 있다. 이 분포는 신호 전달 체계가 몇 개의 경로로 구성됐는지를 알려준다. 즉, Density-PINNs를 이용하면 쉽게 관측할 수 있는 반응 단백질의 시계열 데이터로부터 직접 관찰하기 어려운 신호 전달 체계에 대한 정보를 추정할 수 있다는 의미다.
이어 연구진은 실제 대장균의 항생제에 대한 반응 실험 데이터에 Density-PINNs를 적용하여 세포 간 이질성의 원인도 찾았다. 신호 전달 체계가 단일 경로로 이뤄진 때(직렬)에 비해 여러 경로로 이뤄졌을 때(병렬)가 세포 간 이질성이 적다는 것을 알아냈다.
제1 저자인 조현태 연구원은 “추가 연구가 필요하지만, 신호 전달 체계가 병렬 구조일 경우 극단적인 신호가 서로 상쇄되어서 세포 간 이질성이 적어지는 것으로 보인다”며 “신호 전달 체계가 병렬 구조를 보이도록 약물이나 화학 요법 치료 전략을 세우면 치료 효과를 높일 수 있다는 의미”라고 설명했다.
연구를 이끈 김재경 교수는 “복잡한 세포 신호 전달 체계의 전 과정을 파악하려면 수십 년의 연구가 필요하지만, 우리 연구진이 제시한 방법론은 수 시간 내에 치료에 필요한 핵심 정보만 알아내 치료에 활용할 수 있다”며 “이번 연구를 실제 현장에서 사용되는 약물에 적용하여 치료 효과를 개선할 수 있기를 기대한다”고 말했다.
연구 결과는 지난해 12월 26일 국제학술지 셀(Cell)의 자매지인 ‘패턴스(Patterns)’에 실렸다.
※ 논문명: Density physics-informed neural networks reveal sources of cell heterogeneity in signal transduction
2024.01.17 조회수 5946 면역항암치료 부작용 인공지능으로 예측
면역항암치료는 환자의 면역 시스템을 활성화해 암을 치료하는 혁신적인 3세대 항암 치료 방법으로 알려져 있다. 하지만 면역항암 치료제는 면역활성화에 의해 기존 항암제와는 구분되는 자가면역질환과 유사한 부작용을 유발할 수 있다는 새로운 문제가 제기됐다. 이러한 부작용은 심각한 경우 환자를 죽음에까지 이르게 할 수 있기에 부작용에 대한 연구가 절실한 상황에 놓여있다.
우리 대학 바이오및뇌공학과 최정균 교수팀과 서울아산병원 종양내과 박숙련 교수팀은 면역항암제 치료를 받은 고형암 환자에 대한 대규모 전향적 코호트를 구축하고, 다차원적 분석을 통해 면역항암제 부작용의 위험요인을 규명했다고 22일 밝혔다. 또한 인공지능 딥러닝을 이용해 치료 전 환자에게서 부작용이 나타날지를 예측할 수 있는 모델까지도 개발했다고 알렸다.
기존의 관련 연구들은 소규모로 진행이 되거나, 적은 수의 지표로 국한된 범위에 대해서만 행해졌다. 또한 수행된 연구들은 면역 관련 부작용을 위해 디자인된 연구 설계가 아닌, 다른 목적을 위해 모집된 환자군을 모아 수행하는 후향적 연구 설계로 진행됐다는 한계점이 있었다.
연구팀은 이러한 한계점을 극복하기 위해, 서울아산병원을 필두로 국내 9개 기관과 협력하여 면역 관련 부작용의 포괄적인 위험요인을 밝히기 위한 대규모 전향적 코호트를 구축했다. 또한 환자의 유전체, 전사체, 혈액 지표 등 폭넓은 범위에서 면역 관련 부작용에 대한 위험요인을 밝혀냄으로써, 궁극적으로는 치료 전 미리 환자가 면역항암치료에 대한 부작용을 보일지 알아낼 수 있는 딥러닝 예측 모델을 개발했다. 해당 연구 결과는 다양한 고형암 환자의 임상데이터와 혈액 유전체 데이터에 기반했기에, 향후 환자의 암종과 상관없이 폭넓게 적용될 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 성창환 박사(現 : 서울아산병원 핵의학과)와 안진현 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 캔서(Nature Cancer)’ 에 게재됐다. (논문명 : Integrative analysis of risk factors for immune-related adverse events of checkpoint blockade therapy in cancer).
이번 연구에는 고려대학교 안암병원, 인제대학교 해운대백병원, 국립암센터, 서울삼성병원, 분당서울대학교병원, 고려대학교 구로병원, 연세대학교 세브란스병원, 서울대학교병원의 연구자들도 참여했다.
최정균 교수는 “이번 연구를 통해 면역항암 치료의 아킬레스건이라고 할 수 있는 면역관련 부작용에 대한 폭넓은 분석과 예측모델의 제시를 통해 향후 전세계 연구진이 사용할 수 있는 대규모 면역관련 부작용 리소스를 제공할 수 있을 것이라 기대한다”라고 말했다.
임상연구를 총괄한 서울아산병원 박숙련 교수는 “현재 면역항암제가 임상에서 광범위하게 사용되고 있고 그 치료 영역을 완치적 세팅으로까지 확장하고 있어 치료 효과뿐 아니라 환자 안전성이 더욱 중요한데 그동안 치료 부작용을 예측할 수 있는 좋은 지표가 없던 상황에서, 이번 연구 결과는 개별 환자의 임상데이터와 유전체 데이터에 기반해 면역항암제의 부작용 발생을 예측할 수 있어 암 환자의 정밀 의료 치료를 실현할 수 있는 기반이 될 것으로 기대한다”고 전했다.
이번 연구는 과학기술정보통신부 인공지능 신약개발 플랫폼 구축 사업의 지원을 받아 수행됐다.
2023.06.22 조회수 8265
면역항암치료 부작용 인공지능으로 예측
면역항암치료는 환자의 면역 시스템을 활성화해 암을 치료하는 혁신적인 3세대 항암 치료 방법으로 알려져 있다. 하지만 면역항암 치료제는 면역활성화에 의해 기존 항암제와는 구분되는 자가면역질환과 유사한 부작용을 유발할 수 있다는 새로운 문제가 제기됐다. 이러한 부작용은 심각한 경우 환자를 죽음에까지 이르게 할 수 있기에 부작용에 대한 연구가 절실한 상황에 놓여있다.
우리 대학 바이오및뇌공학과 최정균 교수팀과 서울아산병원 종양내과 박숙련 교수팀은 면역항암제 치료를 받은 고형암 환자에 대한 대규모 전향적 코호트를 구축하고, 다차원적 분석을 통해 면역항암제 부작용의 위험요인을 규명했다고 22일 밝혔다. 또한 인공지능 딥러닝을 이용해 치료 전 환자에게서 부작용이 나타날지를 예측할 수 있는 모델까지도 개발했다고 알렸다.
기존의 관련 연구들은 소규모로 진행이 되거나, 적은 수의 지표로 국한된 범위에 대해서만 행해졌다. 또한 수행된 연구들은 면역 관련 부작용을 위해 디자인된 연구 설계가 아닌, 다른 목적을 위해 모집된 환자군을 모아 수행하는 후향적 연구 설계로 진행됐다는 한계점이 있었다.
연구팀은 이러한 한계점을 극복하기 위해, 서울아산병원을 필두로 국내 9개 기관과 협력하여 면역 관련 부작용의 포괄적인 위험요인을 밝히기 위한 대규모 전향적 코호트를 구축했다. 또한 환자의 유전체, 전사체, 혈액 지표 등 폭넓은 범위에서 면역 관련 부작용에 대한 위험요인을 밝혀냄으로써, 궁극적으로는 치료 전 미리 환자가 면역항암치료에 대한 부작용을 보일지 알아낼 수 있는 딥러닝 예측 모델을 개발했다. 해당 연구 결과는 다양한 고형암 환자의 임상데이터와 혈액 유전체 데이터에 기반했기에, 향후 환자의 암종과 상관없이 폭넓게 적용될 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 성창환 박사(現 : 서울아산병원 핵의학과)와 안진현 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 캔서(Nature Cancer)’ 에 게재됐다. (논문명 : Integrative analysis of risk factors for immune-related adverse events of checkpoint blockade therapy in cancer).
이번 연구에는 고려대학교 안암병원, 인제대학교 해운대백병원, 국립암센터, 서울삼성병원, 분당서울대학교병원, 고려대학교 구로병원, 연세대학교 세브란스병원, 서울대학교병원의 연구자들도 참여했다.
최정균 교수는 “이번 연구를 통해 면역항암 치료의 아킬레스건이라고 할 수 있는 면역관련 부작용에 대한 폭넓은 분석과 예측모델의 제시를 통해 향후 전세계 연구진이 사용할 수 있는 대규모 면역관련 부작용 리소스를 제공할 수 있을 것이라 기대한다”라고 말했다.
임상연구를 총괄한 서울아산병원 박숙련 교수는 “현재 면역항암제가 임상에서 광범위하게 사용되고 있고 그 치료 영역을 완치적 세팅으로까지 확장하고 있어 치료 효과뿐 아니라 환자 안전성이 더욱 중요한데 그동안 치료 부작용을 예측할 수 있는 좋은 지표가 없던 상황에서, 이번 연구 결과는 개별 환자의 임상데이터와 유전체 데이터에 기반해 면역항암제의 부작용 발생을 예측할 수 있어 암 환자의 정밀 의료 치료를 실현할 수 있는 기반이 될 것으로 기대한다”고 전했다.
이번 연구는 과학기술정보통신부 인공지능 신약개발 플랫폼 구축 사업의 지원을 받아 수행됐다.
2023.06.22 조회수 8265 암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다.
조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것에 주목하였다. 컴퓨터 시뮬레이션 분석을 통해 특정 조건에서 유전자 돌연변이에 의해 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복(가역화)될 수 있음을 발견했으며, 분자세포실험을 통해 이와 같은 입출력 관계의 회복이 실제 암세포에서 나타난다는 것을 입증했다.
우리 대학 주재일 박사, 박화정 박사가 참여한 이번 연구결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 6월 2일 字 온라인판 논문으로 출판됐다. (논문명: Normalizing input-output relationships of cancer networks for reversion therapy)
조광현 교수 연구팀은 암세포의 왜곡된 입출력 관계가 정상세포의 정상적인 입출력 관계로 회복될 수 있는 이유는 생명체의 오랜 진화과정에서 획득된 세포내 유전자 조절 네트워크의 견실성(robustness)과 중복성(redundancy)에 기인한다는 것을 규명했다. 또한 암 가역화를 위한 조절 타겟으로 유력한 유전자들이 존재한다는 것을 발견했고 이 유전자들을 조절하면 실제로 암세포의 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복된다는 것을 암세포 분자세포실험을 통해 증명했다.
이번 연구성과는 실제 암세포가 정상세포로 가역화 될 수 있는 현상이 우연한 것이 아니며, 암세포 가역화를 유도할 수 있는 타겟을 체계적으로 탐색하고 이를 조절하는 약물을 개발함으로써 혁신 항암제의 개발이 가능함을 보여준 것이어서 그 의미가 크다.
조광현 교수는 "현행 항암치료의 한계를 극복할 수 있는 새로운 암 가역치료 전략에 대한 근본적인 원리를 밝히는 데 성공함으로써 암 환자의 예후와 삶의 질을 모두 증진시킬 수 있는 혁신 신약 개발의 가능성을 높이게 되었다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역치료 개념을 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장세포로 되돌리는 연구결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 그리고 2023년 1월에는 전이 능력을 획득한 폐암 세포를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 연구에 성공한 바 있다. 하지만 이와 같은 성과들은 서로 다른 암종에서 개별적으로 연구되어진 사례연구였기 때문에, 어떠한 공통된 원리로 암가역화가 여러 암종에서 발생가능한지는 밝히지 못했다. 이번 연구 결과는 이러한 암가역화의 보편적인 원리와 진화적 기원을 밝힌 최초의 연구다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2023.06.08 조회수 10359
암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다.
조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것에 주목하였다. 컴퓨터 시뮬레이션 분석을 통해 특정 조건에서 유전자 돌연변이에 의해 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복(가역화)될 수 있음을 발견했으며, 분자세포실험을 통해 이와 같은 입출력 관계의 회복이 실제 암세포에서 나타난다는 것을 입증했다.
우리 대학 주재일 박사, 박화정 박사가 참여한 이번 연구결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 6월 2일 字 온라인판 논문으로 출판됐다. (논문명: Normalizing input-output relationships of cancer networks for reversion therapy)
조광현 교수 연구팀은 암세포의 왜곡된 입출력 관계가 정상세포의 정상적인 입출력 관계로 회복될 수 있는 이유는 생명체의 오랜 진화과정에서 획득된 세포내 유전자 조절 네트워크의 견실성(robustness)과 중복성(redundancy)에 기인한다는 것을 규명했다. 또한 암 가역화를 위한 조절 타겟으로 유력한 유전자들이 존재한다는 것을 발견했고 이 유전자들을 조절하면 실제로 암세포의 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복된다는 것을 암세포 분자세포실험을 통해 증명했다.
이번 연구성과는 실제 암세포가 정상세포로 가역화 될 수 있는 현상이 우연한 것이 아니며, 암세포 가역화를 유도할 수 있는 타겟을 체계적으로 탐색하고 이를 조절하는 약물을 개발함으로써 혁신 항암제의 개발이 가능함을 보여준 것이어서 그 의미가 크다.
조광현 교수는 "현행 항암치료의 한계를 극복할 수 있는 새로운 암 가역치료 전략에 대한 근본적인 원리를 밝히는 데 성공함으로써 암 환자의 예후와 삶의 질을 모두 증진시킬 수 있는 혁신 신약 개발의 가능성을 높이게 되었다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역치료 개념을 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장세포로 되돌리는 연구결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 그리고 2023년 1월에는 전이 능력을 획득한 폐암 세포를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 연구에 성공한 바 있다. 하지만 이와 같은 성과들은 서로 다른 암종에서 개별적으로 연구되어진 사례연구였기 때문에, 어떠한 공통된 원리로 암가역화가 여러 암종에서 발생가능한지는 밝히지 못했다. 이번 연구 결과는 이러한 암가역화의 보편적인 원리와 진화적 기원을 밝힌 최초의 연구다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2023.06.08 조회수 10359 항암 백신 찾는 ‘딥네오(DeepNeo)’ 개발
신생항원이란 암세포의 돌연변이에서 나온 단백질 조각 중 면역반응을 유도할 수 있는 항원들로서 항암 백신 개발의 이상적인 대상으로 주목받고 있다. 모더나 및 바이오엔텍은 암 치료를 위한 신생항원 백신용으로 개발하던 mRNA 플랫폼을 사용해 COVID-19 백신을 성공적으로 개발한 바 있으며, 현재 대규모 제약회사들과 함께 신생항원 암 백신 임상시험을 진행하고 있다. 이런 암 백신 개발을 위해 핵심적인 단계인 환자 맞춤형 신생항원 발굴에 활용될 인공지능 플랫폼이 개발되어 화제다.
우리 대학 바이오및뇌공학과 최정균 교수가 ㈜펜타메딕스와의 공동연구를 통해 개인 맞춤 치료용 암 백신에 사용될 수 있는 신생항원을 예측하는 인공지능(AI) 모델을 개발하고 웹서비스를 구축했다고 17일 밝혔다.
최정균 교수 연구팀은 딥러닝을 이용해 실제로 T 세포 면역반응을 유도할 수 있는 신생항원을 발굴하는 AI 모델을 개발했으며, 연구자들이 손쉽게 활용할 수 있는 웹서비스를 구축해 DeepNeo라는 이름으로 공개했다 (https://deepneo.net).
기존의 신생항원 발굴 방법론은 MHC* 단백질과 결합할 수 있는 돌연변이를 예측하는 데에 한정되어 있었다. 그러나 암 백신이 효과가 있으려면 돌연변이가 MHC와 결합할 뿐만 아니라 그 결합체가 실제로 T 세포 면역반응을 유발할 수 있어야 하는데, 기존 기술로는 그것이 불가능했다. 따라서 현재 암 백신 임상시험들은 이 결합체들이 실제로 면역반응을 자극할 수 있는지를 알 수 없는 상태로 진행되고 있다.
*MHC란 외부에서 들어온 병원균이나 암세포에서 발생한 항원과 결합하여 우리 몸의 면역세포에 제시해 줌으로써 면역반응을 활성화시키는 역할을 하는 단백질을 일컬음
연구팀은 이러한 문제를 해결하기 위해 새로운 개념의 딥러닝 모델을 구축했고, 여러 빅데이터 분석을 통하여 면역성 및 항암 반응성이 뛰어난 신생항원을 발굴할 수 있음을 확인했다. 따라서 이번에 웹서비스 형태로 구축한 방법론은T 세포 반응을 효과적으로 유도할 수 있는 항암 백신 개발에 활용될 수 있다.
우리 대학 바이오및뇌공학과 김정연 박사과정이 제1 저자로 개발한 핵심 알고리즘은 지난 1월 국제 학술지 ‘네이처 지네틱스(Nature Genetics)’ 에 출판됐으며, 이후 ㈜펜타메딕스의 노승재 박사, 방효은 연구원과의 공동연구를 통해 딥러닝 성능이 더욱 개선된 AI 모델이 웹서비스 형태로 개발돼 이번 4월 국제 학술지 ‘핵산 연구(Nucleic Acids Research)’를 통해 공개됐다.
최정균 교수는 “코로나 백신에서 mRNA 플랫폼이 검증된 만큼 이번에 개발된 AI 기술이 암 백신의 상용화에도 도움이 되기를 희망한다.”고 밝혔다. ㈜펜타메딕스 조대연 대표는 “이번 공동연구를 통해 개발된 플랫폼을 적용한 개인맞춤형 암 백신의 사업화에 박차를 가하겠다”고 전했다.
이번 연구는 한국연구재단 기초연구실지원사업의 지원을 받아 수행됐다.
2023.05.17 조회수 10219
항암 백신 찾는 ‘딥네오(DeepNeo)’ 개발
신생항원이란 암세포의 돌연변이에서 나온 단백질 조각 중 면역반응을 유도할 수 있는 항원들로서 항암 백신 개발의 이상적인 대상으로 주목받고 있다. 모더나 및 바이오엔텍은 암 치료를 위한 신생항원 백신용으로 개발하던 mRNA 플랫폼을 사용해 COVID-19 백신을 성공적으로 개발한 바 있으며, 현재 대규모 제약회사들과 함께 신생항원 암 백신 임상시험을 진행하고 있다. 이런 암 백신 개발을 위해 핵심적인 단계인 환자 맞춤형 신생항원 발굴에 활용될 인공지능 플랫폼이 개발되어 화제다.
우리 대학 바이오및뇌공학과 최정균 교수가 ㈜펜타메딕스와의 공동연구를 통해 개인 맞춤 치료용 암 백신에 사용될 수 있는 신생항원을 예측하는 인공지능(AI) 모델을 개발하고 웹서비스를 구축했다고 17일 밝혔다.
최정균 교수 연구팀은 딥러닝을 이용해 실제로 T 세포 면역반응을 유도할 수 있는 신생항원을 발굴하는 AI 모델을 개발했으며, 연구자들이 손쉽게 활용할 수 있는 웹서비스를 구축해 DeepNeo라는 이름으로 공개했다 (https://deepneo.net).
기존의 신생항원 발굴 방법론은 MHC* 단백질과 결합할 수 있는 돌연변이를 예측하는 데에 한정되어 있었다. 그러나 암 백신이 효과가 있으려면 돌연변이가 MHC와 결합할 뿐만 아니라 그 결합체가 실제로 T 세포 면역반응을 유발할 수 있어야 하는데, 기존 기술로는 그것이 불가능했다. 따라서 현재 암 백신 임상시험들은 이 결합체들이 실제로 면역반응을 자극할 수 있는지를 알 수 없는 상태로 진행되고 있다.
*MHC란 외부에서 들어온 병원균이나 암세포에서 발생한 항원과 결합하여 우리 몸의 면역세포에 제시해 줌으로써 면역반응을 활성화시키는 역할을 하는 단백질을 일컬음
연구팀은 이러한 문제를 해결하기 위해 새로운 개념의 딥러닝 모델을 구축했고, 여러 빅데이터 분석을 통하여 면역성 및 항암 반응성이 뛰어난 신생항원을 발굴할 수 있음을 확인했다. 따라서 이번에 웹서비스 형태로 구축한 방법론은T 세포 반응을 효과적으로 유도할 수 있는 항암 백신 개발에 활용될 수 있다.
우리 대학 바이오및뇌공학과 김정연 박사과정이 제1 저자로 개발한 핵심 알고리즘은 지난 1월 국제 학술지 ‘네이처 지네틱스(Nature Genetics)’ 에 출판됐으며, 이후 ㈜펜타메딕스의 노승재 박사, 방효은 연구원과의 공동연구를 통해 딥러닝 성능이 더욱 개선된 AI 모델이 웹서비스 형태로 개발돼 이번 4월 국제 학술지 ‘핵산 연구(Nucleic Acids Research)’를 통해 공개됐다.
최정균 교수는 “코로나 백신에서 mRNA 플랫폼이 검증된 만큼 이번에 개발된 AI 기술이 암 백신의 상용화에도 도움이 되기를 희망한다.”고 밝혔다. ㈜펜타메딕스 조대연 대표는 “이번 공동연구를 통해 개발된 플랫폼을 적용한 개인맞춤형 암 백신의 사업화에 박차를 가하겠다”고 전했다.
이번 연구는 한국연구재단 기초연구실지원사업의 지원을 받아 수행됐다.
2023.05.17 조회수 10219