-
 획기적 암 치료제를 만들 단백질 코드 규명
우리 대학 의과학대학원 이지민 교수 연구팀이 유럽분자생물학연구소(EMBL) 미하일 사비스키(Mikhail Savitski) 교수, 서울대학교 백성희 교수와 공동 연구를 통해 질환의 억제와 촉진의 실마리가 되는 단백질 수명을 결정하는 단백질 *번역 후 조절(post-translational modification, 이하 PTM) 코드를 규명했다고 1일 밝혔다.
* 번역 후 조절(PTM): DNA가 mRNA가는 전사 과정을 거쳐 최종 단백질로 번역까지 일어난 이후에 추가적으로 생기는 현상으로, 단백질의 구조나 효능에 영향을 미치는 것으로 주로 알려져 있음
연구팀은 기존에 단백질의 운명 조절과 연관이 없을 것으로 생각됐던 PTM 신호를 `PTM-활성화(PTM-activated) 데그론'과 `PTM-불활성화(PTM-inactivated) 데그론'으로 구분해 단백질 수명 조절과의 관련성을 규명했다.
*PTM 활성화 데그론과 PTM 볼활성화 데그론: PTM에 의해 데그론이 활성화 되는 것은 단백질의 번역후 변화가 단백질의 분해를 촉진했다는 것을 의미하며, 반대로 불활성화 데그론은 번역 후 조절 신호가 단백질의 분해를 억제하여 단백질의 축적이 일어났음을 의미
여기서 데그론 코드란 단백질 수준을 조절 가능한 아미노산 서열의 조합 개념으로 질병의 진행이나 억제의 스위치 역할을 하는 단백질의 수명 조절 코드를 말한다.
연구팀은 이를 규명한 결과 기존 치료제가 접근할 수 없는 `기존에 약으로 만들지 못했던(Undruggable)' 신규 타깃의 정확도 높은 치료법 개발의 가능성을 열었다.
또한 연구팀은 신규 PTM 관련 코드를 다각화함으로 인해 단백질 분해 및 생성의 근본 원인을 알 수 없었던 기존의 신호 전달 체계에 PTM을 유도하거나 제거하는 효소의 역할을 재조명했다. 이번 연구를 통해 질병 관련 단백질 수명 변화 기원을 PTM 코드로 디지털화해서 미리 규명을 함으로써 그동안 단백질 수준을 마지막 단계에서 조절하는 *유비퀴틴 신호에만 집중했던 부분을 변경하도록 제안했다.
* 유비퀴틴: 단백질이 분해되기 전에 먼저 일어나는 대표적인 화학적 변화로 알려져 있으며 없어져야 할 단백질에 붙는 표지자로 널리 알려져 있음
우리 대학 의과학대학원 이지민 교수가 제1 저자로 초청돼 기고한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications, IF 17.69)' 에 지난 1월 13일 字 출판됐다. (논문명 : Control of protein stability by post-translational modifications).
이지민 교수는 "새롭게 제시한 PTM-활성화 또는 PTM-불활성화 데그론 코드의 규격화는 기존 약에 반응하지 않거나 저항성이 생기는 단백질 수준을 조절 가능한 다양한 질병 (대표적으로 암이나 퇴행성 뇌질환)의 진단 및 의약품 개발로 발전시킬 수 있을 것으로 기대된다ˮ 고 밝혔다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 리더연구사업,유럽분자생물학연구소 및 과학기술정보통신부 의사과학자양성사업의 지원을 받아 수행됐다.
획기적 암 치료제를 만들 단백질 코드 규명
우리 대학 의과학대학원 이지민 교수 연구팀이 유럽분자생물학연구소(EMBL) 미하일 사비스키(Mikhail Savitski) 교수, 서울대학교 백성희 교수와 공동 연구를 통해 질환의 억제와 촉진의 실마리가 되는 단백질 수명을 결정하는 단백질 *번역 후 조절(post-translational modification, 이하 PTM) 코드를 규명했다고 1일 밝혔다.
* 번역 후 조절(PTM): DNA가 mRNA가는 전사 과정을 거쳐 최종 단백질로 번역까지 일어난 이후에 추가적으로 생기는 현상으로, 단백질의 구조나 효능에 영향을 미치는 것으로 주로 알려져 있음
연구팀은 기존에 단백질의 운명 조절과 연관이 없을 것으로 생각됐던 PTM 신호를 `PTM-활성화(PTM-activated) 데그론'과 `PTM-불활성화(PTM-inactivated) 데그론'으로 구분해 단백질 수명 조절과의 관련성을 규명했다.
*PTM 활성화 데그론과 PTM 볼활성화 데그론: PTM에 의해 데그론이 활성화 되는 것은 단백질의 번역후 변화가 단백질의 분해를 촉진했다는 것을 의미하며, 반대로 불활성화 데그론은 번역 후 조절 신호가 단백질의 분해를 억제하여 단백질의 축적이 일어났음을 의미
여기서 데그론 코드란 단백질 수준을 조절 가능한 아미노산 서열의 조합 개념으로 질병의 진행이나 억제의 스위치 역할을 하는 단백질의 수명 조절 코드를 말한다.
연구팀은 이를 규명한 결과 기존 치료제가 접근할 수 없는 `기존에 약으로 만들지 못했던(Undruggable)' 신규 타깃의 정확도 높은 치료법 개발의 가능성을 열었다.
또한 연구팀은 신규 PTM 관련 코드를 다각화함으로 인해 단백질 분해 및 생성의 근본 원인을 알 수 없었던 기존의 신호 전달 체계에 PTM을 유도하거나 제거하는 효소의 역할을 재조명했다. 이번 연구를 통해 질병 관련 단백질 수명 변화 기원을 PTM 코드로 디지털화해서 미리 규명을 함으로써 그동안 단백질 수준을 마지막 단계에서 조절하는 *유비퀴틴 신호에만 집중했던 부분을 변경하도록 제안했다.
* 유비퀴틴: 단백질이 분해되기 전에 먼저 일어나는 대표적인 화학적 변화로 알려져 있으며 없어져야 할 단백질에 붙는 표지자로 널리 알려져 있음
우리 대학 의과학대학원 이지민 교수가 제1 저자로 초청돼 기고한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications, IF 17.69)' 에 지난 1월 13일 字 출판됐다. (논문명 : Control of protein stability by post-translational modifications).
이지민 교수는 "새롭게 제시한 PTM-활성화 또는 PTM-불활성화 데그론 코드의 규격화는 기존 약에 반응하지 않거나 저항성이 생기는 단백질 수준을 조절 가능한 다양한 질병 (대표적으로 암이나 퇴행성 뇌질환)의 진단 및 의약품 개발로 발전시킬 수 있을 것으로 기대된다ˮ 고 밝혔다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 리더연구사업,유럽분자생물학연구소 및 과학기술정보통신부 의사과학자양성사업의 지원을 받아 수행됐다.
2023.02.01
조회수 9249
-
 질병 세포만 찾아 교정치료 가능한 유전자 가위 시스템 개발
우리 대학 의과학대학원 이지민 교수 연구팀이 한국과학기술연구원(KIST) 오승자 선임연구원, 강원대학교 이주용 교수와 공동 연구를 통해 질병 세포에서만 핵 내 유전자 교정을 수행할 수 있는 유전자 가위 시스템(CRISPR/Cas9)을 개발했다고 14일 밝혔다.
연구팀은 세포 내 마이크로RNA가 특정 서열을 인식해 절단한다는 특성을 활용해, 질병 세포에서 과발현되는 마이크로RNA에 의해 특이적으로 절단될 수 있는 링커를 연결한 유전자 가위 시스템을 설계했다. 이렇게 설계된 시스템은 질병 세포 특이적 마이크로RNA가 적은 정상세포에서는 세포질에 머물러 유전자 교정을 수행하지 않지만, 질병 세포에서는 링커가 절단되면서 유전자 가위가 세포핵으로 들어가 유전자 교정을 수행할 수 있다.
이러한 플랫폼은 유전자 가위를 질병 세포에서만 기능 할 수 있게 해 정상세포와 질병 세포가 혼합돼있는 실제 환자에게도 효과적인 유전자 교정 치료를 진행할 수 있을 것으로 기대된다.
KIST 신철희 박사와 우리 대학 의과학대학원 박수찬 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `뉴클레익 엑시드 리서치(Nucleic Acids Research, IF 16.971)' 온라인판에 지난달 30일 자 출판됐다. (논문명 : Cytosolic microRNA-inducible nuclear translocation of Cas9 protein for disease-specific genome modification).
마이크로RNA는 유전자를 전사 후 조절하는 19~24 뉴클레오티드(DNA나 RNA의 기본 단위) 길이의 RNA다. 마이크로RNA는 DNA로부터 전사된 메신저 RNA에 아르고너트(Argonaute; Ago) 단백질을 통해 결합하며, 결합한 메신저 RNA를 절단한다. 마이크로RNA의 비정상적인 발현이 다양한 질병에서 보고되고 있으며, 질병의 치료를 위한 표적 바이오마커로 많이 연구되고 있다.
다양한 질병에서 마이크로RNA를 표적으로 하는 치료법들이 빠르게 연구되고 있지만, 치료 물질의 전달 및 투여량의 문제, 세포 독성 및 비정상적 면역 반응 활성화 등의 문제가 있다.
유전자 가위 시스템은 단일 가이드 RNA(single guide RNA)를 조합해 정교한 유전자 교정을 수행하는 매우 효과적인 도구다. 하지만, 이 시스템의 실제 활용에는 기술적 한계들이 존재한다. 가장 큰 문제는 안정성 문제로, 표적 유전자가 아닌 다른 유전자를 편집하는 오프-타겟 이펙트(off-target effect)다. 또한, 다양한 세포가 혼합된 환경에서는 유전자 교정을 수행하기 어렵다.
연구팀은 이러한 문제를 해결하기 위해 질병 세포 본연의 생태를 활용하는 접근법을 고안했다. 연구팀은 핵 위치 신호(Nuclear localization signal; NLS)가 부착된 기존 유전자 가위(Cas9)에 핵 외 수송신호(Nuclear export signal; NES)를 연결한 질병 세포 마이크로RNA의 메신저 RNA 표적 서열을 결합한 유전자 가위를 제작했고, 이를 유전자 가위 `셀프 체크인'으로 명명했다.
연구팀은 인간 질병 세포에서 과발현되는 마이크로RNA-21의 표적 서열과 실험용 쥐의 마이크로RNA-294의 표적 서열을 연결한 유전자 가위의 인간 질병 세포 내 유전자 교정 기능을 비교했고, 마이크로RNA-21 표적 서열 연결 유전자 가위만이 세포 내 마이크로RNA-21에 의해 절단돼 핵까지 전달되어 기능을 수행할 수 있음을 확인했다.
연구팀은 다양한 폐암 세포에서 마이크로RNA-21의 발현량과 발암 단백질 Ezh2가 양의 상관관계가 있다는 것을 증명했고, `셀프 체크인'을 적용해 마이크로RNA-21이 과발현된 폐암 세포에서 발암 유전자 Ezh2의 유전자 교정을 성공적으로 수행했다.
또한, 암세포는 항암 약물에 지속해서 노출되게 되면, 약물 저항성을 획득하게 되는데, 연구팀은 폐암 세포에서 마이크로RNA-21과 Ezh2의 발현이 항암 약물 시스플라틴을 투여하면 오히려 증가함을 확인했다. 유전자 가위 셀프 체크인 기술을 통한 Ezh2 유전자 교정과 항암제(시스플라틴)의 병행 사용은 폐암 세포의 성장을 더욱 효과적으로 억제할 수 있음을 마우스 실험을 통해서 밝혔다.
연구팀이 개발한 유전자 가위 셀프 체크인 기술은 질병 세포에서만 기능하기 때문에, 오프-타겟 이펙트를 최소화할 수 있다는 장점이 있으며, 세포 내 시스템을 활용한다는 점에서 안정성이 높다고 할 수 있다. 또한, 단일 가이드 RNA 및 메신저 RNA 표적 서열을 상황에 맞게 교체해 사용할 수 있어, 다양한 질병에 적용이 가능할 것으로 기대된다.
연구팀은 "유전자 가위 셀프 체크인 기술은 기존 유전자 가위 시스템의 문제를 개선해, 높은 특이성을 가지고 질병 세포에 대한 유전자를 세포 특이적으로 교정할 수 있다는 것을 확인할 수 있다ˮ 라며 "다양한 질병 연관 마이크로RNA에 대응해 기술을 적용할 수 있을 것이다ˮ 라고 전했다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 이공분야기초연구사업 및 한국과학기술연구원 지원을 받아 수행됐다.
질병 세포만 찾아 교정치료 가능한 유전자 가위 시스템 개발
우리 대학 의과학대학원 이지민 교수 연구팀이 한국과학기술연구원(KIST) 오승자 선임연구원, 강원대학교 이주용 교수와 공동 연구를 통해 질병 세포에서만 핵 내 유전자 교정을 수행할 수 있는 유전자 가위 시스템(CRISPR/Cas9)을 개발했다고 14일 밝혔다.
연구팀은 세포 내 마이크로RNA가 특정 서열을 인식해 절단한다는 특성을 활용해, 질병 세포에서 과발현되는 마이크로RNA에 의해 특이적으로 절단될 수 있는 링커를 연결한 유전자 가위 시스템을 설계했다. 이렇게 설계된 시스템은 질병 세포 특이적 마이크로RNA가 적은 정상세포에서는 세포질에 머물러 유전자 교정을 수행하지 않지만, 질병 세포에서는 링커가 절단되면서 유전자 가위가 세포핵으로 들어가 유전자 교정을 수행할 수 있다.
이러한 플랫폼은 유전자 가위를 질병 세포에서만 기능 할 수 있게 해 정상세포와 질병 세포가 혼합돼있는 실제 환자에게도 효과적인 유전자 교정 치료를 진행할 수 있을 것으로 기대된다.
KIST 신철희 박사와 우리 대학 의과학대학원 박수찬 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `뉴클레익 엑시드 리서치(Nucleic Acids Research, IF 16.971)' 온라인판에 지난달 30일 자 출판됐다. (논문명 : Cytosolic microRNA-inducible nuclear translocation of Cas9 protein for disease-specific genome modification).
마이크로RNA는 유전자를 전사 후 조절하는 19~24 뉴클레오티드(DNA나 RNA의 기본 단위) 길이의 RNA다. 마이크로RNA는 DNA로부터 전사된 메신저 RNA에 아르고너트(Argonaute; Ago) 단백질을 통해 결합하며, 결합한 메신저 RNA를 절단한다. 마이크로RNA의 비정상적인 발현이 다양한 질병에서 보고되고 있으며, 질병의 치료를 위한 표적 바이오마커로 많이 연구되고 있다.
다양한 질병에서 마이크로RNA를 표적으로 하는 치료법들이 빠르게 연구되고 있지만, 치료 물질의 전달 및 투여량의 문제, 세포 독성 및 비정상적 면역 반응 활성화 등의 문제가 있다.
유전자 가위 시스템은 단일 가이드 RNA(single guide RNA)를 조합해 정교한 유전자 교정을 수행하는 매우 효과적인 도구다. 하지만, 이 시스템의 실제 활용에는 기술적 한계들이 존재한다. 가장 큰 문제는 안정성 문제로, 표적 유전자가 아닌 다른 유전자를 편집하는 오프-타겟 이펙트(off-target effect)다. 또한, 다양한 세포가 혼합된 환경에서는 유전자 교정을 수행하기 어렵다.
연구팀은 이러한 문제를 해결하기 위해 질병 세포 본연의 생태를 활용하는 접근법을 고안했다. 연구팀은 핵 위치 신호(Nuclear localization signal; NLS)가 부착된 기존 유전자 가위(Cas9)에 핵 외 수송신호(Nuclear export signal; NES)를 연결한 질병 세포 마이크로RNA의 메신저 RNA 표적 서열을 결합한 유전자 가위를 제작했고, 이를 유전자 가위 `셀프 체크인'으로 명명했다.
연구팀은 인간 질병 세포에서 과발현되는 마이크로RNA-21의 표적 서열과 실험용 쥐의 마이크로RNA-294의 표적 서열을 연결한 유전자 가위의 인간 질병 세포 내 유전자 교정 기능을 비교했고, 마이크로RNA-21 표적 서열 연결 유전자 가위만이 세포 내 마이크로RNA-21에 의해 절단돼 핵까지 전달되어 기능을 수행할 수 있음을 확인했다.
연구팀은 다양한 폐암 세포에서 마이크로RNA-21의 발현량과 발암 단백질 Ezh2가 양의 상관관계가 있다는 것을 증명했고, `셀프 체크인'을 적용해 마이크로RNA-21이 과발현된 폐암 세포에서 발암 유전자 Ezh2의 유전자 교정을 성공적으로 수행했다.
또한, 암세포는 항암 약물에 지속해서 노출되게 되면, 약물 저항성을 획득하게 되는데, 연구팀은 폐암 세포에서 마이크로RNA-21과 Ezh2의 발현이 항암 약물 시스플라틴을 투여하면 오히려 증가함을 확인했다. 유전자 가위 셀프 체크인 기술을 통한 Ezh2 유전자 교정과 항암제(시스플라틴)의 병행 사용은 폐암 세포의 성장을 더욱 효과적으로 억제할 수 있음을 마우스 실험을 통해서 밝혔다.
연구팀이 개발한 유전자 가위 셀프 체크인 기술은 질병 세포에서만 기능하기 때문에, 오프-타겟 이펙트를 최소화할 수 있다는 장점이 있으며, 세포 내 시스템을 활용한다는 점에서 안정성이 높다고 할 수 있다. 또한, 단일 가이드 RNA 및 메신저 RNA 표적 서열을 상황에 맞게 교체해 사용할 수 있어, 다양한 질병에 적용이 가능할 것으로 기대된다.
연구팀은 "유전자 가위 셀프 체크인 기술은 기존 유전자 가위 시스템의 문제를 개선해, 높은 특이성을 가지고 질병 세포에 대한 유전자를 세포 특이적으로 교정할 수 있다는 것을 확인할 수 있다ˮ 라며 "다양한 질병 연관 마이크로RNA에 대응해 기술을 적용할 수 있을 것이다ˮ 라고 전했다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 이공분야기초연구사업 및 한국과학기술연구원 지원을 받아 수행됐다.
2022.06.14
조회수 15606
-
 방관자 T세포에 의한 질병 발생 이론 발표
우리 대학 의과학대학원 신의철 교수, 이호영 박사, 정성주 대학원생이 감염질환에서 방관자 (bystander) T세포 활성화의 중요성을 강조하는 주제로 세계적인 면역학 권위지인 `네이처 이뮤놀로지(Nature Immunology)' 8월호에 초청 리뷰 논문을 게재했다고 31일 밝혔다.
인간 질병에서 방관자 T세포의 역할에 관한 연구를 세계적으로 선도하고 있는 신의철 교수 연구팀은 이번 리뷰 논문을 통해 다양한 감염질환에서 방관자 T세포의 역할과 이를 조절하는 기전들을 총체적으로 고찰하고 인간 질병 치료에 응용할 수 있는 미래 연구의 방향을 제시했다.
일반적으로 인체는 바이러스에 감염되면 항바이러스 작용을 하는 T세포가 활성화되어 질병으로부터의 회복을 촉진한다고 알려져 있다. 이때 특정 바이러스에 대응하는 T세포만 활성화되고 관련 없는 T세포들은 활성화되지 않는데, 이러한 현상을 선택적 면역반응이라고 한다. 선택적 면역반응은 T세포가 바이러스의 항원 펩타이드를 인식하면서 이뤄진다.
하지만 바이러스의 종류 및 환자의 면역 체계에 따라, 감염을 일으키는 바이러스와는 상관없는 T세포의 활성화가 일어나게 되는데 이를 방관자 T세포의 활성화라고 이야기한다. 방관자 T세포의 활성화는 바이러스 항원 펩타이드의 존재와는 상관없이 사이토카인(cytokine)에 의해 유발된다고 알려져 있다. 이러한 방관자 T세포의 활성화는 복잡한 감염 이력을 가진 사람의 면역반응을 더 정교하게 이해하기 위해 반드시 고려해야 하는 현상이다.
과거 신의철 교수 연구팀은 2010년대에 한국에서 유행했던 A형 간염 바이러스 감염환자에서 간세포가 심하게 파괴되는 원인으로 방관자 T세포의 활성화 현상을 새롭게 발견해 그 결과를 2018년 권위 있는 면역학 학술지 `이뮤니티(Immunity)'에 보고한 바 있다. 이는 인간 질병에서 방관자 T세포의 역할을 체계적으로 증명한 세계 첫 논문으로 인정받고 있다.
이후 연구팀은 관련 연구를 활발히 지속하며 더 상세한 기전들을 발견해왔다. 간 조직에 상주하며 방관자 활성화를 일으킬 수 있는 T세포를 조절하는 분자를 발견하여 2020년 국제적 학술지 `저널 오브 헤파톨로지 (Journal of Hepatology)'에 보고했고, 특수한 T세포인 점막연관 불변사슬 T세포(MAIT: Mucosal-associated invariant T)도 유사한 활성 과정을 거쳐 간 손상에 기여할 수 있음을 발견해 같은 해 동일 저널에 발표했다.
또한, 최근에는 활성화된 방관자 T세포들이 감염된 조직으로 이동하는데 필요한 세포이동 관련 기전을 발견하여 국제학술지 `셀 리포트 (Cell Reports)'에 보고한 바도 있다.
현재 연구팀은 방관자 T세포 활성화 특성 및 관련 기전을 바이러스 질환 그리고 종양질환에서 밝혀내는 후속 연구를 진행 중이다. 또한, 현재 전 세계적으로 유행 중인 코로나19 감염상황에서 방관자 T세포 활성화 및 역할에 관한 연구도 진행하고 있다.
신의철 교수 연구팀은 방관자 T세포 활성화 연구 분야를 개척하고 확장해 나가고 있는 공로를 인정받아 이번 초청 리뷰 논문을 게재하게 됐다.
이러한 그동안의 연구는 2014년부터 삼성미래기술육성재단의 지속적인 지원을 받아 수행될 수 있었다. 연구팀의 이번 리뷰 논문은 국제 면역학 저명 학술지인 네이처 이뮤놀로지 (Nature Immunology) 誌 8월 5일 字에 게재됐다(논문명: Significance of bystander T cell activation in microbial infection).
이번 연구의 제1 저자인 우리 대학 이호영 박사(박사후 연구원)는 "그동안 면역학계에서 그 중요성을 몰랐던 방관자 T세포 활성화 현상이 이번 리뷰 논문을 통해 크게 주목받기를 기대한다며, 앞으로 다양한 질병에서의 방관자 T세포의 역할 및 관련 기전들의 규명을 위해 노력하겠다ˮ고 말했다.
신의철 교수는 "한국에서 개척한 연구 분야가 국제 면역학계에서 인정을 받는 것이 기쁘다며, 방관자 T세포의 연구가 논문에서만 그치지 않고 신약개발의 단초가 되도록 노력하겠다ˮ 라고 말했다.
방관자 T세포에 의한 질병 발생 이론 발표
우리 대학 의과학대학원 신의철 교수, 이호영 박사, 정성주 대학원생이 감염질환에서 방관자 (bystander) T세포 활성화의 중요성을 강조하는 주제로 세계적인 면역학 권위지인 `네이처 이뮤놀로지(Nature Immunology)' 8월호에 초청 리뷰 논문을 게재했다고 31일 밝혔다.
인간 질병에서 방관자 T세포의 역할에 관한 연구를 세계적으로 선도하고 있는 신의철 교수 연구팀은 이번 리뷰 논문을 통해 다양한 감염질환에서 방관자 T세포의 역할과 이를 조절하는 기전들을 총체적으로 고찰하고 인간 질병 치료에 응용할 수 있는 미래 연구의 방향을 제시했다.
일반적으로 인체는 바이러스에 감염되면 항바이러스 작용을 하는 T세포가 활성화되어 질병으로부터의 회복을 촉진한다고 알려져 있다. 이때 특정 바이러스에 대응하는 T세포만 활성화되고 관련 없는 T세포들은 활성화되지 않는데, 이러한 현상을 선택적 면역반응이라고 한다. 선택적 면역반응은 T세포가 바이러스의 항원 펩타이드를 인식하면서 이뤄진다.
하지만 바이러스의 종류 및 환자의 면역 체계에 따라, 감염을 일으키는 바이러스와는 상관없는 T세포의 활성화가 일어나게 되는데 이를 방관자 T세포의 활성화라고 이야기한다. 방관자 T세포의 활성화는 바이러스 항원 펩타이드의 존재와는 상관없이 사이토카인(cytokine)에 의해 유발된다고 알려져 있다. 이러한 방관자 T세포의 활성화는 복잡한 감염 이력을 가진 사람의 면역반응을 더 정교하게 이해하기 위해 반드시 고려해야 하는 현상이다.
과거 신의철 교수 연구팀은 2010년대에 한국에서 유행했던 A형 간염 바이러스 감염환자에서 간세포가 심하게 파괴되는 원인으로 방관자 T세포의 활성화 현상을 새롭게 발견해 그 결과를 2018년 권위 있는 면역학 학술지 `이뮤니티(Immunity)'에 보고한 바 있다. 이는 인간 질병에서 방관자 T세포의 역할을 체계적으로 증명한 세계 첫 논문으로 인정받고 있다.
이후 연구팀은 관련 연구를 활발히 지속하며 더 상세한 기전들을 발견해왔다. 간 조직에 상주하며 방관자 활성화를 일으킬 수 있는 T세포를 조절하는 분자를 발견하여 2020년 국제적 학술지 `저널 오브 헤파톨로지 (Journal of Hepatology)'에 보고했고, 특수한 T세포인 점막연관 불변사슬 T세포(MAIT: Mucosal-associated invariant T)도 유사한 활성 과정을 거쳐 간 손상에 기여할 수 있음을 발견해 같은 해 동일 저널에 발표했다.
또한, 최근에는 활성화된 방관자 T세포들이 감염된 조직으로 이동하는데 필요한 세포이동 관련 기전을 발견하여 국제학술지 `셀 리포트 (Cell Reports)'에 보고한 바도 있다.
현재 연구팀은 방관자 T세포 활성화 특성 및 관련 기전을 바이러스 질환 그리고 종양질환에서 밝혀내는 후속 연구를 진행 중이다. 또한, 현재 전 세계적으로 유행 중인 코로나19 감염상황에서 방관자 T세포 활성화 및 역할에 관한 연구도 진행하고 있다.
신의철 교수 연구팀은 방관자 T세포 활성화 연구 분야를 개척하고 확장해 나가고 있는 공로를 인정받아 이번 초청 리뷰 논문을 게재하게 됐다.
이러한 그동안의 연구는 2014년부터 삼성미래기술육성재단의 지속적인 지원을 받아 수행될 수 있었다. 연구팀의 이번 리뷰 논문은 국제 면역학 저명 학술지인 네이처 이뮤놀로지 (Nature Immunology) 誌 8월 5일 字에 게재됐다(논문명: Significance of bystander T cell activation in microbial infection).
이번 연구의 제1 저자인 우리 대학 이호영 박사(박사후 연구원)는 "그동안 면역학계에서 그 중요성을 몰랐던 방관자 T세포 활성화 현상이 이번 리뷰 논문을 통해 크게 주목받기를 기대한다며, 앞으로 다양한 질병에서의 방관자 T세포의 역할 및 관련 기전들의 규명을 위해 노력하겠다ˮ고 말했다.
신의철 교수는 "한국에서 개척한 연구 분야가 국제 면역학계에서 인정을 받는 것이 기쁘다며, 방관자 T세포의 연구가 논문에서만 그치지 않고 신약개발의 단초가 되도록 노력하겠다ˮ 라고 말했다.
2021.09.01
조회수 11915
-
 사람 3D 폐포 배양 기술로 코로나19 감염 기전을 규명하는 데 성공
우리 대학 연구진 포함 국내 연구진이 실험실에서 3차원으로 키운 사람의 폐포(허파꽈리)에 코로나19 바이러스를 배양해 감염 기전과 치료제 개발에 적용이 가능한 기술 개발에 성공했다.
국제 통계 사이트 월드오미터에 따르면 전 세계 누적 코로나바이러스감염증-19(이하 코로나19) 확진자 수는 25일 기준 4,331만 8,941명으로 지난 18일(4,030만 1,609명) 4,000만 명을 넘어선 후 일주일 만에 4,331만을 돌파하는 2차 대유행이 점차 현실화돼 가고 있다.
우리 대학 의과학대학원 주영석 교수 연구팀은 인간의 폐포 세포를 실험실에서 구현하는 3D 미니 장기기술을 개발하고 이를 활용해 코로나19 바이러스가 인간의 폐 세포를 파괴하는 과정을 정밀하게 규명하는 데 성공했다고 26일 밝혔다.
이번 연구는 영국 케임브리지대학 이주현 박사를 비롯해 국립보건연구원 국립감염병연구소 최병선 과장·기초과학연구원(IBS) 고규영 혈관연구단장(우리 대학 의과학대학원 교수)·서울대병원 김영태 교수와 우리 대학 교원창업기업인 ㈜지놈인사이트와 공동으로 진행됐다.
공동연구팀의 이번 연구 결과는 줄기세포 분야 세계적인 학술지 `Cell Stem Cell' 10월 22일 字 온라인판에 실렸다. (논문명: Three-dimensional human alveolar stem cell culture models reveal infection response to SARS-CoV-2)
정확한 질병 기전의 이해를 기반으로 치료제를 효과적으로 개발하기 위해서는 실험실에서 사용 가능한 인체를 모사한 모델 사용이 필수적이다. 코로나19 바이러스는 생쥐 모델에 감염시키기가 어렵고, 특히 실험실에서 사용할 수 있는 폐 세포 모델은 존재하지 않기 때문에 직접적인 감염 연구의 한계가 존재해왔다.
공동연구팀은 이런 문제를 해소하기 위해 지속적으로 배양이 가능한 3차원 인간 폐포 모델을 새롭게 정립했다. 이를 이용하면 실험실에서 사람의 폐 세포를 이용해 코로나19 바이러스 등 각종 호흡기 바이러스의 질병 기전을 연구할 수 있기 때문이다. 더 나가서 3차원 인간 폐포 모델은 약물 스크리닝 등 치료법 개발에도 직접적으로 응용할 수 있다는 장점이 있다.
공동연구팀은 폐암 등 사람의 수술 검사재료에서 확보되는 사람 폐 조직을 장기간 안정적으로 3차원 배양할 수 있는 조건을 알아내는 데 성공했다. 실험 결과, 3D 폐포는 코로나19 바이러스에 노출되면 6시간 내 급속한 바이러스 증식이 일어나 세포 감염이 완료됐으나, 이를 막기 위한 폐 세포의 선천 면역 반응 활성화에는 약 3일가량의 시간이 걸렸다.
이와 함께 하나의 코로나19 바이러스 입자는 하나의 세포를 감염시키는 데 충분하다는 사실을 알아냈다. 감염 3일째 공동연구팀은 세포 가운데 일부분이 고유의 기능을 급격히 상실한다는 사실도 확인했다.
공동 교신저자인 주영석 교수는 "이번에 개발한 3차원 인체 폐 배양 모델 규모를 확대한다면 코로나19 바이러스를 포함한 다양한 호흡기 바이러스의 감염 연구에 유용하게 사용될 것ˮ이라고 말했다.
주 교수는 이어 "동물이나 다른 장기 유래의 세포가 아닌 호흡기 바이러스의 표적 세포인 사람의 폐 세포를 직접적으로 질병 연구에 응용함으로써 효율적이고 정확한 기전 규명은 물론 치료제 개발에도 이용할 수 있다ˮ고 강조했다.
코로나19 바이러스 대응 기술개발을 위해서는 다양한 기관의 지원과 관련 연구자들의 협력 연구가 필수적이다. 공동연구팀의 이번 연구는 한국연구재단·질병관리청·기초과학연구원(IBS)·서울대학교 의과대학·유럽연구이사회(ERC)·서경배과학재단·휴먼프론티어과학재단의 지원을 받아 수행됐다.
사람 3D 폐포 배양 기술로 코로나19 감염 기전을 규명하는 데 성공
우리 대학 연구진 포함 국내 연구진이 실험실에서 3차원으로 키운 사람의 폐포(허파꽈리)에 코로나19 바이러스를 배양해 감염 기전과 치료제 개발에 적용이 가능한 기술 개발에 성공했다.
국제 통계 사이트 월드오미터에 따르면 전 세계 누적 코로나바이러스감염증-19(이하 코로나19) 확진자 수는 25일 기준 4,331만 8,941명으로 지난 18일(4,030만 1,609명) 4,000만 명을 넘어선 후 일주일 만에 4,331만을 돌파하는 2차 대유행이 점차 현실화돼 가고 있다.
우리 대학 의과학대학원 주영석 교수 연구팀은 인간의 폐포 세포를 실험실에서 구현하는 3D 미니 장기기술을 개발하고 이를 활용해 코로나19 바이러스가 인간의 폐 세포를 파괴하는 과정을 정밀하게 규명하는 데 성공했다고 26일 밝혔다.
이번 연구는 영국 케임브리지대학 이주현 박사를 비롯해 국립보건연구원 국립감염병연구소 최병선 과장·기초과학연구원(IBS) 고규영 혈관연구단장(우리 대학 의과학대학원 교수)·서울대병원 김영태 교수와 우리 대학 교원창업기업인 ㈜지놈인사이트와 공동으로 진행됐다.
공동연구팀의 이번 연구 결과는 줄기세포 분야 세계적인 학술지 `Cell Stem Cell' 10월 22일 字 온라인판에 실렸다. (논문명: Three-dimensional human alveolar stem cell culture models reveal infection response to SARS-CoV-2)
정확한 질병 기전의 이해를 기반으로 치료제를 효과적으로 개발하기 위해서는 실험실에서 사용 가능한 인체를 모사한 모델 사용이 필수적이다. 코로나19 바이러스는 생쥐 모델에 감염시키기가 어렵고, 특히 실험실에서 사용할 수 있는 폐 세포 모델은 존재하지 않기 때문에 직접적인 감염 연구의 한계가 존재해왔다.
공동연구팀은 이런 문제를 해소하기 위해 지속적으로 배양이 가능한 3차원 인간 폐포 모델을 새롭게 정립했다. 이를 이용하면 실험실에서 사람의 폐 세포를 이용해 코로나19 바이러스 등 각종 호흡기 바이러스의 질병 기전을 연구할 수 있기 때문이다. 더 나가서 3차원 인간 폐포 모델은 약물 스크리닝 등 치료법 개발에도 직접적으로 응용할 수 있다는 장점이 있다.
공동연구팀은 폐암 등 사람의 수술 검사재료에서 확보되는 사람 폐 조직을 장기간 안정적으로 3차원 배양할 수 있는 조건을 알아내는 데 성공했다. 실험 결과, 3D 폐포는 코로나19 바이러스에 노출되면 6시간 내 급속한 바이러스 증식이 일어나 세포 감염이 완료됐으나, 이를 막기 위한 폐 세포의 선천 면역 반응 활성화에는 약 3일가량의 시간이 걸렸다.
이와 함께 하나의 코로나19 바이러스 입자는 하나의 세포를 감염시키는 데 충분하다는 사실을 알아냈다. 감염 3일째 공동연구팀은 세포 가운데 일부분이 고유의 기능을 급격히 상실한다는 사실도 확인했다.
공동 교신저자인 주영석 교수는 "이번에 개발한 3차원 인체 폐 배양 모델 규모를 확대한다면 코로나19 바이러스를 포함한 다양한 호흡기 바이러스의 감염 연구에 유용하게 사용될 것ˮ이라고 말했다.
주 교수는 이어 "동물이나 다른 장기 유래의 세포가 아닌 호흡기 바이러스의 표적 세포인 사람의 폐 세포를 직접적으로 질병 연구에 응용함으로써 효율적이고 정확한 기전 규명은 물론 치료제 개발에도 이용할 수 있다ˮ고 강조했다.
코로나19 바이러스 대응 기술개발을 위해서는 다양한 기관의 지원과 관련 연구자들의 협력 연구가 필수적이다. 공동연구팀의 이번 연구는 한국연구재단·질병관리청·기초과학연구원(IBS)·서울대학교 의과대학·유럽연구이사회(ERC)·서경배과학재단·휴먼프론티어과학재단의 지원을 받아 수행됐다.
2020.10.26
조회수 33450
-
 초음파를 내비게이션으로 사용하는 광학현미경 개발
생체 내부를 꿰뚫어볼 수 있는 새로운 현미경이 나왔다. 바이오 및 뇌공학과 장무석 교수 연구팀이 기초과학연구원 분자 분광학 및 동력학 연구단 최원식 부연구단장 연구팀과의 공동 연구를 통해 초음파를 이용해 기존 현미경으로 볼 수 없었던 생체 내부의 미세구조를 관찰하는 기법을 개발했다.
연구결과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)2월 5일자 온라인 판에 게재됐다.
사람의 눈은 250㎜ 떨어진 거리에 70㎜의 간격을 두고 놓인 물체를 구분할 수 있다. 이보다 작은 미세구조를 관찰하기 위해서는 광학현미경이 필요하다. 광학현미경은 눈으로 볼 수 없는 작은 미세구조를 확대해서 보여준다. 하지만 생체조직을 관찰할 때는 이야기가 달라진다.
빛이 생체 조직을 투과할 때 직진광과 산란광이라는 두 종류의 빛이 생겨난다. 직진광은 말 그대로 생체 조직의 영향 없이 직진하는 빛이며, 산란광은 생체 조직 내 세포나 세포 내 구조의 영향에 의해 진행 방향이 무작위로 굴절된 빛이다. 광학 현미경으로 생체 조직 깊은 곳을 관찰하려면 직진광에 비해 산란광이 강해져 이미지 정보가 흐려진다는 치명적인 단점이 있다. 안개 속을 볼 수 없듯, 생체 조직의 수많은 세포와 구조들이 빛을 산란시켜 이미지를 흐리게 만들기 때문이다. 반면, 초음파 영상은 태아를 감별할 수 있을 정도로 생체 내부 깊은 곳까지 이미징할 수 있지만, 해상도가 낮아 미세한 구조를 볼 수 없다는 단점이 있다.
연구진은 광학 현미경과 초음파 영상의 장점을 결합하여, 생체 내부 깊은 곳을 높은 해상도로 관찰할 수 있는 초음파 결합 광학 현미경을 개발했다. 초음파 결합 현미경은 생체 조직 내부를 잘 침투하는 초음파를 집속시킨 후, 초음파의 초점을 지나는 빛만 측정하는 방식으로 산란광의 세기를 크게 감쇄시킬 수 있다. 초음파가 광학현미경에게 관찰 경로를 알려주는 일종의 내비게이션 역할을 하는 셈이다.
초음파는 생체 조직을 응축, 팽창시켜 굴절률을 변조하는 방식으로 빛의 진행에 영향을 준다. 연구진은 이런 초음파의 특성을 응용해 초음파의 초점을 통과하는 빛만을 선택적으로 측정하는 기술을 개발하고, 이 기술을 공간 게이팅(space-gating)이라 명명했다. 초음파는 생체 내부의 ‘빛 거름망’ 역할을 하며 무작위로 산란되던 빛을 차폐한다. 공간 게이팅 기술을 통해 연구진은 산란광을 100배 이상 감쇄시키며 생체 조직 내에서 광학 이미지가 흐려지는 문제를 극복할 수 있었다.
장무석 교수는 “촘촘한 거름망을 사용하면 더 고운 가루만 남는 것처럼 초음파의 초점을 작게 할수록 산란광을 더 많이 감쇄시킬 수 있다”며 “향후 산란광을 1000~1만 배 수준까지 감쇄시켜 더 선명한 이미지를 얻게 될 것으로 기대한다”고 말했다.
연구진은 개발한 현미경을 이용해 별도의 형광 표지 없이 부화한지 30일 된 성체 제브라피시의 척추 안쪽 근육 조직 이미지를 얻는데 성공했다. 기존 기술은 제브라피시의 장기, 척추 등 내부 구조에서 산란 현상이 일어나 절단을 통해서만 내부 근육 결을 관찰할 수 있었다. 이와 달리 개발된 현미경은 자연 상태 그대로 살아있는 제브라피쉬 내부 조직을 꿰뚫어볼 수 있다.
연구진은 인체 조직에도 사용할 수 있는 공간 게이팅 기술을 구현해나갈 계획이다. 향후 현미경을 소형화하고 이미징 속도를 증가시키면, 실시간 질병 진단에도 응용할 수 있을 것으로 기대된다. 이번 연구를 이끈 최원식 부연구단장은 “초음파 결합 광학 현미경은 기존 광학 현미경의 얕은 이미징 깊이 문제를 해결하는 획기적인 기술”이라며 “공간 게이팅 기술을 더욱 발전시켜 빛의 산란 현상을 이해하고, 의생명 광학 기술 분야 활용 범위를 넓혀나갈 것”이라고 말했다.
초음파를 내비게이션으로 사용하는 광학현미경 개발
생체 내부를 꿰뚫어볼 수 있는 새로운 현미경이 나왔다. 바이오 및 뇌공학과 장무석 교수 연구팀이 기초과학연구원 분자 분광학 및 동력학 연구단 최원식 부연구단장 연구팀과의 공동 연구를 통해 초음파를 이용해 기존 현미경으로 볼 수 없었던 생체 내부의 미세구조를 관찰하는 기법을 개발했다.
연구결과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)2월 5일자 온라인 판에 게재됐다.
사람의 눈은 250㎜ 떨어진 거리에 70㎜의 간격을 두고 놓인 물체를 구분할 수 있다. 이보다 작은 미세구조를 관찰하기 위해서는 광학현미경이 필요하다. 광학현미경은 눈으로 볼 수 없는 작은 미세구조를 확대해서 보여준다. 하지만 생체조직을 관찰할 때는 이야기가 달라진다.
빛이 생체 조직을 투과할 때 직진광과 산란광이라는 두 종류의 빛이 생겨난다. 직진광은 말 그대로 생체 조직의 영향 없이 직진하는 빛이며, 산란광은 생체 조직 내 세포나 세포 내 구조의 영향에 의해 진행 방향이 무작위로 굴절된 빛이다. 광학 현미경으로 생체 조직 깊은 곳을 관찰하려면 직진광에 비해 산란광이 강해져 이미지 정보가 흐려진다는 치명적인 단점이 있다. 안개 속을 볼 수 없듯, 생체 조직의 수많은 세포와 구조들이 빛을 산란시켜 이미지를 흐리게 만들기 때문이다. 반면, 초음파 영상은 태아를 감별할 수 있을 정도로 생체 내부 깊은 곳까지 이미징할 수 있지만, 해상도가 낮아 미세한 구조를 볼 수 없다는 단점이 있다.
연구진은 광학 현미경과 초음파 영상의 장점을 결합하여, 생체 내부 깊은 곳을 높은 해상도로 관찰할 수 있는 초음파 결합 광학 현미경을 개발했다. 초음파 결합 현미경은 생체 조직 내부를 잘 침투하는 초음파를 집속시킨 후, 초음파의 초점을 지나는 빛만 측정하는 방식으로 산란광의 세기를 크게 감쇄시킬 수 있다. 초음파가 광학현미경에게 관찰 경로를 알려주는 일종의 내비게이션 역할을 하는 셈이다.
초음파는 생체 조직을 응축, 팽창시켜 굴절률을 변조하는 방식으로 빛의 진행에 영향을 준다. 연구진은 이런 초음파의 특성을 응용해 초음파의 초점을 통과하는 빛만을 선택적으로 측정하는 기술을 개발하고, 이 기술을 공간 게이팅(space-gating)이라 명명했다. 초음파는 생체 내부의 ‘빛 거름망’ 역할을 하며 무작위로 산란되던 빛을 차폐한다. 공간 게이팅 기술을 통해 연구진은 산란광을 100배 이상 감쇄시키며 생체 조직 내에서 광학 이미지가 흐려지는 문제를 극복할 수 있었다.
장무석 교수는 “촘촘한 거름망을 사용하면 더 고운 가루만 남는 것처럼 초음파의 초점을 작게 할수록 산란광을 더 많이 감쇄시킬 수 있다”며 “향후 산란광을 1000~1만 배 수준까지 감쇄시켜 더 선명한 이미지를 얻게 될 것으로 기대한다”고 말했다.
연구진은 개발한 현미경을 이용해 별도의 형광 표지 없이 부화한지 30일 된 성체 제브라피시의 척추 안쪽 근육 조직 이미지를 얻는데 성공했다. 기존 기술은 제브라피시의 장기, 척추 등 내부 구조에서 산란 현상이 일어나 절단을 통해서만 내부 근육 결을 관찰할 수 있었다. 이와 달리 개발된 현미경은 자연 상태 그대로 살아있는 제브라피쉬 내부 조직을 꿰뚫어볼 수 있다.
연구진은 인체 조직에도 사용할 수 있는 공간 게이팅 기술을 구현해나갈 계획이다. 향후 현미경을 소형화하고 이미징 속도를 증가시키면, 실시간 질병 진단에도 응용할 수 있을 것으로 기대된다. 이번 연구를 이끈 최원식 부연구단장은 “초음파 결합 광학 현미경은 기존 광학 현미경의 얕은 이미징 깊이 문제를 해결하는 획기적인 기술”이라며 “공간 게이팅 기술을 더욱 발전시켜 빛의 산란 현상을 이해하고, 의생명 광학 기술 분야 활용 범위를 넓혀나갈 것”이라고 말했다.
2020.02.21
조회수 15695
-
 김일두 교수, 동물 단백질 촉매로 활용한 질병진단센서 개발
〈 김 일 두 교수 〉
우리 대학 신소재공학과 김일두 교수 연구팀이 동물의 단백질을 촉매로 활용해 호흡으로 질병을 진단할 수 있는 센서를 개발했다.
이는 사람의 날숨에 포함된 다양한 질병과 관련된 바이오마커 가스들에 대한 패턴 인식을 통해 질병을 조기 모니터링 할 수 있는 기술이다.
이번 기술은 다양한 단일 금속입자 뿐만 아니라 어떠한 조합의 이종입자도 2 nm 크기로 합성할 수 있는 장점을 갖는다. 연구팀은 기존에도 호흡으로 질병을 진단하는 센서를 개발했으나 이번 기술은 더욱 정확하고 높은 감도를 갖는다는 특징이 있다.
김상준, 최선진 박사가 1저자로 참여한 이번 연구 결과는 미국 화학회의 화학분야 국제 학술지 ‘어카운트 오브 케미칼 리서치(Accounts of Chemical Research)’ 7월호 표지논문으로 선정됐고, 독일 와일리 국제 학술지인 ‘어드밴스드 머터리얼즈(Advanced Materials)’에도 게재가 확정됐다.
혈액 체취나 영상 촬영 없이 내뱉는 숨(호기)만으로 각종 질병 여부를 파악하는 호흡 지문 센서 기술은 핵심 미래 기술이다. 호기 속 특정 가스들의 농도변화를 체크해 건강 이상 여부를 판단할 수 있다.
호기가스 성분에는 수분 외에도 수소, 아세톤, 톨루엔, 암모니아, 황화수소, 일산화질소 등이 포함된다. 이 가스들은 천식, 폐암, 1형 당뇨병, 구취 등 특정 질병 환자에게서 높은 농도로 배출되는 바이오마커 가스이다.
호흡을 이용한 질병 진단은 마치 음주측정기처럼 테들라(Tedlar) 백에 포집된 날숨 가스를 소형 센서 장치로 주입한 후 빠른 속도로 분석되기 때문에 쉽고 간편하게 질병을 진단할 수 있다. 또한 질병 대사가 일어나는 시점에서 검출이 가능해 조기 진단이 가능하다.
하지만 매우 경미한 수준인 10억분의 1(ppb)에서 100만분의 1(ppm) 수준으로 발생하는 가스를 호흡 속에서 정확히 분석하기 위해서는 기술의 진보가 필요하다. 특히 수분을 포함한 수백 종의 방해 가스는 특정 질병 관련 바이오마커 가스를 선택적으로 분석하는 저항 변화식 센서의 취약점으로 남아 있다.
기존의 가스 센서는 백금, 팔라듐 등 특정 촉매를 결합해 감지 특성을 높이려고 시도했으나 ppb 농도에서는 생체지표 가스 감지 특성이 높지 않다는 한계가 있었다.
연구팀은 기존 센서의 한계 극복을 위해 동물의 조직에 존재하는 나노크기의 단백질을 희생층으로 이용해 속이 비어있는 단백질 껍질 안에 석출된 이종촉매(Heterogeneous catalyst) 입자를 합성하는데 성공했다.
이번 연구에 사용된 나노크기의 단백질은 주기율표에 존재하는 원소물질을 조합해 어떠한 형태의 이종촉매도 다양하게 구현할 수 있다는 큰 장점을 갖는다.
특히 이종 원소간 조성비를 쉽게 조절할 수 있고 금속간화합물도 제조할 수 있어 신조성을 갖는 촉매 합성 측면에서 매우 획기적인 방법이다.
예를 들어 백금이 기준 촉매일 때 백금팔라듐(PtPd), 백금니켈(PtNi), 백금루테늄(PdRu), 백금이트륨(PtY3) 등 다양한 이종 합금촉매로 확장할 수 있다.
연구팀은 개발된 이종촉매 입자를 넓은 비표면적과 다공성 구조를 갖는 금속산화물 나노섬유에 결착시켜 특정 생체지표 기체에만 선택적으로 반응하는 감지소재를 개발했다. 이종촉매가 결착된 나노섬유 센서는 기존에 촉매 활성이 가장 뛰어나다고 알려진 백금이나 팔라듐 촉매보다 약 3~4배 이상 감지 특성이 향상됨을 확인했다.
특히 아세톤이나 황화수소 가스는 1ppm에서 감도가 100배 수준으로 바뀌는 최고 수준의 감도 특성이 관찰됐다.
연구팀은 다양한 종류의 감지 소재가 적용된 복합 센서 배치(sensor array) 시스템을 이용해 사람의 지문을 인식하듯 개개인의 호흡을 패턴 인식해 일반인도 쉽게 건강 이상을 판별할 수 있는 질병진단 플랫폼을 개발했다.
16종의 다른 선택성을 갖는 센서를 어레이화하는데 성공했으며, 환자의 건강상태에 따라 날숨 농도변화가 다르게 나타나기 때문에 날숨 속 가스 정보를 지문처럼 패턴화하여 개인의 건강 변화를 지속적으로 모니터링 하는 헬스케어 기기에 적용할 수 있다.
김 교수는 “기존에 센서에 사용된 적이 없는 2 nm 크기의 이종촉매를 단백질을 이용하여 적용함으로써, 질병과 연관된 생체지표 가스에 고감도 및 고 선택성으로 반응하는 센서소재 라이브러리를 구현할 수 있다”며 “앞으로 다양한 촉매 군을 확보하면 수많은 질병을 진단할 수 있는 센서를 개발할 수 있다”고 말했다.
또한 “호흡으로 질병을 진단하는 센서는 누구나 손쉽게 스스로 진단할 수 있는 자가 진단 기기의 시작으로 의료비 지출 상승을 막고 지속적 건강관리에 큰 도움이 될 것이다”고 말했다.
이번 기술과 관련된 특허들은 지난 3월과 6월 각각 벤처기업과 중소기업에 기술이전 됐다.
본 연구는 미래창조 과학부 웨어러블 플랫폼소재 기술센터 과제와 바이오의료기술개발사업 과제의 지원으로 이루어졌다.
□ 그림 설명
그림1. 어카운트 오브 케미칼 리서치 표지 이미지
그림2. 다종 입자 촉매
그림3. 함금촉매 합성
그림4. 다종센서 어레이_날숨 분석 센서
김일두 교수, 동물 단백질 촉매로 활용한 질병진단센서 개발
〈 김 일 두 교수 〉
우리 대학 신소재공학과 김일두 교수 연구팀이 동물의 단백질을 촉매로 활용해 호흡으로 질병을 진단할 수 있는 센서를 개발했다.
이는 사람의 날숨에 포함된 다양한 질병과 관련된 바이오마커 가스들에 대한 패턴 인식을 통해 질병을 조기 모니터링 할 수 있는 기술이다.
이번 기술은 다양한 단일 금속입자 뿐만 아니라 어떠한 조합의 이종입자도 2 nm 크기로 합성할 수 있는 장점을 갖는다. 연구팀은 기존에도 호흡으로 질병을 진단하는 센서를 개발했으나 이번 기술은 더욱 정확하고 높은 감도를 갖는다는 특징이 있다.
김상준, 최선진 박사가 1저자로 참여한 이번 연구 결과는 미국 화학회의 화학분야 국제 학술지 ‘어카운트 오브 케미칼 리서치(Accounts of Chemical Research)’ 7월호 표지논문으로 선정됐고, 독일 와일리 국제 학술지인 ‘어드밴스드 머터리얼즈(Advanced Materials)’에도 게재가 확정됐다.
혈액 체취나 영상 촬영 없이 내뱉는 숨(호기)만으로 각종 질병 여부를 파악하는 호흡 지문 센서 기술은 핵심 미래 기술이다. 호기 속 특정 가스들의 농도변화를 체크해 건강 이상 여부를 판단할 수 있다.
호기가스 성분에는 수분 외에도 수소, 아세톤, 톨루엔, 암모니아, 황화수소, 일산화질소 등이 포함된다. 이 가스들은 천식, 폐암, 1형 당뇨병, 구취 등 특정 질병 환자에게서 높은 농도로 배출되는 바이오마커 가스이다.
호흡을 이용한 질병 진단은 마치 음주측정기처럼 테들라(Tedlar) 백에 포집된 날숨 가스를 소형 센서 장치로 주입한 후 빠른 속도로 분석되기 때문에 쉽고 간편하게 질병을 진단할 수 있다. 또한 질병 대사가 일어나는 시점에서 검출이 가능해 조기 진단이 가능하다.
하지만 매우 경미한 수준인 10억분의 1(ppb)에서 100만분의 1(ppm) 수준으로 발생하는 가스를 호흡 속에서 정확히 분석하기 위해서는 기술의 진보가 필요하다. 특히 수분을 포함한 수백 종의 방해 가스는 특정 질병 관련 바이오마커 가스를 선택적으로 분석하는 저항 변화식 센서의 취약점으로 남아 있다.
기존의 가스 센서는 백금, 팔라듐 등 특정 촉매를 결합해 감지 특성을 높이려고 시도했으나 ppb 농도에서는 생체지표 가스 감지 특성이 높지 않다는 한계가 있었다.
연구팀은 기존 센서의 한계 극복을 위해 동물의 조직에 존재하는 나노크기의 단백질을 희생층으로 이용해 속이 비어있는 단백질 껍질 안에 석출된 이종촉매(Heterogeneous catalyst) 입자를 합성하는데 성공했다.
이번 연구에 사용된 나노크기의 단백질은 주기율표에 존재하는 원소물질을 조합해 어떠한 형태의 이종촉매도 다양하게 구현할 수 있다는 큰 장점을 갖는다.
특히 이종 원소간 조성비를 쉽게 조절할 수 있고 금속간화합물도 제조할 수 있어 신조성을 갖는 촉매 합성 측면에서 매우 획기적인 방법이다.
예를 들어 백금이 기준 촉매일 때 백금팔라듐(PtPd), 백금니켈(PtNi), 백금루테늄(PdRu), 백금이트륨(PtY3) 등 다양한 이종 합금촉매로 확장할 수 있다.
연구팀은 개발된 이종촉매 입자를 넓은 비표면적과 다공성 구조를 갖는 금속산화물 나노섬유에 결착시켜 특정 생체지표 기체에만 선택적으로 반응하는 감지소재를 개발했다. 이종촉매가 결착된 나노섬유 센서는 기존에 촉매 활성이 가장 뛰어나다고 알려진 백금이나 팔라듐 촉매보다 약 3~4배 이상 감지 특성이 향상됨을 확인했다.
특히 아세톤이나 황화수소 가스는 1ppm에서 감도가 100배 수준으로 바뀌는 최고 수준의 감도 특성이 관찰됐다.
연구팀은 다양한 종류의 감지 소재가 적용된 복합 센서 배치(sensor array) 시스템을 이용해 사람의 지문을 인식하듯 개개인의 호흡을 패턴 인식해 일반인도 쉽게 건강 이상을 판별할 수 있는 질병진단 플랫폼을 개발했다.
16종의 다른 선택성을 갖는 센서를 어레이화하는데 성공했으며, 환자의 건강상태에 따라 날숨 농도변화가 다르게 나타나기 때문에 날숨 속 가스 정보를 지문처럼 패턴화하여 개인의 건강 변화를 지속적으로 모니터링 하는 헬스케어 기기에 적용할 수 있다.
김 교수는 “기존에 센서에 사용된 적이 없는 2 nm 크기의 이종촉매를 단백질을 이용하여 적용함으로써, 질병과 연관된 생체지표 가스에 고감도 및 고 선택성으로 반응하는 센서소재 라이브러리를 구현할 수 있다”며 “앞으로 다양한 촉매 군을 확보하면 수많은 질병을 진단할 수 있는 센서를 개발할 수 있다”고 말했다.
또한 “호흡으로 질병을 진단하는 센서는 누구나 손쉽게 스스로 진단할 수 있는 자가 진단 기기의 시작으로 의료비 지출 상승을 막고 지속적 건강관리에 큰 도움이 될 것이다”고 말했다.
이번 기술과 관련된 특허들은 지난 3월과 6월 각각 벤처기업과 중소기업에 기술이전 됐다.
본 연구는 미래창조 과학부 웨어러블 플랫폼소재 기술센터 과제와 바이오의료기술개발사업 과제의 지원으로 이루어졌다.
□ 그림 설명
그림1. 어카운트 오브 케미칼 리서치 표지 이미지
그림2. 다종 입자 촉매
그림3. 함금촉매 합성
그림4. 다종센서 어레이_날숨 분석 센서
2017.07.18
조회수 35336
-
 김일두 교수, 호흡으로 폐암, 당뇨 조기 진단하는 초소형 센서 개발
혈액 체취나 영상촬영을 하지 않고도 사람의 호흡만으로 폐암, 당뇨 등 각종 질병을 실시간으로 파악할 수 있는 초소형 감지 센서 기술이 개발됐다.
우리 대학 신소재공학과 김일두 교수신소재공학과 연구팀은 사람의 호흡 내에 질병과 관련된 극미량의 특정 가스의 농도를 실시간으로 정확하게 분석할 수 있는 세계 최고 수준의 고감도·초소형 센서를 개발하였다고 밝혔다.
이를 통해, 현재 병원에서 혈액 체취나 조직 검사, MRI 등을 통해 고비용으로 진단하고 있는 폐암이나 당뇨 등의 질병을 개인 스마트폰이나 웨어러블 장치를 통해 수시로 저렴하게 진단할 수 있는 길을 열었다.
사람이 숨을 쉬면서 내뱉는 호흡 속 가스 성분 중에는 다양한 휘발성 유기화합물 가스들이 포함되어 있으며, 이중 일부 가스는 질병과 밀접한 연관이 있는 것으로 알려져 있다.
대표적으로 아세톤, 톨루엔, 황화수소 가스는 각각 당뇨병, 폐암, 구취 환자에서 더 높은 농도로 배출되며, 이러한 호흡 속 특정 가스의 농도를 정확하게 분석할 수 있다면 여러 질병들을 간편한 방법으로 조기에 진단할 수 있다.
그러나, 입안에는 수분을 포함하여 수백 종의 가스들이 존재하기 때문에, 그간 개발된 센서는 사람 호흡 속에 포함되어 있는 극미량(10 – 2,000ppb)의 특정 가스를 선택적으로 검출하는데 한계가 있었다.
연구팀은 수백 종의 가스 중 질병과 관련된 특정 가스만 선택적으로 탁월하게 검출할 수 있는 고성능 촉매를 개발하였으며, 이를 나노 섬유 형상의 센서 소재에 적용하여 개인 스마트폰과 연동이 가능한 초소형·고감도 질병 진단 센서를 구현하는데 성공하였다.
김일두 교수는 “질병 진단 센서는 차량이나 모바일 기기 등에 활용하여 개인 질병을 지속적으로 모니터링 할 수 있을 뿐만 아니라, 향후 대기 오염 분석, 실내 공기질 분석 등 가스 센서와 관련된 산업분야에서 사물인터넷(IoT) 제품과 융합되어 새로운 시장을 창출할 것으로 기대된다.”라고 연구의의를 밝혔다.
이번 연구는 김일두 교수 외 최선진·김상준 연구원이 주도하였고, 미래창조과학부 글로벌프런티어사업(스마트 IT 융합시스템 연구단)의 지원으로 수행되었다.
연구 결과는 재료과학분야 세계적 국제학술지인 ‘스몰(small)’ 표지논문에 2월 17일(수) 게제 되었으며, 관련 특허는 국내기업에 기술이전 되어 향후 조기 상용화가 이뤄질 것으로 기대된다.
□ 그림 설명
그림1. 스마트폰과 연결된 호기가스 분석 센서 및 호흡지문 패턴 인식을 통한 질병 진단
그림2. 동글 타입(Dongle-type), 패치 타입(Patch-type), 및 시계 타입(Watch-type) 센서 모듈을 이용한 휴대형, 실시간 호기가스 분석 센서
그림3. 'small' 표지에 게재된 논문
김일두 교수, 호흡으로 폐암, 당뇨 조기 진단하는 초소형 센서 개발
혈액 체취나 영상촬영을 하지 않고도 사람의 호흡만으로 폐암, 당뇨 등 각종 질병을 실시간으로 파악할 수 있는 초소형 감지 센서 기술이 개발됐다.
우리 대학 신소재공학과 김일두 교수신소재공학과 연구팀은 사람의 호흡 내에 질병과 관련된 극미량의 특정 가스의 농도를 실시간으로 정확하게 분석할 수 있는 세계 최고 수준의 고감도·초소형 센서를 개발하였다고 밝혔다.
이를 통해, 현재 병원에서 혈액 체취나 조직 검사, MRI 등을 통해 고비용으로 진단하고 있는 폐암이나 당뇨 등의 질병을 개인 스마트폰이나 웨어러블 장치를 통해 수시로 저렴하게 진단할 수 있는 길을 열었다.
사람이 숨을 쉬면서 내뱉는 호흡 속 가스 성분 중에는 다양한 휘발성 유기화합물 가스들이 포함되어 있으며, 이중 일부 가스는 질병과 밀접한 연관이 있는 것으로 알려져 있다.
대표적으로 아세톤, 톨루엔, 황화수소 가스는 각각 당뇨병, 폐암, 구취 환자에서 더 높은 농도로 배출되며, 이러한 호흡 속 특정 가스의 농도를 정확하게 분석할 수 있다면 여러 질병들을 간편한 방법으로 조기에 진단할 수 있다.
그러나, 입안에는 수분을 포함하여 수백 종의 가스들이 존재하기 때문에, 그간 개발된 센서는 사람 호흡 속에 포함되어 있는 극미량(10 – 2,000ppb)의 특정 가스를 선택적으로 검출하는데 한계가 있었다.
연구팀은 수백 종의 가스 중 질병과 관련된 특정 가스만 선택적으로 탁월하게 검출할 수 있는 고성능 촉매를 개발하였으며, 이를 나노 섬유 형상의 센서 소재에 적용하여 개인 스마트폰과 연동이 가능한 초소형·고감도 질병 진단 센서를 구현하는데 성공하였다.
김일두 교수는 “질병 진단 센서는 차량이나 모바일 기기 등에 활용하여 개인 질병을 지속적으로 모니터링 할 수 있을 뿐만 아니라, 향후 대기 오염 분석, 실내 공기질 분석 등 가스 센서와 관련된 산업분야에서 사물인터넷(IoT) 제품과 융합되어 새로운 시장을 창출할 것으로 기대된다.”라고 연구의의를 밝혔다.
이번 연구는 김일두 교수 외 최선진·김상준 연구원이 주도하였고, 미래창조과학부 글로벌프런티어사업(스마트 IT 융합시스템 연구단)의 지원으로 수행되었다.
연구 결과는 재료과학분야 세계적 국제학술지인 ‘스몰(small)’ 표지논문에 2월 17일(수) 게제 되었으며, 관련 특허는 국내기업에 기술이전 되어 향후 조기 상용화가 이뤄질 것으로 기대된다.
□ 그림 설명
그림1. 스마트폰과 연결된 호기가스 분석 센서 및 호흡지문 패턴 인식을 통한 질병 진단
그림2. 동글 타입(Dongle-type), 패치 타입(Patch-type), 및 시계 타입(Watch-type) 센서 모듈을 이용한 휴대형, 실시간 호기가스 분석 센서
그림3. 'small' 표지에 게재된 논문
2016.03.07
조회수 22278
-
 단백질 분해조절 효소 정보 담은 바이오마커 발굴 시스템 개발
- Mol Cell Proteomics지 게재, “바이오마커 개발의 새로운 패러다임 제시” -
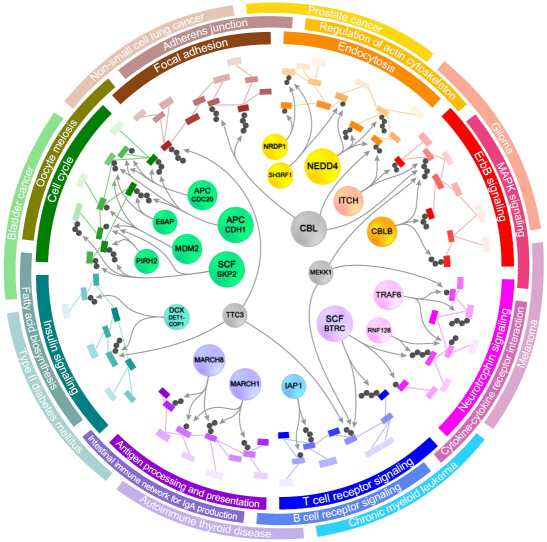
단백질의 분해를 조절하는 효소와 기질에 대한 관계정보를 담은 바이오마커* 발굴 시스템(E3Net)이 국내 연구진에 의해 개발되어, 고부가가치의 새로운 바이오마커 개발에 가능성이 열렸다.
※ 바이오마커(Biomarker) : 유전자, 단백질 등에서 유래된 특이한 패턴의 분자적 정보로, 유전적․후천적 영향으로 발생한 신체의 변화를 감지할 수 있는 생물표지인자
우리학교 바이오및뇍 이관수 교수(49세)가 주도하고, 한영웅 박사과정생, 이호동 박사 및 박종철 교수가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 선도연구센터지원사업(NCRC), 신기술융합형성장동력사업 및 교육과학기술부의 KAIST 미래형 시스템 헬스케어 연구개발사업의 지원으로 수행되었고, 단백질체 연구 분야의 권위 있는 학술지인 ‘Molecular and Cellular Proteomics"지 4월호(4월 1일자)에 게재되었다. (논문명: A system for exploring E3-mediated regulatory networks of cellular functions)이관수 교수 연구팀은 전 세계 바이오 관련 DB(데이터베이스)와 논문(약 2만 편)으로부터 정보를 추출해 단백질 분해를 조절하는 효소(E3 효소)와 기질*들 간의 네트워크를 집대성하여, 이와 관련된 세포의 기능과 질병을 분석하는 ‘E3Net’ 시스템을 개발하였다.
※ 기질(substrate) : 효소와 특이적으로 결합하여 화학반응을 일으키는 분자로, 소화작용은 우리의 몸속에서 일어나는 효소와 기질간의 반응의 대표적인 사례
세포는 시시각각 변하는 환경에 대응하여 필요한 단백질들을 생산, 폐기 및 재활용하는 정교한 시스템을 가지고 있는데, 만일 이 과정에서 오류가 생기면 ‘질병’으로 이어질 수 있다.
따라서 단백질 분해를 조절하는 E3 효소와 기질 간의 관계를 파악하면 관련 질병을 치료하거나 예방할 수 있게 된다. 특히 E3 효소는 단백질 분해의 80%를 담당하는 것으로 알려져 수많은 질병이 관련되어 있을 것으로 예측되고 있다.
그러나 E3 효소와 기질 간의 정보들이 개별 논문과 DB에 흩어져 있어, 단백질 분해 조절과 관련된 세포의 기능과 질병의 특성을 종합적․체계적으로 분석할 수 없었다.
이 교수팀은 모든 E3 효소(2,201개)와 기질(4,896개) 및 그 조절관계(1,671개)에 대한 정보를 통합하여 E3 효소 조절 네트워크 내에 존재하는 관련된 세포의 기능과 질병을 시스템적으로 분석할 수 있는 E3Net을 구축하는데 성공하였다.
이 네트워크는 지금까지 구축된 조절정보를 모두 합친 것보다 무려 10배에 이르는 방대한 양으로, E3 효소가 독자적으로 또는 협력해서 조절하는 세포의 기능과 관련 질병을 정확히 파악할 수 있는 토대가 마련된 첫 사례로서 의미가 크다.
연구팀은 E3Net을 이용하면 각각의 질병과 관련된 단백질들의 분해조절을 담당하는 E3 효소들을 찾을 수 있고, 분해조절 원리와 세포기능 네트워크를 함께 파악하여 질병의 발생 원인이나 환자에 적합한 맞춤형 치료방법을 제공할 수 있는 바이오마커를 발굴할 수 있을 것으로 기대한다.
실제 연구팀은 E3Net을 활용해 암, 뇌심혈관 질환 및 당뇨병 등 현대인의 대표적 질환과 관련된 E3 바이오마커 후보 수십 개를 새롭게 발견하는 등 눈에 띄는 성과를 거두었고, 현재 이를 검증할 후속 연구를 계획하고 있다. 이관수 교수는 “이번 연구결과로 E3 효소와 관련된 단백질 분해조절의 네트워크가 구축되고, 이 네트워크에 존재하는 세포의 기능과 질병의 특이성을 시스템적으로 분석할 수 있게 됨에 따라, E3 효소와 관련된 세포의 기능 연구와 질병 연구에 새로운 전기가 마련되었다”고 연구의의를 밝혔다.
단백질 분해조절 효소 정보 담은 바이오마커 발굴 시스템 개발
- Mol Cell Proteomics지 게재, “바이오마커 개발의 새로운 패러다임 제시” -
단백질의 분해를 조절하는 효소와 기질에 대한 관계정보를 담은 바이오마커* 발굴 시스템(E3Net)이 국내 연구진에 의해 개발되어, 고부가가치의 새로운 바이오마커 개발에 가능성이 열렸다.
※ 바이오마커(Biomarker) : 유전자, 단백질 등에서 유래된 특이한 패턴의 분자적 정보로, 유전적․후천적 영향으로 발생한 신체의 변화를 감지할 수 있는 생물표지인자
우리학교 바이오및뇍 이관수 교수(49세)가 주도하고, 한영웅 박사과정생, 이호동 박사 및 박종철 교수가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 선도연구센터지원사업(NCRC), 신기술융합형성장동력사업 및 교육과학기술부의 KAIST 미래형 시스템 헬스케어 연구개발사업의 지원으로 수행되었고, 단백질체 연구 분야의 권위 있는 학술지인 ‘Molecular and Cellular Proteomics"지 4월호(4월 1일자)에 게재되었다. (논문명: A system for exploring E3-mediated regulatory networks of cellular functions)이관수 교수 연구팀은 전 세계 바이오 관련 DB(데이터베이스)와 논문(약 2만 편)으로부터 정보를 추출해 단백질 분해를 조절하는 효소(E3 효소)와 기질*들 간의 네트워크를 집대성하여, 이와 관련된 세포의 기능과 질병을 분석하는 ‘E3Net’ 시스템을 개발하였다.
※ 기질(substrate) : 효소와 특이적으로 결합하여 화학반응을 일으키는 분자로, 소화작용은 우리의 몸속에서 일어나는 효소와 기질간의 반응의 대표적인 사례
세포는 시시각각 변하는 환경에 대응하여 필요한 단백질들을 생산, 폐기 및 재활용하는 정교한 시스템을 가지고 있는데, 만일 이 과정에서 오류가 생기면 ‘질병’으로 이어질 수 있다.
따라서 단백질 분해를 조절하는 E3 효소와 기질 간의 관계를 파악하면 관련 질병을 치료하거나 예방할 수 있게 된다. 특히 E3 효소는 단백질 분해의 80%를 담당하는 것으로 알려져 수많은 질병이 관련되어 있을 것으로 예측되고 있다.
그러나 E3 효소와 기질 간의 정보들이 개별 논문과 DB에 흩어져 있어, 단백질 분해 조절과 관련된 세포의 기능과 질병의 특성을 종합적․체계적으로 분석할 수 없었다.
이 교수팀은 모든 E3 효소(2,201개)와 기질(4,896개) 및 그 조절관계(1,671개)에 대한 정보를 통합하여 E3 효소 조절 네트워크 내에 존재하는 관련된 세포의 기능과 질병을 시스템적으로 분석할 수 있는 E3Net을 구축하는데 성공하였다.
이 네트워크는 지금까지 구축된 조절정보를 모두 합친 것보다 무려 10배에 이르는 방대한 양으로, E3 효소가 독자적으로 또는 협력해서 조절하는 세포의 기능과 관련 질병을 정확히 파악할 수 있는 토대가 마련된 첫 사례로서 의미가 크다.
연구팀은 E3Net을 이용하면 각각의 질병과 관련된 단백질들의 분해조절을 담당하는 E3 효소들을 찾을 수 있고, 분해조절 원리와 세포기능 네트워크를 함께 파악하여 질병의 발생 원인이나 환자에 적합한 맞춤형 치료방법을 제공할 수 있는 바이오마커를 발굴할 수 있을 것으로 기대한다.
실제 연구팀은 E3Net을 활용해 암, 뇌심혈관 질환 및 당뇨병 등 현대인의 대표적 질환과 관련된 E3 바이오마커 후보 수십 개를 새롭게 발견하는 등 눈에 띄는 성과를 거두었고, 현재 이를 검증할 후속 연구를 계획하고 있다. 이관수 교수는 “이번 연구결과로 E3 효소와 관련된 단백질 분해조절의 네트워크가 구축되고, 이 네트워크에 존재하는 세포의 기능과 질병의 특이성을 시스템적으로 분석할 수 있게 됨에 따라, E3 효소와 관련된 세포의 기능 연구와 질병 연구에 새로운 전기가 마련되었다”고 연구의의를 밝혔다.
2012.05.01
조회수 25548
-
 생체삽입형 바이오센서 기술 개발
-유연한 GaN LED 기술로 암을 진단-
인간의 주름진 뇌에 부착하거나, 혈관 및 척추를 감싼 유연한 LED에서 발생된 빛으로 질병을 진단하거나 치료할 수 있는 일들이 현실로 가까워지고 있다.
우리 학교 신소재공학과 이건재 교수팀이 최근 질화물 반도체 발광다이오드(GaN-LED)를 유연한 기판 위에 구현해내고 LED에서 발생되는 빛이 암의 항원-항체반응에 의하여 감도 차이가 일어나는 것을 확인함으로써 전립선암 항체를 검출하는 실험에 성공했다.
이번 연구를 계기로 유연한 LED에서 발생하는 녹색, 파란색, 그리고 자외선 영역까지의 다양한 파장의 강한 빛을 이용하면 신경세포를 자극할 수 있어 질병을 치료하는 데에도 응용될 수 있을 것으로 기대된다.
질화갈륨(GaN)은 적은 에너지로 높은 효율의 빛을 낼 수 있는 반도체로 현재 LED TV, 조명 등 산업 전반에 쓰이고 있으나 깨지기 쉬운 성질을 갖고 있다.
연구팀은 딱딱한 기판에서 성장된 얇은 고효율 GaN-LED를 유연한 플라스틱 기판에 전사하고, 생체 친화적인 재료를 사용한 바이오센서를 개발해 인체와 유사한 조건에 적용할 수 있게 했다.
이건재 교수는 “인체에 삽입된 유연한 LED는 인간 생명 연장과 건강한 삶의 중요한 과제를 해결할 수 있는 흥미롭고 새로운 분야로 꿈같은 일들이 실현될 수 있을 것”이라고 말했다.
이번 연구결과는 나노 분야의 세계적인 석학이자 최고 권위자인 미국 조지아 공대 왕종린(Wang, Zhong Lin) 교수가 편집장으로 있는 "나노 에너지(Nano Energy)" 9월호 온라인 판에 게재됐다.
관련 연구는 2009년부터 국내외에 다수의 특허가 출원․등록되었고, 지난 3월에는 KAIST를 대표하는 브랜드 과제로 선정되기도 했다.
한편, 이 교수는 논문의 공동책임으로 참여한 ETRI 성건용 박사팀과 생체이식형 라벨프리(Label-Free) LED 바이오센서에 대해 후속 연구를 계속 진행하고 있다.(끝)
<관련 동영상>
생체 친화적이고 유연한 GaN-LED가 빛을 내는 동영상 http://www.youtube.com/watch?v=miqc-o8fOkw
<그림설명>구부러지는 유연한 GaN-LED에서 푸른빛이 발생되고 있다.
생체삽입형 바이오센서 기술 개발
-유연한 GaN LED 기술로 암을 진단-
인간의 주름진 뇌에 부착하거나, 혈관 및 척추를 감싼 유연한 LED에서 발생된 빛으로 질병을 진단하거나 치료할 수 있는 일들이 현실로 가까워지고 있다.
우리 학교 신소재공학과 이건재 교수팀이 최근 질화물 반도체 발광다이오드(GaN-LED)를 유연한 기판 위에 구현해내고 LED에서 발생되는 빛이 암의 항원-항체반응에 의하여 감도 차이가 일어나는 것을 확인함으로써 전립선암 항체를 검출하는 실험에 성공했다.
이번 연구를 계기로 유연한 LED에서 발생하는 녹색, 파란색, 그리고 자외선 영역까지의 다양한 파장의 강한 빛을 이용하면 신경세포를 자극할 수 있어 질병을 치료하는 데에도 응용될 수 있을 것으로 기대된다.
질화갈륨(GaN)은 적은 에너지로 높은 효율의 빛을 낼 수 있는 반도체로 현재 LED TV, 조명 등 산업 전반에 쓰이고 있으나 깨지기 쉬운 성질을 갖고 있다.
연구팀은 딱딱한 기판에서 성장된 얇은 고효율 GaN-LED를 유연한 플라스틱 기판에 전사하고, 생체 친화적인 재료를 사용한 바이오센서를 개발해 인체와 유사한 조건에 적용할 수 있게 했다.
이건재 교수는 “인체에 삽입된 유연한 LED는 인간 생명 연장과 건강한 삶의 중요한 과제를 해결할 수 있는 흥미롭고 새로운 분야로 꿈같은 일들이 실현될 수 있을 것”이라고 말했다.
이번 연구결과는 나노 분야의 세계적인 석학이자 최고 권위자인 미국 조지아 공대 왕종린(Wang, Zhong Lin) 교수가 편집장으로 있는 "나노 에너지(Nano Energy)" 9월호 온라인 판에 게재됐다.
관련 연구는 2009년부터 국내외에 다수의 특허가 출원․등록되었고, 지난 3월에는 KAIST를 대표하는 브랜드 과제로 선정되기도 했다.
한편, 이 교수는 논문의 공동책임으로 참여한 ETRI 성건용 박사팀과 생체이식형 라벨프리(Label-Free) LED 바이오센서에 대해 후속 연구를 계속 진행하고 있다.(끝)
<관련 동영상>
생체 친화적이고 유연한 GaN-LED가 빛을 내는 동영상 http://www.youtube.com/watch?v=miqc-o8fOkw
<그림설명>구부러지는 유연한 GaN-LED에서 푸른빛이 발생되고 있다.
2011.09.20
조회수 15121
-
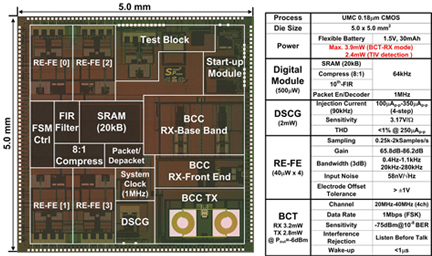 유회준 교수 연구팀, 세계 최초로 가슴에 붙이는 심장건강상태 모니터링 장치 개발
- 붙이는 파스형태의 심장 건강상태 모니터링 장치, ‘스마트 파스’ 세계 최초개발 -
전기및전자공학과 유회준 교수 연구팀이 세계 최초로 가슴에 붙이는 심장건강상태 모니터링 장치를 최근 개발했다.
붙이는 파스형태로 제작돼 휴대폰 등의 휴대용 단말기기를 통하여 원격으로 켜고 끌 수 있으며 데이터통신도 가능하다.
고성능 반도체 집적회로(헬스케어 칩)가 파스 안에 장착돼 있고 파스 표면에 25개의 전극이 형성돼 있어 다양한 형태로 전극을 사용할 수 있으며 심장의 수축·이완 능력과 심전도 신호를 동시에 검출해 무선으로 외부에 알려 준다.
이 장치의 핵심은 크게 심혈관 저항 및 심전도 측정 집적회로(헬스케어 칩)와 이 칩을 내부에 장착하고 있으며 표면에 전극을 형성시킨 4층 헝겊형 기판기술이다.
직물 위에 전극 및 회로 기판을 직접 인쇄할 수 있는 P-FCB(Planar Fashionable Circuit Board)기술로 서로 다른 헝겊에 전극, 무선 안테나, 회로기판(이 헝겊의 중앙부에 헬스 케어 칩을 부착)형성한 후 플렉시블 배터리와 함께 적층해 이 장치를 제작했다.
또한 전극 제어부, 심전도·혈관 저항 측정부, 데이터 압축부, SRAM, 무선 송수신 장치 등을 가지고 초저전력으로 동작하는 특수 헬스 케어 집적회로(크기 5mm X 5mm)를 제작해 헝겊형 회로 기판 위에 부착시켰다.
전극이 형성된 헝겊 면에는 접착제가 발라져 있어 일반 파스처럼 가슴에 부착시켜 사용하게 된다. 완성품은 가로 세로 15Cm X 15Cm이며 두께는 가장 두꺼운 중앙 부분이 1mm정도이다.
특히, 헬스 케어 칩은 차동전류주입기와 재구성이 가능한 고감도 검출 회로를 통해 심혈관 임피던스 변화를 16가지 서로 다른 조합으로 0.81% 신호왜곡 이하로 검출 가능하다.
KAIST 얜롱(Yan Long, 전기및전자공학과 박사과정)연구원은 “헝겊 위에 직접 전극 배열을 인쇄하고 건강관리 칩과 플렉시블 배터리를 부착함으로서 편의성과 착용감을 확보해 간편하게 심전도와 심혈관 임피던스 변화를 동시에 측정할 수 있다.”라고 말했다.
자신의 건강상태를 실시간으로 간편하게 자가진단을 할 수 있어 지속적인 관리가 필요한 만성 심부전 환자 등을 포함한 심혈관 질병이 있는 사람들에게 안성맞춤이다.
만성 심혈관 관련 환자를 위한 건강관리 기술은 2000년 이후 전 세계적으로 꾸준한 관심을 받고 있으나, 대부분 심장의 전기적 특성 즉 심전도 신호만을 검출하는데 그쳤다. 현재까지 개발된 측정기는 크고 이물감이 있으며, 유선으로 연결되는 등 외부와의 저전력 통신이 어려워 일상생활에서 널리 사용되지 못하고 있다.
이번 연구결과는 지난 2월 8일부터 10일까지 미국 샌프란시스코에서 개최된 국제반도체회로 학술회의(ISSCC)에 발표됐다.
❋ ISSCC (International Solid State Circuit Conference: 국제 고체 회로 학회)학회:1954년부터 국제 전기전자공학회 (IEEE SSCS) 주관으로 매년 2월에 미국 San Francisco, Marriot 호텔에서 개최되는 이 분야 최고 권위의 학회로 ‘반도체 올림픽’이라고 불리우고 있음. 전 세계로부터 4천여명의 학자와 연구원들이 참여한 가운데 매년 반도체 분야 최우수 논문 210편만을 엄선하여 3일 동안 발표하면서 연구 성과와 정보를 교환하고 미래의 반도체 산업과 기술을 논의하는 학회임.
(사진 1) 스마트 파스 구조
스마트 파스는 총 4층 구조로 형성 되어 있으며 그 크기는 15cm x 15cm 이다. 가슴에 부착하는 면인 제 1층은 25개의 전극이 형성되어 이 중 4개는 전류 주입 전극으로 16개는 전압 측정 전극으로 5개는 기준 전극으로 사용할 수 있다. 제 2층은 직물형 인덕터(2.2uH, Q=9.2)로 스마트 파스의 무선 데이터 통신을 지원한다. 제 3층은 플렉시블 배터리(1.5V, 30mAh)로 파스를 하루이상 지속적으로 사용할 수 있도록 전원을 공급한다. 제 4층은 직물형 인쇄 회로 기판으로 그 위에 고성능 반도체 칩이 장착되어 있다.
(사진 2) 스마트 파스 사용 예
사용자가 스마트 파스를 가슴에 붙인 모습을 보여 준다. 휴대폰 등의 휴대용 단말기기를 통하여 원격으로 켜고 끌 수 있으며 25개의 전극배열이 피부와 접착되어 있어 심혈관 저항 및 심전도를 여러 가지 형태로 측정하여 내장메모리에 저장 또는 휴대용 단말기기로데이터를 고속으로 송신도 가능하다.
(사진 3) 스마트 파스 측정 예스마트 파스를 통하여 측정된 심전도 신호와 심혈관의 저항의 변화를 보여 준다. 이러한 신호로부터 심장의 수축 이완 능력을 편리하게 일상생활 속에서 측정 가능하다.
(사진 4) 스마트 파스에 장착된 헬스 케어 칩
직물형 인쇄 회로 기판에 장착되어 있는 고성능 반도체칩(헬스케어 칩)의 사진과 제원이다. 본 헬스케어 칩은 최대 3.9mW의 전력을 소모하며 평균 2.4mW의 전력소비로 0.1옴이하의 저항 변화를 고감도 회로를 통하여 검출 가능케 하는 것이 특징이다.
유회준 교수 연구팀, 세계 최초로 가슴에 붙이는 심장건강상태 모니터링 장치 개발
- 붙이는 파스형태의 심장 건강상태 모니터링 장치, ‘스마트 파스’ 세계 최초개발 -
전기및전자공학과 유회준 교수 연구팀이 세계 최초로 가슴에 붙이는 심장건강상태 모니터링 장치를 최근 개발했다.
붙이는 파스형태로 제작돼 휴대폰 등의 휴대용 단말기기를 통하여 원격으로 켜고 끌 수 있으며 데이터통신도 가능하다.
고성능 반도체 집적회로(헬스케어 칩)가 파스 안에 장착돼 있고 파스 표면에 25개의 전극이 형성돼 있어 다양한 형태로 전극을 사용할 수 있으며 심장의 수축·이완 능력과 심전도 신호를 동시에 검출해 무선으로 외부에 알려 준다.
이 장치의 핵심은 크게 심혈관 저항 및 심전도 측정 집적회로(헬스케어 칩)와 이 칩을 내부에 장착하고 있으며 표면에 전극을 형성시킨 4층 헝겊형 기판기술이다.
직물 위에 전극 및 회로 기판을 직접 인쇄할 수 있는 P-FCB(Planar Fashionable Circuit Board)기술로 서로 다른 헝겊에 전극, 무선 안테나, 회로기판(이 헝겊의 중앙부에 헬스 케어 칩을 부착)형성한 후 플렉시블 배터리와 함께 적층해 이 장치를 제작했다.
또한 전극 제어부, 심전도·혈관 저항 측정부, 데이터 압축부, SRAM, 무선 송수신 장치 등을 가지고 초저전력으로 동작하는 특수 헬스 케어 집적회로(크기 5mm X 5mm)를 제작해 헝겊형 회로 기판 위에 부착시켰다.
전극이 형성된 헝겊 면에는 접착제가 발라져 있어 일반 파스처럼 가슴에 부착시켜 사용하게 된다. 완성품은 가로 세로 15Cm X 15Cm이며 두께는 가장 두꺼운 중앙 부분이 1mm정도이다.
특히, 헬스 케어 칩은 차동전류주입기와 재구성이 가능한 고감도 검출 회로를 통해 심혈관 임피던스 변화를 16가지 서로 다른 조합으로 0.81% 신호왜곡 이하로 검출 가능하다.
KAIST 얜롱(Yan Long, 전기및전자공학과 박사과정)연구원은 “헝겊 위에 직접 전극 배열을 인쇄하고 건강관리 칩과 플렉시블 배터리를 부착함으로서 편의성과 착용감을 확보해 간편하게 심전도와 심혈관 임피던스 변화를 동시에 측정할 수 있다.”라고 말했다.
자신의 건강상태를 실시간으로 간편하게 자가진단을 할 수 있어 지속적인 관리가 필요한 만성 심부전 환자 등을 포함한 심혈관 질병이 있는 사람들에게 안성맞춤이다.
만성 심혈관 관련 환자를 위한 건강관리 기술은 2000년 이후 전 세계적으로 꾸준한 관심을 받고 있으나, 대부분 심장의 전기적 특성 즉 심전도 신호만을 검출하는데 그쳤다. 현재까지 개발된 측정기는 크고 이물감이 있으며, 유선으로 연결되는 등 외부와의 저전력 통신이 어려워 일상생활에서 널리 사용되지 못하고 있다.
이번 연구결과는 지난 2월 8일부터 10일까지 미국 샌프란시스코에서 개최된 국제반도체회로 학술회의(ISSCC)에 발표됐다.
❋ ISSCC (International Solid State Circuit Conference: 국제 고체 회로 학회)학회:1954년부터 국제 전기전자공학회 (IEEE SSCS) 주관으로 매년 2월에 미국 San Francisco, Marriot 호텔에서 개최되는 이 분야 최고 권위의 학회로 ‘반도체 올림픽’이라고 불리우고 있음. 전 세계로부터 4천여명의 학자와 연구원들이 참여한 가운데 매년 반도체 분야 최우수 논문 210편만을 엄선하여 3일 동안 발표하면서 연구 성과와 정보를 교환하고 미래의 반도체 산업과 기술을 논의하는 학회임.
(사진 1) 스마트 파스 구조
스마트 파스는 총 4층 구조로 형성 되어 있으며 그 크기는 15cm x 15cm 이다. 가슴에 부착하는 면인 제 1층은 25개의 전극이 형성되어 이 중 4개는 전류 주입 전극으로 16개는 전압 측정 전극으로 5개는 기준 전극으로 사용할 수 있다. 제 2층은 직물형 인덕터(2.2uH, Q=9.2)로 스마트 파스의 무선 데이터 통신을 지원한다. 제 3층은 플렉시블 배터리(1.5V, 30mAh)로 파스를 하루이상 지속적으로 사용할 수 있도록 전원을 공급한다. 제 4층은 직물형 인쇄 회로 기판으로 그 위에 고성능 반도체 칩이 장착되어 있다.
(사진 2) 스마트 파스 사용 예
사용자가 스마트 파스를 가슴에 붙인 모습을 보여 준다. 휴대폰 등의 휴대용 단말기기를 통하여 원격으로 켜고 끌 수 있으며 25개의 전극배열이 피부와 접착되어 있어 심혈관 저항 및 심전도를 여러 가지 형태로 측정하여 내장메모리에 저장 또는 휴대용 단말기기로데이터를 고속으로 송신도 가능하다.
(사진 3) 스마트 파스 측정 예스마트 파스를 통하여 측정된 심전도 신호와 심혈관의 저항의 변화를 보여 준다. 이러한 신호로부터 심장의 수축 이완 능력을 편리하게 일상생활 속에서 측정 가능하다.
(사진 4) 스마트 파스에 장착된 헬스 케어 칩
직물형 인쇄 회로 기판에 장착되어 있는 고성능 반도체칩(헬스케어 칩)의 사진과 제원이다. 본 헬스케어 칩은 최대 3.9mW의 전력을 소모하며 평균 2.4mW의 전력소비로 0.1옴이하의 저항 변화를 고감도 회로를 통하여 검출 가능케 하는 것이 특징이다.
2010.02.10
조회수 24819
-
 김봉수교수, 은나노선 합성법 개발
단결정 銀 나노선 합성법 최초 개발
- 질병진단센서, 바이오센서, 차세대 자성소자 등 광범위한 활용- 화학분야 최고 권위지인 미국화학회지에 지난 18일자 속보로 게재
KAIST(총장 서남표) 화학과 김봉수(金峯秀, 48) 교수 연구팀은 촉매를 전혀 사용하지 않는 새로운 합성법 개발로 ‘단결정 은 나노선 합성’에 최초로 성공했다. 이 연구 결과는 화학분야 최고 권위지인 미국화학회지(Journal of the American Chemical Society)에 지난 18일(수) 속보로 게재됐다.
은(Ag)은 높은 항균효과를 지니며, 전자 및 광학 재료로도 중요하게 사용된다. 은을 완벽한 단결정 나노선으로 만들면 탄소가 다이아몬드로 변하듯 물질의 특성이 변하면서 가치가 크게 높아진다. 보통의 물질은 촉매 등을 사용하면 단결정 나노선 합성이 가능한데 은과 같은 금속의 경우에는 적절한 촉매를 찾아내지 못해서 합성이 불가능했다.
金 교수는 촉매를 사용하지 않고 산화은을 출발물질로 적절한 응결조건을 맞추어줌으로써 은 입자들이 가장 에너지가 낮은 상태를 스스로 찾아가서 저절로 은 나노선이 생긴다는 사실을 발견했다. 이 기술을 이용하면 금속 및 금속화합물 대부분을 단결정 나노선으로 만들 수 있다. 특히 자성물질 나노선 및 열전소자 나노선 개발로 차세대 자성 소자 및 신에너지 핵심 물질을 개발할 수 있는 가능성이 열렸다. 합성된 은 나노섬유는 소독이 필요 없는 의료용 제품 개발, 바이오센서 및 자성메모리 제작 등에 중요한 소재가 될 수 있다.
은에 분자가 흡착되면 빛을 쪼였을 때 산란되는 빛의 세기가 1조배 이상 커진다. 이를 “표면증강 라만 효과”라 하며, 단 하나의 분자만 존재하더라도 검출이 가능하다. 이 효과는 은이 나노입자 크기로 작아지면 더욱 높아지므로 이를 이용한 질병 진단기 개발 연구가 활발하게 진행되고 있다. 특히, 은 나노선은 진단 능력이 보다 뛰어나 질병진단센서로 개발 전망이 높다.
이 연구는 과학기술부「21세기 프론티어연구개발사업」나노소재기술개발사업단에서 지원했으며, 연구 결과는 현재 세계 각국에 특허 출원중이다.
<붙임1. 용어해설>
■ 단결정 은 나노선나노선은 직경이 수 나노미터에서 수백 나노미터 사이에 있는 아주 가늘고 긴 선을 말한다. 단결정은 물질을 이루고 있는 모든 구성원소가 규칙적으로 배열되어 있는 순수하고 독특한 구조인데 다이아몬드 같은 것이 대표적 예다. 은과 같은 금속의 경우에는 적절한 촉매를 찾아내지 못해서 합성이 불가능한데, 이번에 촉매를 사용하지 않고 은이 스스로 단결정 나노선을 이루는 새로운 합성법을 개발했다.
■ 은 나노섬유의 의료분야 응용
은 나노섬유를 이용하여 상처를 보호하기 위해 사용하는 의료용 붕대 등을 제작하면 병균 등의 침투를 근본적으로 방지할 수 있으므로 강력한 의료용 소재가 될 것으로 전망된다.
■ 미국 화학회지(Journal of the American Chemical Society)미국화학회(American Chemical Society)에서 발행하는 대표 학회지로서 가장 역사가 오래되고 권위가 높은 학술지이다. 여기서 특히 긴급하며 중요성이 높은 연구결과는 속보(Communication)로 신속하게 발표된다.
<붙임2. 관련 사진 및 설명>
1. 연구팀이 합성에 성공한 단결정 은 나노선의 전자현미경 사진
2. 하나하나의 원자까지 보여주며 완벽한 은 단결정임을 증명하는 초고전압 전자현미경 사진
김봉수교수, 은나노선 합성법 개발
단결정 銀 나노선 합성법 최초 개발
- 질병진단센서, 바이오센서, 차세대 자성소자 등 광범위한 활용- 화학분야 최고 권위지인 미국화학회지에 지난 18일자 속보로 게재
KAIST(총장 서남표) 화학과 김봉수(金峯秀, 48) 교수 연구팀은 촉매를 전혀 사용하지 않는 새로운 합성법 개발로 ‘단결정 은 나노선 합성’에 최초로 성공했다. 이 연구 결과는 화학분야 최고 권위지인 미국화학회지(Journal of the American Chemical Society)에 지난 18일(수) 속보로 게재됐다.
은(Ag)은 높은 항균효과를 지니며, 전자 및 광학 재료로도 중요하게 사용된다. 은을 완벽한 단결정 나노선으로 만들면 탄소가 다이아몬드로 변하듯 물질의 특성이 변하면서 가치가 크게 높아진다. 보통의 물질은 촉매 등을 사용하면 단결정 나노선 합성이 가능한데 은과 같은 금속의 경우에는 적절한 촉매를 찾아내지 못해서 합성이 불가능했다.
金 교수는 촉매를 사용하지 않고 산화은을 출발물질로 적절한 응결조건을 맞추어줌으로써 은 입자들이 가장 에너지가 낮은 상태를 스스로 찾아가서 저절로 은 나노선이 생긴다는 사실을 발견했다. 이 기술을 이용하면 금속 및 금속화합물 대부분을 단결정 나노선으로 만들 수 있다. 특히 자성물질 나노선 및 열전소자 나노선 개발로 차세대 자성 소자 및 신에너지 핵심 물질을 개발할 수 있는 가능성이 열렸다. 합성된 은 나노섬유는 소독이 필요 없는 의료용 제품 개발, 바이오센서 및 자성메모리 제작 등에 중요한 소재가 될 수 있다.
은에 분자가 흡착되면 빛을 쪼였을 때 산란되는 빛의 세기가 1조배 이상 커진다. 이를 “표면증강 라만 효과”라 하며, 단 하나의 분자만 존재하더라도 검출이 가능하다. 이 효과는 은이 나노입자 크기로 작아지면 더욱 높아지므로 이를 이용한 질병 진단기 개발 연구가 활발하게 진행되고 있다. 특히, 은 나노선은 진단 능력이 보다 뛰어나 질병진단센서로 개발 전망이 높다.
이 연구는 과학기술부「21세기 프론티어연구개발사업」나노소재기술개발사업단에서 지원했으며, 연구 결과는 현재 세계 각국에 특허 출원중이다.
<붙임1. 용어해설>
■ 단결정 은 나노선나노선은 직경이 수 나노미터에서 수백 나노미터 사이에 있는 아주 가늘고 긴 선을 말한다. 단결정은 물질을 이루고 있는 모든 구성원소가 규칙적으로 배열되어 있는 순수하고 독특한 구조인데 다이아몬드 같은 것이 대표적 예다. 은과 같은 금속의 경우에는 적절한 촉매를 찾아내지 못해서 합성이 불가능한데, 이번에 촉매를 사용하지 않고 은이 스스로 단결정 나노선을 이루는 새로운 합성법을 개발했다.
■ 은 나노섬유의 의료분야 응용
은 나노섬유를 이용하여 상처를 보호하기 위해 사용하는 의료용 붕대 등을 제작하면 병균 등의 침투를 근본적으로 방지할 수 있으므로 강력한 의료용 소재가 될 것으로 전망된다.
■ 미국 화학회지(Journal of the American Chemical Society)미국화학회(American Chemical Society)에서 발행하는 대표 학회지로서 가장 역사가 오래되고 권위가 높은 학술지이다. 여기서 특히 긴급하며 중요성이 높은 연구결과는 속보(Communication)로 신속하게 발표된다.
<붙임2. 관련 사진 및 설명>
1. 연구팀이 합성에 성공한 단결정 은 나노선의 전자현미경 사진
2. 하나하나의 원자까지 보여주며 완벽한 은 단결정임을 증명하는 초고전압 전자현미경 사진
2007.07.23
조회수 28542
-
 생명화학공학과 이상엽 교수, 획기적인 단백체 분석 기술 개발
과학기술부 시스템생물학 연구개발사업 결실
열충격 단백질이 세포외에서 단백질 분해를 효과적으로 억제하는 현상 최초 규명
기존 단백질 분해 저해제보다 최고 50% 이상 단백질 검출 가능 기술 개발
전세계 특허 출원/등록 중, 단백체 연구분야 권위지 미국화학회 발간 저널 오브 프로테옴 리서치에 게재 예정, 온라인판에 공개
생명화학공학과 이상엽 교수(李相燁, 41, LG화학 석좌교수)가 작은 열충격 단백질의 세포외 단백질 분해 저해 기능을 적용하여 획기적으로 향상된 새로운 단백체 분석 기술을 개발했다.
1. 개발배경
포스트 게놈 시대의 가장 주목 받는 연구 분야로서, 또한 시스템 생물학의 중심이 되는 한 분야로서, 세포의 생리적 변화를 단백질 수준에서 관찰할 수 있는 단백체(프로테옴) 연구에 대한 관심이 집중되고 있다. 단백체 연구의 가장 핵심적인 기술은 세포, 조직, 또는 생물체 유래 샘플을 폴리아크릴아마이드젤(polyacrylamide gel) 상에서 2차원 전기영동방법으로 분리하는 것이다. 이때 전체 단백질들을 분석할 수 있도록 단백질 분해를 막는 것이 매우 중요하다.
이제까지 다양한 단백질 분해 저해제들이 개발되어 실험에 사용되어 왔다. 하지만, 단백체 분석시 2차원 전기영동된 젤(gel)에서는 단백질 분해 등의 현상으로 인해 게놈에서 예측되는 숫자보다 훨씬 적은 수의 단백질들이 발견되어 전체 단백질 대상 연구에 한계를 드러냈다.
2. 개발현황
과학기술부 시스템생물학 연구개발사업으로 진행된 이 연구에서 李 교수팀은 대장균의 전체 전사체와 단백체를 분석하고, 이들을 대사 및 조절회로에 연관시키는 과정에서 작은 열충격 단백질의 새로운 기능을 발견하게 되었다.
직접 대장균에서 작은 열충격 단백질을 생산ㆍ정제하고, 이를 이용한 세포 밖 시험관 (in vitro)에서 작은 열충격 단백질이 다양한 효소에 의한 단백질 분해를 효율적으로 억제함을 규명하였다.
또한, 다른 종에서 유래한 작은 열충격 단백질들도 마찬가지로 단백질 분해를 억제하는데 사용될 수 있음도 밝혀냈다.
李 교수팀은 단백체 연구의 핵심기술 중의 하나인 2차원 전기영동시 단백질이 분해되어 변형되거나 없어지는 문제를 해결하고자 이 발견된 기술을 적용하였다. 2차원 전기영동시 작은 열충격 단백질 첨가로 단백질 분해 현상을 저해시킬 수 있음을 밝혀내었다.
기존에 알려진 단백질 분해 저해제를 적용하였을 때는 검출 되지 않았던 단백질들도 이 새로운 방법을 이용하였을 때 검출 가능하였다. 최고 50% 이상 증가된 숫자의 단백질들이 보일 정도로 획기적인 기술로 평가된다.
또한, 이 방법을 미생물뿐 아니라 사람, 식물 유래의 다양한 단백질 시료에도 적용하여 모든 경우에서 그 효과를 확인함으로써, 이 기술이 매우 광범위한 단백질 시료에 적용 가능함을 보여 주었다.
3. 개발성과 및 향후계획
기존의 방법으로 검출 되지 않았던 단백질들이 새로 개발된 방법으로 검출 가능하므로 단백체를 이용한 세포내 생리 변화 관찰 또는 질병 진단 표지 개발 등에 상당한 고성능의 분해능을 제공해 줄 수 있다. 李 교수는 “모든 단백체 분석에 적용이 가능한 이 기술이 향후 단백체 연구 분야에 획기적인 발전을 가져올 것으로 기대한다”고 말했다.
이 기술은 현재 전 세계 특허 출원/등록 중이고, 미국화학회 (American Chemical Society)에서 발간하는 단백체 분야의 권위 있는 학술지인 저널 오브 프로테옴 리서치 (Journal of Proteome Research)에 실리게 되며, 온라인 판에 게재 되었다.
<사진설명>
작은 열충격 단백질 첨가에 의한 단백질 분해를 최소화시켜 분석가능한 단백질 수를 획기적으로 늘린 결과를 보여주는 젤(gel) 사진 (왼쪽 위부터 시계방향으로)
1. 대장균 단백질 시료에 기존에 시판되는 단백질 분해억제제인 칵테일 인히비터를 첨가하여 2차원 전기영동한 젤
2. 같은 시료에 IbpAEc (대장균 유래의 작은 열충격 단백질)를 첨가하여 2차원 전기영동한 젤
3. 같은 시료에 Hsp26Sc (효모 유래의 작은 열충격 단백질)를 첨가하여 2차원 전기영동한 젤
4. 같은 시료에 IbpBEc (대장균 유래의 또 다른 작은 열충격 단백질)를 첨가하여 2차원 전기영동한 젤
- 각 그림의 원 안은 확대된 이미지로서 작은 열충격 단백질 첨가시 까만점(단백질)의 수가 획기적으로 늘어났음을 볼 수 있음.
생명화학공학과 이상엽 교수, 획기적인 단백체 분석 기술 개발
과학기술부 시스템생물학 연구개발사업 결실
열충격 단백질이 세포외에서 단백질 분해를 효과적으로 억제하는 현상 최초 규명
기존 단백질 분해 저해제보다 최고 50% 이상 단백질 검출 가능 기술 개발
전세계 특허 출원/등록 중, 단백체 연구분야 권위지 미국화학회 발간 저널 오브 프로테옴 리서치에 게재 예정, 온라인판에 공개
생명화학공학과 이상엽 교수(李相燁, 41, LG화학 석좌교수)가 작은 열충격 단백질의 세포외 단백질 분해 저해 기능을 적용하여 획기적으로 향상된 새로운 단백체 분석 기술을 개발했다.
1. 개발배경
포스트 게놈 시대의 가장 주목 받는 연구 분야로서, 또한 시스템 생물학의 중심이 되는 한 분야로서, 세포의 생리적 변화를 단백질 수준에서 관찰할 수 있는 단백체(프로테옴) 연구에 대한 관심이 집중되고 있다. 단백체 연구의 가장 핵심적인 기술은 세포, 조직, 또는 생물체 유래 샘플을 폴리아크릴아마이드젤(polyacrylamide gel) 상에서 2차원 전기영동방법으로 분리하는 것이다. 이때 전체 단백질들을 분석할 수 있도록 단백질 분해를 막는 것이 매우 중요하다.
이제까지 다양한 단백질 분해 저해제들이 개발되어 실험에 사용되어 왔다. 하지만, 단백체 분석시 2차원 전기영동된 젤(gel)에서는 단백질 분해 등의 현상으로 인해 게놈에서 예측되는 숫자보다 훨씬 적은 수의 단백질들이 발견되어 전체 단백질 대상 연구에 한계를 드러냈다.
2. 개발현황
과학기술부 시스템생물학 연구개발사업으로 진행된 이 연구에서 李 교수팀은 대장균의 전체 전사체와 단백체를 분석하고, 이들을 대사 및 조절회로에 연관시키는 과정에서 작은 열충격 단백질의 새로운 기능을 발견하게 되었다.
직접 대장균에서 작은 열충격 단백질을 생산ㆍ정제하고, 이를 이용한 세포 밖 시험관 (in vitro)에서 작은 열충격 단백질이 다양한 효소에 의한 단백질 분해를 효율적으로 억제함을 규명하였다.
또한, 다른 종에서 유래한 작은 열충격 단백질들도 마찬가지로 단백질 분해를 억제하는데 사용될 수 있음도 밝혀냈다.
李 교수팀은 단백체 연구의 핵심기술 중의 하나인 2차원 전기영동시 단백질이 분해되어 변형되거나 없어지는 문제를 해결하고자 이 발견된 기술을 적용하였다. 2차원 전기영동시 작은 열충격 단백질 첨가로 단백질 분해 현상을 저해시킬 수 있음을 밝혀내었다.
기존에 알려진 단백질 분해 저해제를 적용하였을 때는 검출 되지 않았던 단백질들도 이 새로운 방법을 이용하였을 때 검출 가능하였다. 최고 50% 이상 증가된 숫자의 단백질들이 보일 정도로 획기적인 기술로 평가된다.
또한, 이 방법을 미생물뿐 아니라 사람, 식물 유래의 다양한 단백질 시료에도 적용하여 모든 경우에서 그 효과를 확인함으로써, 이 기술이 매우 광범위한 단백질 시료에 적용 가능함을 보여 주었다.
3. 개발성과 및 향후계획
기존의 방법으로 검출 되지 않았던 단백질들이 새로 개발된 방법으로 검출 가능하므로 단백체를 이용한 세포내 생리 변화 관찰 또는 질병 진단 표지 개발 등에 상당한 고성능의 분해능을 제공해 줄 수 있다. 李 교수는 “모든 단백체 분석에 적용이 가능한 이 기술이 향후 단백체 연구 분야에 획기적인 발전을 가져올 것으로 기대한다”고 말했다.
이 기술은 현재 전 세계 특허 출원/등록 중이고, 미국화학회 (American Chemical Society)에서 발간하는 단백체 분야의 권위 있는 학술지인 저널 오브 프로테옴 리서치 (Journal of Proteome Research)에 실리게 되며, 온라인 판에 게재 되었다.
<사진설명>
작은 열충격 단백질 첨가에 의한 단백질 분해를 최소화시켜 분석가능한 단백질 수를 획기적으로 늘린 결과를 보여주는 젤(gel) 사진 (왼쪽 위부터 시계방향으로)
1. 대장균 단백질 시료에 기존에 시판되는 단백질 분해억제제인 칵테일 인히비터를 첨가하여 2차원 전기영동한 젤
2. 같은 시료에 IbpAEc (대장균 유래의 작은 열충격 단백질)를 첨가하여 2차원 전기영동한 젤
3. 같은 시료에 Hsp26Sc (효모 유래의 작은 열충격 단백질)를 첨가하여 2차원 전기영동한 젤
4. 같은 시료에 IbpBEc (대장균 유래의 또 다른 작은 열충격 단백질)를 첨가하여 2차원 전기영동한 젤
- 각 그림의 원 안은 확대된 이미지로서 작은 열충격 단백질 첨가시 까만점(단백질)의 수가 획기적으로 늘어났음을 볼 수 있음.
2005.11.11
조회수 21217
 획기적 암 치료제를 만들 단백질 코드 규명
우리 대학 의과학대학원 이지민 교수 연구팀이 유럽분자생물학연구소(EMBL) 미하일 사비스키(Mikhail Savitski) 교수, 서울대학교 백성희 교수와 공동 연구를 통해 질환의 억제와 촉진의 실마리가 되는 단백질 수명을 결정하는 단백질 *번역 후 조절(post-translational modification, 이하 PTM) 코드를 규명했다고 1일 밝혔다.
* 번역 후 조절(PTM): DNA가 mRNA가는 전사 과정을 거쳐 최종 단백질로 번역까지 일어난 이후에 추가적으로 생기는 현상으로, 단백질의 구조나 효능에 영향을 미치는 것으로 주로 알려져 있음
연구팀은 기존에 단백질의 운명 조절과 연관이 없을 것으로 생각됐던 PTM 신호를 `PTM-활성화(PTM-activated) 데그론'과 `PTM-불활성화(PTM-inactivated) 데그론'으로 구분해 단백질 수명 조절과의 관련성을 규명했다.
*PTM 활성화 데그론과 PTM 볼활성화 데그론: PTM에 의해 데그론이 활성화 되는 것은 단백질의 번역후 변화가 단백질의 분해를 촉진했다는 것을 의미하며, 반대로 불활성화 데그론은 번역 후 조절 신호가 단백질의 분해를 억제하여 단백질의 축적이 일어났음을 의미
여기서 데그론 코드란 단백질 수준을 조절 가능한 아미노산 서열의 조합 개념으로 질병의 진행이나 억제의 스위치 역할을 하는 단백질의 수명 조절 코드를 말한다.
연구팀은 이를 규명한 결과 기존 치료제가 접근할 수 없는 `기존에 약으로 만들지 못했던(Undruggable)' 신규 타깃의 정확도 높은 치료법 개발의 가능성을 열었다.
또한 연구팀은 신규 PTM 관련 코드를 다각화함으로 인해 단백질 분해 및 생성의 근본 원인을 알 수 없었던 기존의 신호 전달 체계에 PTM을 유도하거나 제거하는 효소의 역할을 재조명했다. 이번 연구를 통해 질병 관련 단백질 수명 변화 기원을 PTM 코드로 디지털화해서 미리 규명을 함으로써 그동안 단백질 수준을 마지막 단계에서 조절하는 *유비퀴틴 신호에만 집중했던 부분을 변경하도록 제안했다.
* 유비퀴틴: 단백질이 분해되기 전에 먼저 일어나는 대표적인 화학적 변화로 알려져 있으며 없어져야 할 단백질에 붙는 표지자로 널리 알려져 있음
우리 대학 의과학대학원 이지민 교수가 제1 저자로 초청돼 기고한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications, IF 17.69)' 에 지난 1월 13일 字 출판됐다. (논문명 : Control of protein stability by post-translational modifications).
이지민 교수는 "새롭게 제시한 PTM-활성화 또는 PTM-불활성화 데그론 코드의 규격화는 기존 약에 반응하지 않거나 저항성이 생기는 단백질 수준을 조절 가능한 다양한 질병 (대표적으로 암이나 퇴행성 뇌질환)의 진단 및 의약품 개발로 발전시킬 수 있을 것으로 기대된다ˮ 고 밝혔다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 리더연구사업,유럽분자생물학연구소 및 과학기술정보통신부 의사과학자양성사업의 지원을 받아 수행됐다.
2023.02.01 조회수 9249
획기적 암 치료제를 만들 단백질 코드 규명
우리 대학 의과학대학원 이지민 교수 연구팀이 유럽분자생물학연구소(EMBL) 미하일 사비스키(Mikhail Savitski) 교수, 서울대학교 백성희 교수와 공동 연구를 통해 질환의 억제와 촉진의 실마리가 되는 단백질 수명을 결정하는 단백질 *번역 후 조절(post-translational modification, 이하 PTM) 코드를 규명했다고 1일 밝혔다.
* 번역 후 조절(PTM): DNA가 mRNA가는 전사 과정을 거쳐 최종 단백질로 번역까지 일어난 이후에 추가적으로 생기는 현상으로, 단백질의 구조나 효능에 영향을 미치는 것으로 주로 알려져 있음
연구팀은 기존에 단백질의 운명 조절과 연관이 없을 것으로 생각됐던 PTM 신호를 `PTM-활성화(PTM-activated) 데그론'과 `PTM-불활성화(PTM-inactivated) 데그론'으로 구분해 단백질 수명 조절과의 관련성을 규명했다.
*PTM 활성화 데그론과 PTM 볼활성화 데그론: PTM에 의해 데그론이 활성화 되는 것은 단백질의 번역후 변화가 단백질의 분해를 촉진했다는 것을 의미하며, 반대로 불활성화 데그론은 번역 후 조절 신호가 단백질의 분해를 억제하여 단백질의 축적이 일어났음을 의미
여기서 데그론 코드란 단백질 수준을 조절 가능한 아미노산 서열의 조합 개념으로 질병의 진행이나 억제의 스위치 역할을 하는 단백질의 수명 조절 코드를 말한다.
연구팀은 이를 규명한 결과 기존 치료제가 접근할 수 없는 `기존에 약으로 만들지 못했던(Undruggable)' 신규 타깃의 정확도 높은 치료법 개발의 가능성을 열었다.
또한 연구팀은 신규 PTM 관련 코드를 다각화함으로 인해 단백질 분해 및 생성의 근본 원인을 알 수 없었던 기존의 신호 전달 체계에 PTM을 유도하거나 제거하는 효소의 역할을 재조명했다. 이번 연구를 통해 질병 관련 단백질 수명 변화 기원을 PTM 코드로 디지털화해서 미리 규명을 함으로써 그동안 단백질 수준을 마지막 단계에서 조절하는 *유비퀴틴 신호에만 집중했던 부분을 변경하도록 제안했다.
* 유비퀴틴: 단백질이 분해되기 전에 먼저 일어나는 대표적인 화학적 변화로 알려져 있으며 없어져야 할 단백질에 붙는 표지자로 널리 알려져 있음
우리 대학 의과학대학원 이지민 교수가 제1 저자로 초청돼 기고한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications, IF 17.69)' 에 지난 1월 13일 字 출판됐다. (논문명 : Control of protein stability by post-translational modifications).
이지민 교수는 "새롭게 제시한 PTM-활성화 또는 PTM-불활성화 데그론 코드의 규격화는 기존 약에 반응하지 않거나 저항성이 생기는 단백질 수준을 조절 가능한 다양한 질병 (대표적으로 암이나 퇴행성 뇌질환)의 진단 및 의약품 개발로 발전시킬 수 있을 것으로 기대된다ˮ 고 밝혔다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 리더연구사업,유럽분자생물학연구소 및 과학기술정보통신부 의사과학자양성사업의 지원을 받아 수행됐다.
2023.02.01 조회수 9249 질병 세포만 찾아 교정치료 가능한 유전자 가위 시스템 개발
우리 대학 의과학대학원 이지민 교수 연구팀이 한국과학기술연구원(KIST) 오승자 선임연구원, 강원대학교 이주용 교수와 공동 연구를 통해 질병 세포에서만 핵 내 유전자 교정을 수행할 수 있는 유전자 가위 시스템(CRISPR/Cas9)을 개발했다고 14일 밝혔다.
연구팀은 세포 내 마이크로RNA가 특정 서열을 인식해 절단한다는 특성을 활용해, 질병 세포에서 과발현되는 마이크로RNA에 의해 특이적으로 절단될 수 있는 링커를 연결한 유전자 가위 시스템을 설계했다. 이렇게 설계된 시스템은 질병 세포 특이적 마이크로RNA가 적은 정상세포에서는 세포질에 머물러 유전자 교정을 수행하지 않지만, 질병 세포에서는 링커가 절단되면서 유전자 가위가 세포핵으로 들어가 유전자 교정을 수행할 수 있다.
이러한 플랫폼은 유전자 가위를 질병 세포에서만 기능 할 수 있게 해 정상세포와 질병 세포가 혼합돼있는 실제 환자에게도 효과적인 유전자 교정 치료를 진행할 수 있을 것으로 기대된다.
KIST 신철희 박사와 우리 대학 의과학대학원 박수찬 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `뉴클레익 엑시드 리서치(Nucleic Acids Research, IF 16.971)' 온라인판에 지난달 30일 자 출판됐다. (논문명 : Cytosolic microRNA-inducible nuclear translocation of Cas9 protein for disease-specific genome modification).
마이크로RNA는 유전자를 전사 후 조절하는 19~24 뉴클레오티드(DNA나 RNA의 기본 단위) 길이의 RNA다. 마이크로RNA는 DNA로부터 전사된 메신저 RNA에 아르고너트(Argonaute; Ago) 단백질을 통해 결합하며, 결합한 메신저 RNA를 절단한다. 마이크로RNA의 비정상적인 발현이 다양한 질병에서 보고되고 있으며, 질병의 치료를 위한 표적 바이오마커로 많이 연구되고 있다.
다양한 질병에서 마이크로RNA를 표적으로 하는 치료법들이 빠르게 연구되고 있지만, 치료 물질의 전달 및 투여량의 문제, 세포 독성 및 비정상적 면역 반응 활성화 등의 문제가 있다.
유전자 가위 시스템은 단일 가이드 RNA(single guide RNA)를 조합해 정교한 유전자 교정을 수행하는 매우 효과적인 도구다. 하지만, 이 시스템의 실제 활용에는 기술적 한계들이 존재한다. 가장 큰 문제는 안정성 문제로, 표적 유전자가 아닌 다른 유전자를 편집하는 오프-타겟 이펙트(off-target effect)다. 또한, 다양한 세포가 혼합된 환경에서는 유전자 교정을 수행하기 어렵다.
연구팀은 이러한 문제를 해결하기 위해 질병 세포 본연의 생태를 활용하는 접근법을 고안했다. 연구팀은 핵 위치 신호(Nuclear localization signal; NLS)가 부착된 기존 유전자 가위(Cas9)에 핵 외 수송신호(Nuclear export signal; NES)를 연결한 질병 세포 마이크로RNA의 메신저 RNA 표적 서열을 결합한 유전자 가위를 제작했고, 이를 유전자 가위 `셀프 체크인'으로 명명했다.
연구팀은 인간 질병 세포에서 과발현되는 마이크로RNA-21의 표적 서열과 실험용 쥐의 마이크로RNA-294의 표적 서열을 연결한 유전자 가위의 인간 질병 세포 내 유전자 교정 기능을 비교했고, 마이크로RNA-21 표적 서열 연결 유전자 가위만이 세포 내 마이크로RNA-21에 의해 절단돼 핵까지 전달되어 기능을 수행할 수 있음을 확인했다.
연구팀은 다양한 폐암 세포에서 마이크로RNA-21의 발현량과 발암 단백질 Ezh2가 양의 상관관계가 있다는 것을 증명했고, `셀프 체크인'을 적용해 마이크로RNA-21이 과발현된 폐암 세포에서 발암 유전자 Ezh2의 유전자 교정을 성공적으로 수행했다.
또한, 암세포는 항암 약물에 지속해서 노출되게 되면, 약물 저항성을 획득하게 되는데, 연구팀은 폐암 세포에서 마이크로RNA-21과 Ezh2의 발현이 항암 약물 시스플라틴을 투여하면 오히려 증가함을 확인했다. 유전자 가위 셀프 체크인 기술을 통한 Ezh2 유전자 교정과 항암제(시스플라틴)의 병행 사용은 폐암 세포의 성장을 더욱 효과적으로 억제할 수 있음을 마우스 실험을 통해서 밝혔다.
연구팀이 개발한 유전자 가위 셀프 체크인 기술은 질병 세포에서만 기능하기 때문에, 오프-타겟 이펙트를 최소화할 수 있다는 장점이 있으며, 세포 내 시스템을 활용한다는 점에서 안정성이 높다고 할 수 있다. 또한, 단일 가이드 RNA 및 메신저 RNA 표적 서열을 상황에 맞게 교체해 사용할 수 있어, 다양한 질병에 적용이 가능할 것으로 기대된다.
연구팀은 "유전자 가위 셀프 체크인 기술은 기존 유전자 가위 시스템의 문제를 개선해, 높은 특이성을 가지고 질병 세포에 대한 유전자를 세포 특이적으로 교정할 수 있다는 것을 확인할 수 있다ˮ 라며 "다양한 질병 연관 마이크로RNA에 대응해 기술을 적용할 수 있을 것이다ˮ 라고 전했다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 이공분야기초연구사업 및 한국과학기술연구원 지원을 받아 수행됐다.
2022.06.14 조회수 15606
질병 세포만 찾아 교정치료 가능한 유전자 가위 시스템 개발
우리 대학 의과학대학원 이지민 교수 연구팀이 한국과학기술연구원(KIST) 오승자 선임연구원, 강원대학교 이주용 교수와 공동 연구를 통해 질병 세포에서만 핵 내 유전자 교정을 수행할 수 있는 유전자 가위 시스템(CRISPR/Cas9)을 개발했다고 14일 밝혔다.
연구팀은 세포 내 마이크로RNA가 특정 서열을 인식해 절단한다는 특성을 활용해, 질병 세포에서 과발현되는 마이크로RNA에 의해 특이적으로 절단될 수 있는 링커를 연결한 유전자 가위 시스템을 설계했다. 이렇게 설계된 시스템은 질병 세포 특이적 마이크로RNA가 적은 정상세포에서는 세포질에 머물러 유전자 교정을 수행하지 않지만, 질병 세포에서는 링커가 절단되면서 유전자 가위가 세포핵으로 들어가 유전자 교정을 수행할 수 있다.
이러한 플랫폼은 유전자 가위를 질병 세포에서만 기능 할 수 있게 해 정상세포와 질병 세포가 혼합돼있는 실제 환자에게도 효과적인 유전자 교정 치료를 진행할 수 있을 것으로 기대된다.
KIST 신철희 박사와 우리 대학 의과학대학원 박수찬 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `뉴클레익 엑시드 리서치(Nucleic Acids Research, IF 16.971)' 온라인판에 지난달 30일 자 출판됐다. (논문명 : Cytosolic microRNA-inducible nuclear translocation of Cas9 protein for disease-specific genome modification).
마이크로RNA는 유전자를 전사 후 조절하는 19~24 뉴클레오티드(DNA나 RNA의 기본 단위) 길이의 RNA다. 마이크로RNA는 DNA로부터 전사된 메신저 RNA에 아르고너트(Argonaute; Ago) 단백질을 통해 결합하며, 결합한 메신저 RNA를 절단한다. 마이크로RNA의 비정상적인 발현이 다양한 질병에서 보고되고 있으며, 질병의 치료를 위한 표적 바이오마커로 많이 연구되고 있다.
다양한 질병에서 마이크로RNA를 표적으로 하는 치료법들이 빠르게 연구되고 있지만, 치료 물질의 전달 및 투여량의 문제, 세포 독성 및 비정상적 면역 반응 활성화 등의 문제가 있다.
유전자 가위 시스템은 단일 가이드 RNA(single guide RNA)를 조합해 정교한 유전자 교정을 수행하는 매우 효과적인 도구다. 하지만, 이 시스템의 실제 활용에는 기술적 한계들이 존재한다. 가장 큰 문제는 안정성 문제로, 표적 유전자가 아닌 다른 유전자를 편집하는 오프-타겟 이펙트(off-target effect)다. 또한, 다양한 세포가 혼합된 환경에서는 유전자 교정을 수행하기 어렵다.
연구팀은 이러한 문제를 해결하기 위해 질병 세포 본연의 생태를 활용하는 접근법을 고안했다. 연구팀은 핵 위치 신호(Nuclear localization signal; NLS)가 부착된 기존 유전자 가위(Cas9)에 핵 외 수송신호(Nuclear export signal; NES)를 연결한 질병 세포 마이크로RNA의 메신저 RNA 표적 서열을 결합한 유전자 가위를 제작했고, 이를 유전자 가위 `셀프 체크인'으로 명명했다.
연구팀은 인간 질병 세포에서 과발현되는 마이크로RNA-21의 표적 서열과 실험용 쥐의 마이크로RNA-294의 표적 서열을 연결한 유전자 가위의 인간 질병 세포 내 유전자 교정 기능을 비교했고, 마이크로RNA-21 표적 서열 연결 유전자 가위만이 세포 내 마이크로RNA-21에 의해 절단돼 핵까지 전달되어 기능을 수행할 수 있음을 확인했다.
연구팀은 다양한 폐암 세포에서 마이크로RNA-21의 발현량과 발암 단백질 Ezh2가 양의 상관관계가 있다는 것을 증명했고, `셀프 체크인'을 적용해 마이크로RNA-21이 과발현된 폐암 세포에서 발암 유전자 Ezh2의 유전자 교정을 성공적으로 수행했다.
또한, 암세포는 항암 약물에 지속해서 노출되게 되면, 약물 저항성을 획득하게 되는데, 연구팀은 폐암 세포에서 마이크로RNA-21과 Ezh2의 발현이 항암 약물 시스플라틴을 투여하면 오히려 증가함을 확인했다. 유전자 가위 셀프 체크인 기술을 통한 Ezh2 유전자 교정과 항암제(시스플라틴)의 병행 사용은 폐암 세포의 성장을 더욱 효과적으로 억제할 수 있음을 마우스 실험을 통해서 밝혔다.
연구팀이 개발한 유전자 가위 셀프 체크인 기술은 질병 세포에서만 기능하기 때문에, 오프-타겟 이펙트를 최소화할 수 있다는 장점이 있으며, 세포 내 시스템을 활용한다는 점에서 안정성이 높다고 할 수 있다. 또한, 단일 가이드 RNA 및 메신저 RNA 표적 서열을 상황에 맞게 교체해 사용할 수 있어, 다양한 질병에 적용이 가능할 것으로 기대된다.
연구팀은 "유전자 가위 셀프 체크인 기술은 기존 유전자 가위 시스템의 문제를 개선해, 높은 특이성을 가지고 질병 세포에 대한 유전자를 세포 특이적으로 교정할 수 있다는 것을 확인할 수 있다ˮ 라며 "다양한 질병 연관 마이크로RNA에 대응해 기술을 적용할 수 있을 것이다ˮ 라고 전했다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 이공분야기초연구사업 및 한국과학기술연구원 지원을 받아 수행됐다.
2022.06.14 조회수 15606 방관자 T세포에 의한 질병 발생 이론 발표
우리 대학 의과학대학원 신의철 교수, 이호영 박사, 정성주 대학원생이 감염질환에서 방관자 (bystander) T세포 활성화의 중요성을 강조하는 주제로 세계적인 면역학 권위지인 `네이처 이뮤놀로지(Nature Immunology)' 8월호에 초청 리뷰 논문을 게재했다고 31일 밝혔다.
인간 질병에서 방관자 T세포의 역할에 관한 연구를 세계적으로 선도하고 있는 신의철 교수 연구팀은 이번 리뷰 논문을 통해 다양한 감염질환에서 방관자 T세포의 역할과 이를 조절하는 기전들을 총체적으로 고찰하고 인간 질병 치료에 응용할 수 있는 미래 연구의 방향을 제시했다.
일반적으로 인체는 바이러스에 감염되면 항바이러스 작용을 하는 T세포가 활성화되어 질병으로부터의 회복을 촉진한다고 알려져 있다. 이때 특정 바이러스에 대응하는 T세포만 활성화되고 관련 없는 T세포들은 활성화되지 않는데, 이러한 현상을 선택적 면역반응이라고 한다. 선택적 면역반응은 T세포가 바이러스의 항원 펩타이드를 인식하면서 이뤄진다.
하지만 바이러스의 종류 및 환자의 면역 체계에 따라, 감염을 일으키는 바이러스와는 상관없는 T세포의 활성화가 일어나게 되는데 이를 방관자 T세포의 활성화라고 이야기한다. 방관자 T세포의 활성화는 바이러스 항원 펩타이드의 존재와는 상관없이 사이토카인(cytokine)에 의해 유발된다고 알려져 있다. 이러한 방관자 T세포의 활성화는 복잡한 감염 이력을 가진 사람의 면역반응을 더 정교하게 이해하기 위해 반드시 고려해야 하는 현상이다.
과거 신의철 교수 연구팀은 2010년대에 한국에서 유행했던 A형 간염 바이러스 감염환자에서 간세포가 심하게 파괴되는 원인으로 방관자 T세포의 활성화 현상을 새롭게 발견해 그 결과를 2018년 권위 있는 면역학 학술지 `이뮤니티(Immunity)'에 보고한 바 있다. 이는 인간 질병에서 방관자 T세포의 역할을 체계적으로 증명한 세계 첫 논문으로 인정받고 있다.
이후 연구팀은 관련 연구를 활발히 지속하며 더 상세한 기전들을 발견해왔다. 간 조직에 상주하며 방관자 활성화를 일으킬 수 있는 T세포를 조절하는 분자를 발견하여 2020년 국제적 학술지 `저널 오브 헤파톨로지 (Journal of Hepatology)'에 보고했고, 특수한 T세포인 점막연관 불변사슬 T세포(MAIT: Mucosal-associated invariant T)도 유사한 활성 과정을 거쳐 간 손상에 기여할 수 있음을 발견해 같은 해 동일 저널에 발표했다.
또한, 최근에는 활성화된 방관자 T세포들이 감염된 조직으로 이동하는데 필요한 세포이동 관련 기전을 발견하여 국제학술지 `셀 리포트 (Cell Reports)'에 보고한 바도 있다.
현재 연구팀은 방관자 T세포 활성화 특성 및 관련 기전을 바이러스 질환 그리고 종양질환에서 밝혀내는 후속 연구를 진행 중이다. 또한, 현재 전 세계적으로 유행 중인 코로나19 감염상황에서 방관자 T세포 활성화 및 역할에 관한 연구도 진행하고 있다.
신의철 교수 연구팀은 방관자 T세포 활성화 연구 분야를 개척하고 확장해 나가고 있는 공로를 인정받아 이번 초청 리뷰 논문을 게재하게 됐다.
이러한 그동안의 연구는 2014년부터 삼성미래기술육성재단의 지속적인 지원을 받아 수행될 수 있었다. 연구팀의 이번 리뷰 논문은 국제 면역학 저명 학술지인 네이처 이뮤놀로지 (Nature Immunology) 誌 8월 5일 字에 게재됐다(논문명: Significance of bystander T cell activation in microbial infection).
이번 연구의 제1 저자인 우리 대학 이호영 박사(박사후 연구원)는 "그동안 면역학계에서 그 중요성을 몰랐던 방관자 T세포 활성화 현상이 이번 리뷰 논문을 통해 크게 주목받기를 기대한다며, 앞으로 다양한 질병에서의 방관자 T세포의 역할 및 관련 기전들의 규명을 위해 노력하겠다ˮ고 말했다.
신의철 교수는 "한국에서 개척한 연구 분야가 국제 면역학계에서 인정을 받는 것이 기쁘다며, 방관자 T세포의 연구가 논문에서만 그치지 않고 신약개발의 단초가 되도록 노력하겠다ˮ 라고 말했다.
2021.09.01 조회수 11915
방관자 T세포에 의한 질병 발생 이론 발표
우리 대학 의과학대학원 신의철 교수, 이호영 박사, 정성주 대학원생이 감염질환에서 방관자 (bystander) T세포 활성화의 중요성을 강조하는 주제로 세계적인 면역학 권위지인 `네이처 이뮤놀로지(Nature Immunology)' 8월호에 초청 리뷰 논문을 게재했다고 31일 밝혔다.
인간 질병에서 방관자 T세포의 역할에 관한 연구를 세계적으로 선도하고 있는 신의철 교수 연구팀은 이번 리뷰 논문을 통해 다양한 감염질환에서 방관자 T세포의 역할과 이를 조절하는 기전들을 총체적으로 고찰하고 인간 질병 치료에 응용할 수 있는 미래 연구의 방향을 제시했다.
일반적으로 인체는 바이러스에 감염되면 항바이러스 작용을 하는 T세포가 활성화되어 질병으로부터의 회복을 촉진한다고 알려져 있다. 이때 특정 바이러스에 대응하는 T세포만 활성화되고 관련 없는 T세포들은 활성화되지 않는데, 이러한 현상을 선택적 면역반응이라고 한다. 선택적 면역반응은 T세포가 바이러스의 항원 펩타이드를 인식하면서 이뤄진다.
하지만 바이러스의 종류 및 환자의 면역 체계에 따라, 감염을 일으키는 바이러스와는 상관없는 T세포의 활성화가 일어나게 되는데 이를 방관자 T세포의 활성화라고 이야기한다. 방관자 T세포의 활성화는 바이러스 항원 펩타이드의 존재와는 상관없이 사이토카인(cytokine)에 의해 유발된다고 알려져 있다. 이러한 방관자 T세포의 활성화는 복잡한 감염 이력을 가진 사람의 면역반응을 더 정교하게 이해하기 위해 반드시 고려해야 하는 현상이다.
과거 신의철 교수 연구팀은 2010년대에 한국에서 유행했던 A형 간염 바이러스 감염환자에서 간세포가 심하게 파괴되는 원인으로 방관자 T세포의 활성화 현상을 새롭게 발견해 그 결과를 2018년 권위 있는 면역학 학술지 `이뮤니티(Immunity)'에 보고한 바 있다. 이는 인간 질병에서 방관자 T세포의 역할을 체계적으로 증명한 세계 첫 논문으로 인정받고 있다.
이후 연구팀은 관련 연구를 활발히 지속하며 더 상세한 기전들을 발견해왔다. 간 조직에 상주하며 방관자 활성화를 일으킬 수 있는 T세포를 조절하는 분자를 발견하여 2020년 국제적 학술지 `저널 오브 헤파톨로지 (Journal of Hepatology)'에 보고했고, 특수한 T세포인 점막연관 불변사슬 T세포(MAIT: Mucosal-associated invariant T)도 유사한 활성 과정을 거쳐 간 손상에 기여할 수 있음을 발견해 같은 해 동일 저널에 발표했다.
또한, 최근에는 활성화된 방관자 T세포들이 감염된 조직으로 이동하는데 필요한 세포이동 관련 기전을 발견하여 국제학술지 `셀 리포트 (Cell Reports)'에 보고한 바도 있다.
현재 연구팀은 방관자 T세포 활성화 특성 및 관련 기전을 바이러스 질환 그리고 종양질환에서 밝혀내는 후속 연구를 진행 중이다. 또한, 현재 전 세계적으로 유행 중인 코로나19 감염상황에서 방관자 T세포 활성화 및 역할에 관한 연구도 진행하고 있다.
신의철 교수 연구팀은 방관자 T세포 활성화 연구 분야를 개척하고 확장해 나가고 있는 공로를 인정받아 이번 초청 리뷰 논문을 게재하게 됐다.
이러한 그동안의 연구는 2014년부터 삼성미래기술육성재단의 지속적인 지원을 받아 수행될 수 있었다. 연구팀의 이번 리뷰 논문은 국제 면역학 저명 학술지인 네이처 이뮤놀로지 (Nature Immunology) 誌 8월 5일 字에 게재됐다(논문명: Significance of bystander T cell activation in microbial infection).
이번 연구의 제1 저자인 우리 대학 이호영 박사(박사후 연구원)는 "그동안 면역학계에서 그 중요성을 몰랐던 방관자 T세포 활성화 현상이 이번 리뷰 논문을 통해 크게 주목받기를 기대한다며, 앞으로 다양한 질병에서의 방관자 T세포의 역할 및 관련 기전들의 규명을 위해 노력하겠다ˮ고 말했다.
신의철 교수는 "한국에서 개척한 연구 분야가 국제 면역학계에서 인정을 받는 것이 기쁘다며, 방관자 T세포의 연구가 논문에서만 그치지 않고 신약개발의 단초가 되도록 노력하겠다ˮ 라고 말했다.
2021.09.01 조회수 11915 사람 3D 폐포 배양 기술로 코로나19 감염 기전을 규명하는 데 성공
우리 대학 연구진 포함 국내 연구진이 실험실에서 3차원으로 키운 사람의 폐포(허파꽈리)에 코로나19 바이러스를 배양해 감염 기전과 치료제 개발에 적용이 가능한 기술 개발에 성공했다.
국제 통계 사이트 월드오미터에 따르면 전 세계 누적 코로나바이러스감염증-19(이하 코로나19) 확진자 수는 25일 기준 4,331만 8,941명으로 지난 18일(4,030만 1,609명) 4,000만 명을 넘어선 후 일주일 만에 4,331만을 돌파하는 2차 대유행이 점차 현실화돼 가고 있다.
우리 대학 의과학대학원 주영석 교수 연구팀은 인간의 폐포 세포를 실험실에서 구현하는 3D 미니 장기기술을 개발하고 이를 활용해 코로나19 바이러스가 인간의 폐 세포를 파괴하는 과정을 정밀하게 규명하는 데 성공했다고 26일 밝혔다.
이번 연구는 영국 케임브리지대학 이주현 박사를 비롯해 국립보건연구원 국립감염병연구소 최병선 과장·기초과학연구원(IBS) 고규영 혈관연구단장(우리 대학 의과학대학원 교수)·서울대병원 김영태 교수와 우리 대학 교원창업기업인 ㈜지놈인사이트와 공동으로 진행됐다.
공동연구팀의 이번 연구 결과는 줄기세포 분야 세계적인 학술지 `Cell Stem Cell' 10월 22일 字 온라인판에 실렸다. (논문명: Three-dimensional human alveolar stem cell culture models reveal infection response to SARS-CoV-2)
정확한 질병 기전의 이해를 기반으로 치료제를 효과적으로 개발하기 위해서는 실험실에서 사용 가능한 인체를 모사한 모델 사용이 필수적이다. 코로나19 바이러스는 생쥐 모델에 감염시키기가 어렵고, 특히 실험실에서 사용할 수 있는 폐 세포 모델은 존재하지 않기 때문에 직접적인 감염 연구의 한계가 존재해왔다.
공동연구팀은 이런 문제를 해소하기 위해 지속적으로 배양이 가능한 3차원 인간 폐포 모델을 새롭게 정립했다. 이를 이용하면 실험실에서 사람의 폐 세포를 이용해 코로나19 바이러스 등 각종 호흡기 바이러스의 질병 기전을 연구할 수 있기 때문이다. 더 나가서 3차원 인간 폐포 모델은 약물 스크리닝 등 치료법 개발에도 직접적으로 응용할 수 있다는 장점이 있다.
공동연구팀은 폐암 등 사람의 수술 검사재료에서 확보되는 사람 폐 조직을 장기간 안정적으로 3차원 배양할 수 있는 조건을 알아내는 데 성공했다. 실험 결과, 3D 폐포는 코로나19 바이러스에 노출되면 6시간 내 급속한 바이러스 증식이 일어나 세포 감염이 완료됐으나, 이를 막기 위한 폐 세포의 선천 면역 반응 활성화에는 약 3일가량의 시간이 걸렸다.
이와 함께 하나의 코로나19 바이러스 입자는 하나의 세포를 감염시키는 데 충분하다는 사실을 알아냈다. 감염 3일째 공동연구팀은 세포 가운데 일부분이 고유의 기능을 급격히 상실한다는 사실도 확인했다.
공동 교신저자인 주영석 교수는 "이번에 개발한 3차원 인체 폐 배양 모델 규모를 확대한다면 코로나19 바이러스를 포함한 다양한 호흡기 바이러스의 감염 연구에 유용하게 사용될 것ˮ이라고 말했다.
주 교수는 이어 "동물이나 다른 장기 유래의 세포가 아닌 호흡기 바이러스의 표적 세포인 사람의 폐 세포를 직접적으로 질병 연구에 응용함으로써 효율적이고 정확한 기전 규명은 물론 치료제 개발에도 이용할 수 있다ˮ고 강조했다.
코로나19 바이러스 대응 기술개발을 위해서는 다양한 기관의 지원과 관련 연구자들의 협력 연구가 필수적이다. 공동연구팀의 이번 연구는 한국연구재단·질병관리청·기초과학연구원(IBS)·서울대학교 의과대학·유럽연구이사회(ERC)·서경배과학재단·휴먼프론티어과학재단의 지원을 받아 수행됐다.
2020.10.26 조회수 33450
사람 3D 폐포 배양 기술로 코로나19 감염 기전을 규명하는 데 성공
우리 대학 연구진 포함 국내 연구진이 실험실에서 3차원으로 키운 사람의 폐포(허파꽈리)에 코로나19 바이러스를 배양해 감염 기전과 치료제 개발에 적용이 가능한 기술 개발에 성공했다.
국제 통계 사이트 월드오미터에 따르면 전 세계 누적 코로나바이러스감염증-19(이하 코로나19) 확진자 수는 25일 기준 4,331만 8,941명으로 지난 18일(4,030만 1,609명) 4,000만 명을 넘어선 후 일주일 만에 4,331만을 돌파하는 2차 대유행이 점차 현실화돼 가고 있다.
우리 대학 의과학대학원 주영석 교수 연구팀은 인간의 폐포 세포를 실험실에서 구현하는 3D 미니 장기기술을 개발하고 이를 활용해 코로나19 바이러스가 인간의 폐 세포를 파괴하는 과정을 정밀하게 규명하는 데 성공했다고 26일 밝혔다.
이번 연구는 영국 케임브리지대학 이주현 박사를 비롯해 국립보건연구원 국립감염병연구소 최병선 과장·기초과학연구원(IBS) 고규영 혈관연구단장(우리 대학 의과학대학원 교수)·서울대병원 김영태 교수와 우리 대학 교원창업기업인 ㈜지놈인사이트와 공동으로 진행됐다.
공동연구팀의 이번 연구 결과는 줄기세포 분야 세계적인 학술지 `Cell Stem Cell' 10월 22일 字 온라인판에 실렸다. (논문명: Three-dimensional human alveolar stem cell culture models reveal infection response to SARS-CoV-2)
정확한 질병 기전의 이해를 기반으로 치료제를 효과적으로 개발하기 위해서는 실험실에서 사용 가능한 인체를 모사한 모델 사용이 필수적이다. 코로나19 바이러스는 생쥐 모델에 감염시키기가 어렵고, 특히 실험실에서 사용할 수 있는 폐 세포 모델은 존재하지 않기 때문에 직접적인 감염 연구의 한계가 존재해왔다.
공동연구팀은 이런 문제를 해소하기 위해 지속적으로 배양이 가능한 3차원 인간 폐포 모델을 새롭게 정립했다. 이를 이용하면 실험실에서 사람의 폐 세포를 이용해 코로나19 바이러스 등 각종 호흡기 바이러스의 질병 기전을 연구할 수 있기 때문이다. 더 나가서 3차원 인간 폐포 모델은 약물 스크리닝 등 치료법 개발에도 직접적으로 응용할 수 있다는 장점이 있다.
공동연구팀은 폐암 등 사람의 수술 검사재료에서 확보되는 사람 폐 조직을 장기간 안정적으로 3차원 배양할 수 있는 조건을 알아내는 데 성공했다. 실험 결과, 3D 폐포는 코로나19 바이러스에 노출되면 6시간 내 급속한 바이러스 증식이 일어나 세포 감염이 완료됐으나, 이를 막기 위한 폐 세포의 선천 면역 반응 활성화에는 약 3일가량의 시간이 걸렸다.
이와 함께 하나의 코로나19 바이러스 입자는 하나의 세포를 감염시키는 데 충분하다는 사실을 알아냈다. 감염 3일째 공동연구팀은 세포 가운데 일부분이 고유의 기능을 급격히 상실한다는 사실도 확인했다.
공동 교신저자인 주영석 교수는 "이번에 개발한 3차원 인체 폐 배양 모델 규모를 확대한다면 코로나19 바이러스를 포함한 다양한 호흡기 바이러스의 감염 연구에 유용하게 사용될 것ˮ이라고 말했다.
주 교수는 이어 "동물이나 다른 장기 유래의 세포가 아닌 호흡기 바이러스의 표적 세포인 사람의 폐 세포를 직접적으로 질병 연구에 응용함으로써 효율적이고 정확한 기전 규명은 물론 치료제 개발에도 이용할 수 있다ˮ고 강조했다.
코로나19 바이러스 대응 기술개발을 위해서는 다양한 기관의 지원과 관련 연구자들의 협력 연구가 필수적이다. 공동연구팀의 이번 연구는 한국연구재단·질병관리청·기초과학연구원(IBS)·서울대학교 의과대학·유럽연구이사회(ERC)·서경배과학재단·휴먼프론티어과학재단의 지원을 받아 수행됐다.
2020.10.26 조회수 33450 초음파를 내비게이션으로 사용하는 광학현미경 개발
생체 내부를 꿰뚫어볼 수 있는 새로운 현미경이 나왔다. 바이오 및 뇌공학과 장무석 교수 연구팀이 기초과학연구원 분자 분광학 및 동력학 연구단 최원식 부연구단장 연구팀과의 공동 연구를 통해 초음파를 이용해 기존 현미경으로 볼 수 없었던 생체 내부의 미세구조를 관찰하는 기법을 개발했다.
연구결과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)2월 5일자 온라인 판에 게재됐다.
사람의 눈은 250㎜ 떨어진 거리에 70㎜의 간격을 두고 놓인 물체를 구분할 수 있다. 이보다 작은 미세구조를 관찰하기 위해서는 광학현미경이 필요하다. 광학현미경은 눈으로 볼 수 없는 작은 미세구조를 확대해서 보여준다. 하지만 생체조직을 관찰할 때는 이야기가 달라진다.
빛이 생체 조직을 투과할 때 직진광과 산란광이라는 두 종류의 빛이 생겨난다. 직진광은 말 그대로 생체 조직의 영향 없이 직진하는 빛이며, 산란광은 생체 조직 내 세포나 세포 내 구조의 영향에 의해 진행 방향이 무작위로 굴절된 빛이다. 광학 현미경으로 생체 조직 깊은 곳을 관찰하려면 직진광에 비해 산란광이 강해져 이미지 정보가 흐려진다는 치명적인 단점이 있다. 안개 속을 볼 수 없듯, 생체 조직의 수많은 세포와 구조들이 빛을 산란시켜 이미지를 흐리게 만들기 때문이다. 반면, 초음파 영상은 태아를 감별할 수 있을 정도로 생체 내부 깊은 곳까지 이미징할 수 있지만, 해상도가 낮아 미세한 구조를 볼 수 없다는 단점이 있다.
연구진은 광학 현미경과 초음파 영상의 장점을 결합하여, 생체 내부 깊은 곳을 높은 해상도로 관찰할 수 있는 초음파 결합 광학 현미경을 개발했다. 초음파 결합 현미경은 생체 조직 내부를 잘 침투하는 초음파를 집속시킨 후, 초음파의 초점을 지나는 빛만 측정하는 방식으로 산란광의 세기를 크게 감쇄시킬 수 있다. 초음파가 광학현미경에게 관찰 경로를 알려주는 일종의 내비게이션 역할을 하는 셈이다.
초음파는 생체 조직을 응축, 팽창시켜 굴절률을 변조하는 방식으로 빛의 진행에 영향을 준다. 연구진은 이런 초음파의 특성을 응용해 초음파의 초점을 통과하는 빛만을 선택적으로 측정하는 기술을 개발하고, 이 기술을 공간 게이팅(space-gating)이라 명명했다. 초음파는 생체 내부의 ‘빛 거름망’ 역할을 하며 무작위로 산란되던 빛을 차폐한다. 공간 게이팅 기술을 통해 연구진은 산란광을 100배 이상 감쇄시키며 생체 조직 내에서 광학 이미지가 흐려지는 문제를 극복할 수 있었다.
장무석 교수는 “촘촘한 거름망을 사용하면 더 고운 가루만 남는 것처럼 초음파의 초점을 작게 할수록 산란광을 더 많이 감쇄시킬 수 있다”며 “향후 산란광을 1000~1만 배 수준까지 감쇄시켜 더 선명한 이미지를 얻게 될 것으로 기대한다”고 말했다.
연구진은 개발한 현미경을 이용해 별도의 형광 표지 없이 부화한지 30일 된 성체 제브라피시의 척추 안쪽 근육 조직 이미지를 얻는데 성공했다. 기존 기술은 제브라피시의 장기, 척추 등 내부 구조에서 산란 현상이 일어나 절단을 통해서만 내부 근육 결을 관찰할 수 있었다. 이와 달리 개발된 현미경은 자연 상태 그대로 살아있는 제브라피쉬 내부 조직을 꿰뚫어볼 수 있다.
연구진은 인체 조직에도 사용할 수 있는 공간 게이팅 기술을 구현해나갈 계획이다. 향후 현미경을 소형화하고 이미징 속도를 증가시키면, 실시간 질병 진단에도 응용할 수 있을 것으로 기대된다. 이번 연구를 이끈 최원식 부연구단장은 “초음파 결합 광학 현미경은 기존 광학 현미경의 얕은 이미징 깊이 문제를 해결하는 획기적인 기술”이라며 “공간 게이팅 기술을 더욱 발전시켜 빛의 산란 현상을 이해하고, 의생명 광학 기술 분야 활용 범위를 넓혀나갈 것”이라고 말했다.
2020.02.21 조회수 15695
초음파를 내비게이션으로 사용하는 광학현미경 개발
생체 내부를 꿰뚫어볼 수 있는 새로운 현미경이 나왔다. 바이오 및 뇌공학과 장무석 교수 연구팀이 기초과학연구원 분자 분광학 및 동력학 연구단 최원식 부연구단장 연구팀과의 공동 연구를 통해 초음파를 이용해 기존 현미경으로 볼 수 없었던 생체 내부의 미세구조를 관찰하는 기법을 개발했다.
연구결과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)2월 5일자 온라인 판에 게재됐다.
사람의 눈은 250㎜ 떨어진 거리에 70㎜의 간격을 두고 놓인 물체를 구분할 수 있다. 이보다 작은 미세구조를 관찰하기 위해서는 광학현미경이 필요하다. 광학현미경은 눈으로 볼 수 없는 작은 미세구조를 확대해서 보여준다. 하지만 생체조직을 관찰할 때는 이야기가 달라진다.
빛이 생체 조직을 투과할 때 직진광과 산란광이라는 두 종류의 빛이 생겨난다. 직진광은 말 그대로 생체 조직의 영향 없이 직진하는 빛이며, 산란광은 생체 조직 내 세포나 세포 내 구조의 영향에 의해 진행 방향이 무작위로 굴절된 빛이다. 광학 현미경으로 생체 조직 깊은 곳을 관찰하려면 직진광에 비해 산란광이 강해져 이미지 정보가 흐려진다는 치명적인 단점이 있다. 안개 속을 볼 수 없듯, 생체 조직의 수많은 세포와 구조들이 빛을 산란시켜 이미지를 흐리게 만들기 때문이다. 반면, 초음파 영상은 태아를 감별할 수 있을 정도로 생체 내부 깊은 곳까지 이미징할 수 있지만, 해상도가 낮아 미세한 구조를 볼 수 없다는 단점이 있다.
연구진은 광학 현미경과 초음파 영상의 장점을 결합하여, 생체 내부 깊은 곳을 높은 해상도로 관찰할 수 있는 초음파 결합 광학 현미경을 개발했다. 초음파 결합 현미경은 생체 조직 내부를 잘 침투하는 초음파를 집속시킨 후, 초음파의 초점을 지나는 빛만 측정하는 방식으로 산란광의 세기를 크게 감쇄시킬 수 있다. 초음파가 광학현미경에게 관찰 경로를 알려주는 일종의 내비게이션 역할을 하는 셈이다.
초음파는 생체 조직을 응축, 팽창시켜 굴절률을 변조하는 방식으로 빛의 진행에 영향을 준다. 연구진은 이런 초음파의 특성을 응용해 초음파의 초점을 통과하는 빛만을 선택적으로 측정하는 기술을 개발하고, 이 기술을 공간 게이팅(space-gating)이라 명명했다. 초음파는 생체 내부의 ‘빛 거름망’ 역할을 하며 무작위로 산란되던 빛을 차폐한다. 공간 게이팅 기술을 통해 연구진은 산란광을 100배 이상 감쇄시키며 생체 조직 내에서 광학 이미지가 흐려지는 문제를 극복할 수 있었다.
장무석 교수는 “촘촘한 거름망을 사용하면 더 고운 가루만 남는 것처럼 초음파의 초점을 작게 할수록 산란광을 더 많이 감쇄시킬 수 있다”며 “향후 산란광을 1000~1만 배 수준까지 감쇄시켜 더 선명한 이미지를 얻게 될 것으로 기대한다”고 말했다.
연구진은 개발한 현미경을 이용해 별도의 형광 표지 없이 부화한지 30일 된 성체 제브라피시의 척추 안쪽 근육 조직 이미지를 얻는데 성공했다. 기존 기술은 제브라피시의 장기, 척추 등 내부 구조에서 산란 현상이 일어나 절단을 통해서만 내부 근육 결을 관찰할 수 있었다. 이와 달리 개발된 현미경은 자연 상태 그대로 살아있는 제브라피쉬 내부 조직을 꿰뚫어볼 수 있다.
연구진은 인체 조직에도 사용할 수 있는 공간 게이팅 기술을 구현해나갈 계획이다. 향후 현미경을 소형화하고 이미징 속도를 증가시키면, 실시간 질병 진단에도 응용할 수 있을 것으로 기대된다. 이번 연구를 이끈 최원식 부연구단장은 “초음파 결합 광학 현미경은 기존 광학 현미경의 얕은 이미징 깊이 문제를 해결하는 획기적인 기술”이라며 “공간 게이팅 기술을 더욱 발전시켜 빛의 산란 현상을 이해하고, 의생명 광학 기술 분야 활용 범위를 넓혀나갈 것”이라고 말했다.
2020.02.21 조회수 15695 김일두 교수, 동물 단백질 촉매로 활용한 질병진단센서 개발
〈 김 일 두 교수 〉
우리 대학 신소재공학과 김일두 교수 연구팀이 동물의 단백질을 촉매로 활용해 호흡으로 질병을 진단할 수 있는 센서를 개발했다.
이는 사람의 날숨에 포함된 다양한 질병과 관련된 바이오마커 가스들에 대한 패턴 인식을 통해 질병을 조기 모니터링 할 수 있는 기술이다.
이번 기술은 다양한 단일 금속입자 뿐만 아니라 어떠한 조합의 이종입자도 2 nm 크기로 합성할 수 있는 장점을 갖는다. 연구팀은 기존에도 호흡으로 질병을 진단하는 센서를 개발했으나 이번 기술은 더욱 정확하고 높은 감도를 갖는다는 특징이 있다.
김상준, 최선진 박사가 1저자로 참여한 이번 연구 결과는 미국 화학회의 화학분야 국제 학술지 ‘어카운트 오브 케미칼 리서치(Accounts of Chemical Research)’ 7월호 표지논문으로 선정됐고, 독일 와일리 국제 학술지인 ‘어드밴스드 머터리얼즈(Advanced Materials)’에도 게재가 확정됐다.
혈액 체취나 영상 촬영 없이 내뱉는 숨(호기)만으로 각종 질병 여부를 파악하는 호흡 지문 센서 기술은 핵심 미래 기술이다. 호기 속 특정 가스들의 농도변화를 체크해 건강 이상 여부를 판단할 수 있다.
호기가스 성분에는 수분 외에도 수소, 아세톤, 톨루엔, 암모니아, 황화수소, 일산화질소 등이 포함된다. 이 가스들은 천식, 폐암, 1형 당뇨병, 구취 등 특정 질병 환자에게서 높은 농도로 배출되는 바이오마커 가스이다.
호흡을 이용한 질병 진단은 마치 음주측정기처럼 테들라(Tedlar) 백에 포집된 날숨 가스를 소형 센서 장치로 주입한 후 빠른 속도로 분석되기 때문에 쉽고 간편하게 질병을 진단할 수 있다. 또한 질병 대사가 일어나는 시점에서 검출이 가능해 조기 진단이 가능하다.
하지만 매우 경미한 수준인 10억분의 1(ppb)에서 100만분의 1(ppm) 수준으로 발생하는 가스를 호흡 속에서 정확히 분석하기 위해서는 기술의 진보가 필요하다. 특히 수분을 포함한 수백 종의 방해 가스는 특정 질병 관련 바이오마커 가스를 선택적으로 분석하는 저항 변화식 센서의 취약점으로 남아 있다.
기존의 가스 센서는 백금, 팔라듐 등 특정 촉매를 결합해 감지 특성을 높이려고 시도했으나 ppb 농도에서는 생체지표 가스 감지 특성이 높지 않다는 한계가 있었다.
연구팀은 기존 센서의 한계 극복을 위해 동물의 조직에 존재하는 나노크기의 단백질을 희생층으로 이용해 속이 비어있는 단백질 껍질 안에 석출된 이종촉매(Heterogeneous catalyst) 입자를 합성하는데 성공했다.
이번 연구에 사용된 나노크기의 단백질은 주기율표에 존재하는 원소물질을 조합해 어떠한 형태의 이종촉매도 다양하게 구현할 수 있다는 큰 장점을 갖는다.
특히 이종 원소간 조성비를 쉽게 조절할 수 있고 금속간화합물도 제조할 수 있어 신조성을 갖는 촉매 합성 측면에서 매우 획기적인 방법이다.
예를 들어 백금이 기준 촉매일 때 백금팔라듐(PtPd), 백금니켈(PtNi), 백금루테늄(PdRu), 백금이트륨(PtY3) 등 다양한 이종 합금촉매로 확장할 수 있다.
연구팀은 개발된 이종촉매 입자를 넓은 비표면적과 다공성 구조를 갖는 금속산화물 나노섬유에 결착시켜 특정 생체지표 기체에만 선택적으로 반응하는 감지소재를 개발했다. 이종촉매가 결착된 나노섬유 센서는 기존에 촉매 활성이 가장 뛰어나다고 알려진 백금이나 팔라듐 촉매보다 약 3~4배 이상 감지 특성이 향상됨을 확인했다.
특히 아세톤이나 황화수소 가스는 1ppm에서 감도가 100배 수준으로 바뀌는 최고 수준의 감도 특성이 관찰됐다.
연구팀은 다양한 종류의 감지 소재가 적용된 복합 센서 배치(sensor array) 시스템을 이용해 사람의 지문을 인식하듯 개개인의 호흡을 패턴 인식해 일반인도 쉽게 건강 이상을 판별할 수 있는 질병진단 플랫폼을 개발했다.
16종의 다른 선택성을 갖는 센서를 어레이화하는데 성공했으며, 환자의 건강상태에 따라 날숨 농도변화가 다르게 나타나기 때문에 날숨 속 가스 정보를 지문처럼 패턴화하여 개인의 건강 변화를 지속적으로 모니터링 하는 헬스케어 기기에 적용할 수 있다.
김 교수는 “기존에 센서에 사용된 적이 없는 2 nm 크기의 이종촉매를 단백질을 이용하여 적용함으로써, 질병과 연관된 생체지표 가스에 고감도 및 고 선택성으로 반응하는 센서소재 라이브러리를 구현할 수 있다”며 “앞으로 다양한 촉매 군을 확보하면 수많은 질병을 진단할 수 있는 센서를 개발할 수 있다”고 말했다.
또한 “호흡으로 질병을 진단하는 센서는 누구나 손쉽게 스스로 진단할 수 있는 자가 진단 기기의 시작으로 의료비 지출 상승을 막고 지속적 건강관리에 큰 도움이 될 것이다”고 말했다.
이번 기술과 관련된 특허들은 지난 3월과 6월 각각 벤처기업과 중소기업에 기술이전 됐다.
본 연구는 미래창조 과학부 웨어러블 플랫폼소재 기술센터 과제와 바이오의료기술개발사업 과제의 지원으로 이루어졌다.
□ 그림 설명
그림1. 어카운트 오브 케미칼 리서치 표지 이미지
그림2. 다종 입자 촉매
그림3. 함금촉매 합성
그림4. 다종센서 어레이_날숨 분석 센서
2017.07.18 조회수 35336
김일두 교수, 동물 단백질 촉매로 활용한 질병진단센서 개발
〈 김 일 두 교수 〉
우리 대학 신소재공학과 김일두 교수 연구팀이 동물의 단백질을 촉매로 활용해 호흡으로 질병을 진단할 수 있는 센서를 개발했다.
이는 사람의 날숨에 포함된 다양한 질병과 관련된 바이오마커 가스들에 대한 패턴 인식을 통해 질병을 조기 모니터링 할 수 있는 기술이다.
이번 기술은 다양한 단일 금속입자 뿐만 아니라 어떠한 조합의 이종입자도 2 nm 크기로 합성할 수 있는 장점을 갖는다. 연구팀은 기존에도 호흡으로 질병을 진단하는 센서를 개발했으나 이번 기술은 더욱 정확하고 높은 감도를 갖는다는 특징이 있다.
김상준, 최선진 박사가 1저자로 참여한 이번 연구 결과는 미국 화학회의 화학분야 국제 학술지 ‘어카운트 오브 케미칼 리서치(Accounts of Chemical Research)’ 7월호 표지논문으로 선정됐고, 독일 와일리 국제 학술지인 ‘어드밴스드 머터리얼즈(Advanced Materials)’에도 게재가 확정됐다.
혈액 체취나 영상 촬영 없이 내뱉는 숨(호기)만으로 각종 질병 여부를 파악하는 호흡 지문 센서 기술은 핵심 미래 기술이다. 호기 속 특정 가스들의 농도변화를 체크해 건강 이상 여부를 판단할 수 있다.
호기가스 성분에는 수분 외에도 수소, 아세톤, 톨루엔, 암모니아, 황화수소, 일산화질소 등이 포함된다. 이 가스들은 천식, 폐암, 1형 당뇨병, 구취 등 특정 질병 환자에게서 높은 농도로 배출되는 바이오마커 가스이다.
호흡을 이용한 질병 진단은 마치 음주측정기처럼 테들라(Tedlar) 백에 포집된 날숨 가스를 소형 센서 장치로 주입한 후 빠른 속도로 분석되기 때문에 쉽고 간편하게 질병을 진단할 수 있다. 또한 질병 대사가 일어나는 시점에서 검출이 가능해 조기 진단이 가능하다.
하지만 매우 경미한 수준인 10억분의 1(ppb)에서 100만분의 1(ppm) 수준으로 발생하는 가스를 호흡 속에서 정확히 분석하기 위해서는 기술의 진보가 필요하다. 특히 수분을 포함한 수백 종의 방해 가스는 특정 질병 관련 바이오마커 가스를 선택적으로 분석하는 저항 변화식 센서의 취약점으로 남아 있다.
기존의 가스 센서는 백금, 팔라듐 등 특정 촉매를 결합해 감지 특성을 높이려고 시도했으나 ppb 농도에서는 생체지표 가스 감지 특성이 높지 않다는 한계가 있었다.
연구팀은 기존 센서의 한계 극복을 위해 동물의 조직에 존재하는 나노크기의 단백질을 희생층으로 이용해 속이 비어있는 단백질 껍질 안에 석출된 이종촉매(Heterogeneous catalyst) 입자를 합성하는데 성공했다.
이번 연구에 사용된 나노크기의 단백질은 주기율표에 존재하는 원소물질을 조합해 어떠한 형태의 이종촉매도 다양하게 구현할 수 있다는 큰 장점을 갖는다.
특히 이종 원소간 조성비를 쉽게 조절할 수 있고 금속간화합물도 제조할 수 있어 신조성을 갖는 촉매 합성 측면에서 매우 획기적인 방법이다.
예를 들어 백금이 기준 촉매일 때 백금팔라듐(PtPd), 백금니켈(PtNi), 백금루테늄(PdRu), 백금이트륨(PtY3) 등 다양한 이종 합금촉매로 확장할 수 있다.
연구팀은 개발된 이종촉매 입자를 넓은 비표면적과 다공성 구조를 갖는 금속산화물 나노섬유에 결착시켜 특정 생체지표 기체에만 선택적으로 반응하는 감지소재를 개발했다. 이종촉매가 결착된 나노섬유 센서는 기존에 촉매 활성이 가장 뛰어나다고 알려진 백금이나 팔라듐 촉매보다 약 3~4배 이상 감지 특성이 향상됨을 확인했다.
특히 아세톤이나 황화수소 가스는 1ppm에서 감도가 100배 수준으로 바뀌는 최고 수준의 감도 특성이 관찰됐다.
연구팀은 다양한 종류의 감지 소재가 적용된 복합 센서 배치(sensor array) 시스템을 이용해 사람의 지문을 인식하듯 개개인의 호흡을 패턴 인식해 일반인도 쉽게 건강 이상을 판별할 수 있는 질병진단 플랫폼을 개발했다.
16종의 다른 선택성을 갖는 센서를 어레이화하는데 성공했으며, 환자의 건강상태에 따라 날숨 농도변화가 다르게 나타나기 때문에 날숨 속 가스 정보를 지문처럼 패턴화하여 개인의 건강 변화를 지속적으로 모니터링 하는 헬스케어 기기에 적용할 수 있다.
김 교수는 “기존에 센서에 사용된 적이 없는 2 nm 크기의 이종촉매를 단백질을 이용하여 적용함으로써, 질병과 연관된 생체지표 가스에 고감도 및 고 선택성으로 반응하는 센서소재 라이브러리를 구현할 수 있다”며 “앞으로 다양한 촉매 군을 확보하면 수많은 질병을 진단할 수 있는 센서를 개발할 수 있다”고 말했다.
또한 “호흡으로 질병을 진단하는 센서는 누구나 손쉽게 스스로 진단할 수 있는 자가 진단 기기의 시작으로 의료비 지출 상승을 막고 지속적 건강관리에 큰 도움이 될 것이다”고 말했다.
이번 기술과 관련된 특허들은 지난 3월과 6월 각각 벤처기업과 중소기업에 기술이전 됐다.
본 연구는 미래창조 과학부 웨어러블 플랫폼소재 기술센터 과제와 바이오의료기술개발사업 과제의 지원으로 이루어졌다.
□ 그림 설명
그림1. 어카운트 오브 케미칼 리서치 표지 이미지
그림2. 다종 입자 촉매
그림3. 함금촉매 합성
그림4. 다종센서 어레이_날숨 분석 센서
2017.07.18 조회수 35336 김일두 교수, 호흡으로 폐암, 당뇨 조기 진단하는 초소형 센서 개발
혈액 체취나 영상촬영을 하지 않고도 사람의 호흡만으로 폐암, 당뇨 등 각종 질병을 실시간으로 파악할 수 있는 초소형 감지 센서 기술이 개발됐다.
우리 대학 신소재공학과 김일두 교수신소재공학과 연구팀은 사람의 호흡 내에 질병과 관련된 극미량의 특정 가스의 농도를 실시간으로 정확하게 분석할 수 있는 세계 최고 수준의 고감도·초소형 센서를 개발하였다고 밝혔다.
이를 통해, 현재 병원에서 혈액 체취나 조직 검사, MRI 등을 통해 고비용으로 진단하고 있는 폐암이나 당뇨 등의 질병을 개인 스마트폰이나 웨어러블 장치를 통해 수시로 저렴하게 진단할 수 있는 길을 열었다.
사람이 숨을 쉬면서 내뱉는 호흡 속 가스 성분 중에는 다양한 휘발성 유기화합물 가스들이 포함되어 있으며, 이중 일부 가스는 질병과 밀접한 연관이 있는 것으로 알려져 있다.
대표적으로 아세톤, 톨루엔, 황화수소 가스는 각각 당뇨병, 폐암, 구취 환자에서 더 높은 농도로 배출되며, 이러한 호흡 속 특정 가스의 농도를 정확하게 분석할 수 있다면 여러 질병들을 간편한 방법으로 조기에 진단할 수 있다.
그러나, 입안에는 수분을 포함하여 수백 종의 가스들이 존재하기 때문에, 그간 개발된 센서는 사람 호흡 속에 포함되어 있는 극미량(10 – 2,000ppb)의 특정 가스를 선택적으로 검출하는데 한계가 있었다.
연구팀은 수백 종의 가스 중 질병과 관련된 특정 가스만 선택적으로 탁월하게 검출할 수 있는 고성능 촉매를 개발하였으며, 이를 나노 섬유 형상의 센서 소재에 적용하여 개인 스마트폰과 연동이 가능한 초소형·고감도 질병 진단 센서를 구현하는데 성공하였다.
김일두 교수는 “질병 진단 센서는 차량이나 모바일 기기 등에 활용하여 개인 질병을 지속적으로 모니터링 할 수 있을 뿐만 아니라, 향후 대기 오염 분석, 실내 공기질 분석 등 가스 센서와 관련된 산업분야에서 사물인터넷(IoT) 제품과 융합되어 새로운 시장을 창출할 것으로 기대된다.”라고 연구의의를 밝혔다.
이번 연구는 김일두 교수 외 최선진·김상준 연구원이 주도하였고, 미래창조과학부 글로벌프런티어사업(스마트 IT 융합시스템 연구단)의 지원으로 수행되었다.
연구 결과는 재료과학분야 세계적 국제학술지인 ‘스몰(small)’ 표지논문에 2월 17일(수) 게제 되었으며, 관련 특허는 국내기업에 기술이전 되어 향후 조기 상용화가 이뤄질 것으로 기대된다.
□ 그림 설명
그림1. 스마트폰과 연결된 호기가스 분석 센서 및 호흡지문 패턴 인식을 통한 질병 진단
그림2. 동글 타입(Dongle-type), 패치 타입(Patch-type), 및 시계 타입(Watch-type) 센서 모듈을 이용한 휴대형, 실시간 호기가스 분석 센서
그림3. 'small' 표지에 게재된 논문
2016.03.07 조회수 22278
김일두 교수, 호흡으로 폐암, 당뇨 조기 진단하는 초소형 센서 개발
혈액 체취나 영상촬영을 하지 않고도 사람의 호흡만으로 폐암, 당뇨 등 각종 질병을 실시간으로 파악할 수 있는 초소형 감지 센서 기술이 개발됐다.
우리 대학 신소재공학과 김일두 교수신소재공학과 연구팀은 사람의 호흡 내에 질병과 관련된 극미량의 특정 가스의 농도를 실시간으로 정확하게 분석할 수 있는 세계 최고 수준의 고감도·초소형 센서를 개발하였다고 밝혔다.
이를 통해, 현재 병원에서 혈액 체취나 조직 검사, MRI 등을 통해 고비용으로 진단하고 있는 폐암이나 당뇨 등의 질병을 개인 스마트폰이나 웨어러블 장치를 통해 수시로 저렴하게 진단할 수 있는 길을 열었다.
사람이 숨을 쉬면서 내뱉는 호흡 속 가스 성분 중에는 다양한 휘발성 유기화합물 가스들이 포함되어 있으며, 이중 일부 가스는 질병과 밀접한 연관이 있는 것으로 알려져 있다.
대표적으로 아세톤, 톨루엔, 황화수소 가스는 각각 당뇨병, 폐암, 구취 환자에서 더 높은 농도로 배출되며, 이러한 호흡 속 특정 가스의 농도를 정확하게 분석할 수 있다면 여러 질병들을 간편한 방법으로 조기에 진단할 수 있다.
그러나, 입안에는 수분을 포함하여 수백 종의 가스들이 존재하기 때문에, 그간 개발된 센서는 사람 호흡 속에 포함되어 있는 극미량(10 – 2,000ppb)의 특정 가스를 선택적으로 검출하는데 한계가 있었다.
연구팀은 수백 종의 가스 중 질병과 관련된 특정 가스만 선택적으로 탁월하게 검출할 수 있는 고성능 촉매를 개발하였으며, 이를 나노 섬유 형상의 센서 소재에 적용하여 개인 스마트폰과 연동이 가능한 초소형·고감도 질병 진단 센서를 구현하는데 성공하였다.
김일두 교수는 “질병 진단 센서는 차량이나 모바일 기기 등에 활용하여 개인 질병을 지속적으로 모니터링 할 수 있을 뿐만 아니라, 향후 대기 오염 분석, 실내 공기질 분석 등 가스 센서와 관련된 산업분야에서 사물인터넷(IoT) 제품과 융합되어 새로운 시장을 창출할 것으로 기대된다.”라고 연구의의를 밝혔다.
이번 연구는 김일두 교수 외 최선진·김상준 연구원이 주도하였고, 미래창조과학부 글로벌프런티어사업(스마트 IT 융합시스템 연구단)의 지원으로 수행되었다.
연구 결과는 재료과학분야 세계적 국제학술지인 ‘스몰(small)’ 표지논문에 2월 17일(수) 게제 되었으며, 관련 특허는 국내기업에 기술이전 되어 향후 조기 상용화가 이뤄질 것으로 기대된다.
□ 그림 설명
그림1. 스마트폰과 연결된 호기가스 분석 센서 및 호흡지문 패턴 인식을 통한 질병 진단
그림2. 동글 타입(Dongle-type), 패치 타입(Patch-type), 및 시계 타입(Watch-type) 센서 모듈을 이용한 휴대형, 실시간 호기가스 분석 센서
그림3. 'small' 표지에 게재된 논문
2016.03.07 조회수 22278 단백질 분해조절 효소 정보 담은 바이오마커 발굴 시스템 개발
- Mol Cell Proteomics지 게재, “바이오마커 개발의 새로운 패러다임 제시” -
단백질의 분해를 조절하는 효소와 기질에 대한 관계정보를 담은 바이오마커* 발굴 시스템(E3Net)이 국내 연구진에 의해 개발되어, 고부가가치의 새로운 바이오마커 개발에 가능성이 열렸다.
※ 바이오마커(Biomarker) : 유전자, 단백질 등에서 유래된 특이한 패턴의 분자적 정보로, 유전적․후천적 영향으로 발생한 신체의 변화를 감지할 수 있는 생물표지인자
우리학교 바이오및뇍 이관수 교수(49세)가 주도하고, 한영웅 박사과정생, 이호동 박사 및 박종철 교수가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 선도연구센터지원사업(NCRC), 신기술융합형성장동력사업 및 교육과학기술부의 KAIST 미래형 시스템 헬스케어 연구개발사업의 지원으로 수행되었고, 단백질체 연구 분야의 권위 있는 학술지인 ‘Molecular and Cellular Proteomics"지 4월호(4월 1일자)에 게재되었다. (논문명: A system for exploring E3-mediated regulatory networks of cellular functions)이관수 교수 연구팀은 전 세계 바이오 관련 DB(데이터베이스)와 논문(약 2만 편)으로부터 정보를 추출해 단백질 분해를 조절하는 효소(E3 효소)와 기질*들 간의 네트워크를 집대성하여, 이와 관련된 세포의 기능과 질병을 분석하는 ‘E3Net’ 시스템을 개발하였다.
※ 기질(substrate) : 효소와 특이적으로 결합하여 화학반응을 일으키는 분자로, 소화작용은 우리의 몸속에서 일어나는 효소와 기질간의 반응의 대표적인 사례
세포는 시시각각 변하는 환경에 대응하여 필요한 단백질들을 생산, 폐기 및 재활용하는 정교한 시스템을 가지고 있는데, 만일 이 과정에서 오류가 생기면 ‘질병’으로 이어질 수 있다.
따라서 단백질 분해를 조절하는 E3 효소와 기질 간의 관계를 파악하면 관련 질병을 치료하거나 예방할 수 있게 된다. 특히 E3 효소는 단백질 분해의 80%를 담당하는 것으로 알려져 수많은 질병이 관련되어 있을 것으로 예측되고 있다.
그러나 E3 효소와 기질 간의 정보들이 개별 논문과 DB에 흩어져 있어, 단백질 분해 조절과 관련된 세포의 기능과 질병의 특성을 종합적․체계적으로 분석할 수 없었다.
이 교수팀은 모든 E3 효소(2,201개)와 기질(4,896개) 및 그 조절관계(1,671개)에 대한 정보를 통합하여 E3 효소 조절 네트워크 내에 존재하는 관련된 세포의 기능과 질병을 시스템적으로 분석할 수 있는 E3Net을 구축하는데 성공하였다.
이 네트워크는 지금까지 구축된 조절정보를 모두 합친 것보다 무려 10배에 이르는 방대한 양으로, E3 효소가 독자적으로 또는 협력해서 조절하는 세포의 기능과 관련 질병을 정확히 파악할 수 있는 토대가 마련된 첫 사례로서 의미가 크다.
연구팀은 E3Net을 이용하면 각각의 질병과 관련된 단백질들의 분해조절을 담당하는 E3 효소들을 찾을 수 있고, 분해조절 원리와 세포기능 네트워크를 함께 파악하여 질병의 발생 원인이나 환자에 적합한 맞춤형 치료방법을 제공할 수 있는 바이오마커를 발굴할 수 있을 것으로 기대한다.
실제 연구팀은 E3Net을 활용해 암, 뇌심혈관 질환 및 당뇨병 등 현대인의 대표적 질환과 관련된 E3 바이오마커 후보 수십 개를 새롭게 발견하는 등 눈에 띄는 성과를 거두었고, 현재 이를 검증할 후속 연구를 계획하고 있다. 이관수 교수는 “이번 연구결과로 E3 효소와 관련된 단백질 분해조절의 네트워크가 구축되고, 이 네트워크에 존재하는 세포의 기능과 질병의 특이성을 시스템적으로 분석할 수 있게 됨에 따라, E3 효소와 관련된 세포의 기능 연구와 질병 연구에 새로운 전기가 마련되었다”고 연구의의를 밝혔다.
2012.05.01 조회수 25548
단백질 분해조절 효소 정보 담은 바이오마커 발굴 시스템 개발
- Mol Cell Proteomics지 게재, “바이오마커 개발의 새로운 패러다임 제시” -
단백질의 분해를 조절하는 효소와 기질에 대한 관계정보를 담은 바이오마커* 발굴 시스템(E3Net)이 국내 연구진에 의해 개발되어, 고부가가치의 새로운 바이오마커 개발에 가능성이 열렸다.
※ 바이오마커(Biomarker) : 유전자, 단백질 등에서 유래된 특이한 패턴의 분자적 정보로, 유전적․후천적 영향으로 발생한 신체의 변화를 감지할 수 있는 생물표지인자
우리학교 바이오및뇍 이관수 교수(49세)가 주도하고, 한영웅 박사과정생, 이호동 박사 및 박종철 교수가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 선도연구센터지원사업(NCRC), 신기술융합형성장동력사업 및 교육과학기술부의 KAIST 미래형 시스템 헬스케어 연구개발사업의 지원으로 수행되었고, 단백질체 연구 분야의 권위 있는 학술지인 ‘Molecular and Cellular Proteomics"지 4월호(4월 1일자)에 게재되었다. (논문명: A system for exploring E3-mediated regulatory networks of cellular functions)이관수 교수 연구팀은 전 세계 바이오 관련 DB(데이터베이스)와 논문(약 2만 편)으로부터 정보를 추출해 단백질 분해를 조절하는 효소(E3 효소)와 기질*들 간의 네트워크를 집대성하여, 이와 관련된 세포의 기능과 질병을 분석하는 ‘E3Net’ 시스템을 개발하였다.
※ 기질(substrate) : 효소와 특이적으로 결합하여 화학반응을 일으키는 분자로, 소화작용은 우리의 몸속에서 일어나는 효소와 기질간의 반응의 대표적인 사례
세포는 시시각각 변하는 환경에 대응하여 필요한 단백질들을 생산, 폐기 및 재활용하는 정교한 시스템을 가지고 있는데, 만일 이 과정에서 오류가 생기면 ‘질병’으로 이어질 수 있다.
따라서 단백질 분해를 조절하는 E3 효소와 기질 간의 관계를 파악하면 관련 질병을 치료하거나 예방할 수 있게 된다. 특히 E3 효소는 단백질 분해의 80%를 담당하는 것으로 알려져 수많은 질병이 관련되어 있을 것으로 예측되고 있다.
그러나 E3 효소와 기질 간의 정보들이 개별 논문과 DB에 흩어져 있어, 단백질 분해 조절과 관련된 세포의 기능과 질병의 특성을 종합적․체계적으로 분석할 수 없었다.
이 교수팀은 모든 E3 효소(2,201개)와 기질(4,896개) 및 그 조절관계(1,671개)에 대한 정보를 통합하여 E3 효소 조절 네트워크 내에 존재하는 관련된 세포의 기능과 질병을 시스템적으로 분석할 수 있는 E3Net을 구축하는데 성공하였다.
이 네트워크는 지금까지 구축된 조절정보를 모두 합친 것보다 무려 10배에 이르는 방대한 양으로, E3 효소가 독자적으로 또는 협력해서 조절하는 세포의 기능과 관련 질병을 정확히 파악할 수 있는 토대가 마련된 첫 사례로서 의미가 크다.
연구팀은 E3Net을 이용하면 각각의 질병과 관련된 단백질들의 분해조절을 담당하는 E3 효소들을 찾을 수 있고, 분해조절 원리와 세포기능 네트워크를 함께 파악하여 질병의 발생 원인이나 환자에 적합한 맞춤형 치료방법을 제공할 수 있는 바이오마커를 발굴할 수 있을 것으로 기대한다.
실제 연구팀은 E3Net을 활용해 암, 뇌심혈관 질환 및 당뇨병 등 현대인의 대표적 질환과 관련된 E3 바이오마커 후보 수십 개를 새롭게 발견하는 등 눈에 띄는 성과를 거두었고, 현재 이를 검증할 후속 연구를 계획하고 있다. 이관수 교수는 “이번 연구결과로 E3 효소와 관련된 단백질 분해조절의 네트워크가 구축되고, 이 네트워크에 존재하는 세포의 기능과 질병의 특이성을 시스템적으로 분석할 수 있게 됨에 따라, E3 효소와 관련된 세포의 기능 연구와 질병 연구에 새로운 전기가 마련되었다”고 연구의의를 밝혔다.
2012.05.01 조회수 25548 생체삽입형 바이오센서 기술 개발
-유연한 GaN LED 기술로 암을 진단-
인간의 주름진 뇌에 부착하거나, 혈관 및 척추를 감싼 유연한 LED에서 발생된 빛으로 질병을 진단하거나 치료할 수 있는 일들이 현실로 가까워지고 있다.
우리 학교 신소재공학과 이건재 교수팀이 최근 질화물 반도체 발광다이오드(GaN-LED)를 유연한 기판 위에 구현해내고 LED에서 발생되는 빛이 암의 항원-항체반응에 의하여 감도 차이가 일어나는 것을 확인함으로써 전립선암 항체를 검출하는 실험에 성공했다.
이번 연구를 계기로 유연한 LED에서 발생하는 녹색, 파란색, 그리고 자외선 영역까지의 다양한 파장의 강한 빛을 이용하면 신경세포를 자극할 수 있어 질병을 치료하는 데에도 응용될 수 있을 것으로 기대된다.
질화갈륨(GaN)은 적은 에너지로 높은 효율의 빛을 낼 수 있는 반도체로 현재 LED TV, 조명 등 산업 전반에 쓰이고 있으나 깨지기 쉬운 성질을 갖고 있다.
연구팀은 딱딱한 기판에서 성장된 얇은 고효율 GaN-LED를 유연한 플라스틱 기판에 전사하고, 생체 친화적인 재료를 사용한 바이오센서를 개발해 인체와 유사한 조건에 적용할 수 있게 했다.
이건재 교수는 “인체에 삽입된 유연한 LED는 인간 생명 연장과 건강한 삶의 중요한 과제를 해결할 수 있는 흥미롭고 새로운 분야로 꿈같은 일들이 실현될 수 있을 것”이라고 말했다.
이번 연구결과는 나노 분야의 세계적인 석학이자 최고 권위자인 미국 조지아 공대 왕종린(Wang, Zhong Lin) 교수가 편집장으로 있는 "나노 에너지(Nano Energy)" 9월호 온라인 판에 게재됐다.
관련 연구는 2009년부터 국내외에 다수의 특허가 출원․등록되었고, 지난 3월에는 KAIST를 대표하는 브랜드 과제로 선정되기도 했다.
한편, 이 교수는 논문의 공동책임으로 참여한 ETRI 성건용 박사팀과 생체이식형 라벨프리(Label-Free) LED 바이오센서에 대해 후속 연구를 계속 진행하고 있다.(끝)
<관련 동영상>
생체 친화적이고 유연한 GaN-LED가 빛을 내는 동영상 http://www.youtube.com/watch?v=miqc-o8fOkw
<그림설명>구부러지는 유연한 GaN-LED에서 푸른빛이 발생되고 있다.
2011.09.20 조회수 15121
생체삽입형 바이오센서 기술 개발
-유연한 GaN LED 기술로 암을 진단-
인간의 주름진 뇌에 부착하거나, 혈관 및 척추를 감싼 유연한 LED에서 발생된 빛으로 질병을 진단하거나 치료할 수 있는 일들이 현실로 가까워지고 있다.
우리 학교 신소재공학과 이건재 교수팀이 최근 질화물 반도체 발광다이오드(GaN-LED)를 유연한 기판 위에 구현해내고 LED에서 발생되는 빛이 암의 항원-항체반응에 의하여 감도 차이가 일어나는 것을 확인함으로써 전립선암 항체를 검출하는 실험에 성공했다.
이번 연구를 계기로 유연한 LED에서 발생하는 녹색, 파란색, 그리고 자외선 영역까지의 다양한 파장의 강한 빛을 이용하면 신경세포를 자극할 수 있어 질병을 치료하는 데에도 응용될 수 있을 것으로 기대된다.
질화갈륨(GaN)은 적은 에너지로 높은 효율의 빛을 낼 수 있는 반도체로 현재 LED TV, 조명 등 산업 전반에 쓰이고 있으나 깨지기 쉬운 성질을 갖고 있다.
연구팀은 딱딱한 기판에서 성장된 얇은 고효율 GaN-LED를 유연한 플라스틱 기판에 전사하고, 생체 친화적인 재료를 사용한 바이오센서를 개발해 인체와 유사한 조건에 적용할 수 있게 했다.
이건재 교수는 “인체에 삽입된 유연한 LED는 인간 생명 연장과 건강한 삶의 중요한 과제를 해결할 수 있는 흥미롭고 새로운 분야로 꿈같은 일들이 실현될 수 있을 것”이라고 말했다.
이번 연구결과는 나노 분야의 세계적인 석학이자 최고 권위자인 미국 조지아 공대 왕종린(Wang, Zhong Lin) 교수가 편집장으로 있는 "나노 에너지(Nano Energy)" 9월호 온라인 판에 게재됐다.
관련 연구는 2009년부터 국내외에 다수의 특허가 출원․등록되었고, 지난 3월에는 KAIST를 대표하는 브랜드 과제로 선정되기도 했다.
한편, 이 교수는 논문의 공동책임으로 참여한 ETRI 성건용 박사팀과 생체이식형 라벨프리(Label-Free) LED 바이오센서에 대해 후속 연구를 계속 진행하고 있다.(끝)
<관련 동영상>
생체 친화적이고 유연한 GaN-LED가 빛을 내는 동영상 http://www.youtube.com/watch?v=miqc-o8fOkw
<그림설명>구부러지는 유연한 GaN-LED에서 푸른빛이 발생되고 있다.
2011.09.20 조회수 15121 유회준 교수 연구팀, 세계 최초로 가슴에 붙이는 심장건강상태 모니터링 장치 개발
- 붙이는 파스형태의 심장 건강상태 모니터링 장치, ‘스마트 파스’ 세계 최초개발 -
전기및전자공학과 유회준 교수 연구팀이 세계 최초로 가슴에 붙이는 심장건강상태 모니터링 장치를 최근 개발했다.
붙이는 파스형태로 제작돼 휴대폰 등의 휴대용 단말기기를 통하여 원격으로 켜고 끌 수 있으며 데이터통신도 가능하다.
고성능 반도체 집적회로(헬스케어 칩)가 파스 안에 장착돼 있고 파스 표면에 25개의 전극이 형성돼 있어 다양한 형태로 전극을 사용할 수 있으며 심장의 수축·이완 능력과 심전도 신호를 동시에 검출해 무선으로 외부에 알려 준다.
이 장치의 핵심은 크게 심혈관 저항 및 심전도 측정 집적회로(헬스케어 칩)와 이 칩을 내부에 장착하고 있으며 표면에 전극을 형성시킨 4층 헝겊형 기판기술이다.
직물 위에 전극 및 회로 기판을 직접 인쇄할 수 있는 P-FCB(Planar Fashionable Circuit Board)기술로 서로 다른 헝겊에 전극, 무선 안테나, 회로기판(이 헝겊의 중앙부에 헬스 케어 칩을 부착)형성한 후 플렉시블 배터리와 함께 적층해 이 장치를 제작했다.
또한 전극 제어부, 심전도·혈관 저항 측정부, 데이터 압축부, SRAM, 무선 송수신 장치 등을 가지고 초저전력으로 동작하는 특수 헬스 케어 집적회로(크기 5mm X 5mm)를 제작해 헝겊형 회로 기판 위에 부착시켰다.
전극이 형성된 헝겊 면에는 접착제가 발라져 있어 일반 파스처럼 가슴에 부착시켜 사용하게 된다. 완성품은 가로 세로 15Cm X 15Cm이며 두께는 가장 두꺼운 중앙 부분이 1mm정도이다.
특히, 헬스 케어 칩은 차동전류주입기와 재구성이 가능한 고감도 검출 회로를 통해 심혈관 임피던스 변화를 16가지 서로 다른 조합으로 0.81% 신호왜곡 이하로 검출 가능하다.
KAIST 얜롱(Yan Long, 전기및전자공학과 박사과정)연구원은 “헝겊 위에 직접 전극 배열을 인쇄하고 건강관리 칩과 플렉시블 배터리를 부착함으로서 편의성과 착용감을 확보해 간편하게 심전도와 심혈관 임피던스 변화를 동시에 측정할 수 있다.”라고 말했다.
자신의 건강상태를 실시간으로 간편하게 자가진단을 할 수 있어 지속적인 관리가 필요한 만성 심부전 환자 등을 포함한 심혈관 질병이 있는 사람들에게 안성맞춤이다.
만성 심혈관 관련 환자를 위한 건강관리 기술은 2000년 이후 전 세계적으로 꾸준한 관심을 받고 있으나, 대부분 심장의 전기적 특성 즉 심전도 신호만을 검출하는데 그쳤다. 현재까지 개발된 측정기는 크고 이물감이 있으며, 유선으로 연결되는 등 외부와의 저전력 통신이 어려워 일상생활에서 널리 사용되지 못하고 있다.
이번 연구결과는 지난 2월 8일부터 10일까지 미국 샌프란시스코에서 개최된 국제반도체회로 학술회의(ISSCC)에 발표됐다.
❋ ISSCC (International Solid State Circuit Conference: 국제 고체 회로 학회)학회:1954년부터 국제 전기전자공학회 (IEEE SSCS) 주관으로 매년 2월에 미국 San Francisco, Marriot 호텔에서 개최되는 이 분야 최고 권위의 학회로 ‘반도체 올림픽’이라고 불리우고 있음. 전 세계로부터 4천여명의 학자와 연구원들이 참여한 가운데 매년 반도체 분야 최우수 논문 210편만을 엄선하여 3일 동안 발표하면서 연구 성과와 정보를 교환하고 미래의 반도체 산업과 기술을 논의하는 학회임.
(사진 1) 스마트 파스 구조
스마트 파스는 총 4층 구조로 형성 되어 있으며 그 크기는 15cm x 15cm 이다. 가슴에 부착하는 면인 제 1층은 25개의 전극이 형성되어 이 중 4개는 전류 주입 전극으로 16개는 전압 측정 전극으로 5개는 기준 전극으로 사용할 수 있다. 제 2층은 직물형 인덕터(2.2uH, Q=9.2)로 스마트 파스의 무선 데이터 통신을 지원한다. 제 3층은 플렉시블 배터리(1.5V, 30mAh)로 파스를 하루이상 지속적으로 사용할 수 있도록 전원을 공급한다. 제 4층은 직물형 인쇄 회로 기판으로 그 위에 고성능 반도체 칩이 장착되어 있다.
(사진 2) 스마트 파스 사용 예
사용자가 스마트 파스를 가슴에 붙인 모습을 보여 준다. 휴대폰 등의 휴대용 단말기기를 통하여 원격으로 켜고 끌 수 있으며 25개의 전극배열이 피부와 접착되어 있어 심혈관 저항 및 심전도를 여러 가지 형태로 측정하여 내장메모리에 저장 또는 휴대용 단말기기로데이터를 고속으로 송신도 가능하다.
(사진 3) 스마트 파스 측정 예스마트 파스를 통하여 측정된 심전도 신호와 심혈관의 저항의 변화를 보여 준다. 이러한 신호로부터 심장의 수축 이완 능력을 편리하게 일상생활 속에서 측정 가능하다.
(사진 4) 스마트 파스에 장착된 헬스 케어 칩
직물형 인쇄 회로 기판에 장착되어 있는 고성능 반도체칩(헬스케어 칩)의 사진과 제원이다. 본 헬스케어 칩은 최대 3.9mW의 전력을 소모하며 평균 2.4mW의 전력소비로 0.1옴이하의 저항 변화를 고감도 회로를 통하여 검출 가능케 하는 것이 특징이다.
2010.02.10 조회수 24819
유회준 교수 연구팀, 세계 최초로 가슴에 붙이는 심장건강상태 모니터링 장치 개발
- 붙이는 파스형태의 심장 건강상태 모니터링 장치, ‘스마트 파스’ 세계 최초개발 -
전기및전자공학과 유회준 교수 연구팀이 세계 최초로 가슴에 붙이는 심장건강상태 모니터링 장치를 최근 개발했다.
붙이는 파스형태로 제작돼 휴대폰 등의 휴대용 단말기기를 통하여 원격으로 켜고 끌 수 있으며 데이터통신도 가능하다.
고성능 반도체 집적회로(헬스케어 칩)가 파스 안에 장착돼 있고 파스 표면에 25개의 전극이 형성돼 있어 다양한 형태로 전극을 사용할 수 있으며 심장의 수축·이완 능력과 심전도 신호를 동시에 검출해 무선으로 외부에 알려 준다.
이 장치의 핵심은 크게 심혈관 저항 및 심전도 측정 집적회로(헬스케어 칩)와 이 칩을 내부에 장착하고 있으며 표면에 전극을 형성시킨 4층 헝겊형 기판기술이다.
직물 위에 전극 및 회로 기판을 직접 인쇄할 수 있는 P-FCB(Planar Fashionable Circuit Board)기술로 서로 다른 헝겊에 전극, 무선 안테나, 회로기판(이 헝겊의 중앙부에 헬스 케어 칩을 부착)형성한 후 플렉시블 배터리와 함께 적층해 이 장치를 제작했다.
또한 전극 제어부, 심전도·혈관 저항 측정부, 데이터 압축부, SRAM, 무선 송수신 장치 등을 가지고 초저전력으로 동작하는 특수 헬스 케어 집적회로(크기 5mm X 5mm)를 제작해 헝겊형 회로 기판 위에 부착시켰다.
전극이 형성된 헝겊 면에는 접착제가 발라져 있어 일반 파스처럼 가슴에 부착시켜 사용하게 된다. 완성품은 가로 세로 15Cm X 15Cm이며 두께는 가장 두꺼운 중앙 부분이 1mm정도이다.
특히, 헬스 케어 칩은 차동전류주입기와 재구성이 가능한 고감도 검출 회로를 통해 심혈관 임피던스 변화를 16가지 서로 다른 조합으로 0.81% 신호왜곡 이하로 검출 가능하다.
KAIST 얜롱(Yan Long, 전기및전자공학과 박사과정)연구원은 “헝겊 위에 직접 전극 배열을 인쇄하고 건강관리 칩과 플렉시블 배터리를 부착함으로서 편의성과 착용감을 확보해 간편하게 심전도와 심혈관 임피던스 변화를 동시에 측정할 수 있다.”라고 말했다.
자신의 건강상태를 실시간으로 간편하게 자가진단을 할 수 있어 지속적인 관리가 필요한 만성 심부전 환자 등을 포함한 심혈관 질병이 있는 사람들에게 안성맞춤이다.
만성 심혈관 관련 환자를 위한 건강관리 기술은 2000년 이후 전 세계적으로 꾸준한 관심을 받고 있으나, 대부분 심장의 전기적 특성 즉 심전도 신호만을 검출하는데 그쳤다. 현재까지 개발된 측정기는 크고 이물감이 있으며, 유선으로 연결되는 등 외부와의 저전력 통신이 어려워 일상생활에서 널리 사용되지 못하고 있다.
이번 연구결과는 지난 2월 8일부터 10일까지 미국 샌프란시스코에서 개최된 국제반도체회로 학술회의(ISSCC)에 발표됐다.
❋ ISSCC (International Solid State Circuit Conference: 국제 고체 회로 학회)학회:1954년부터 국제 전기전자공학회 (IEEE SSCS) 주관으로 매년 2월에 미국 San Francisco, Marriot 호텔에서 개최되는 이 분야 최고 권위의 학회로 ‘반도체 올림픽’이라고 불리우고 있음. 전 세계로부터 4천여명의 학자와 연구원들이 참여한 가운데 매년 반도체 분야 최우수 논문 210편만을 엄선하여 3일 동안 발표하면서 연구 성과와 정보를 교환하고 미래의 반도체 산업과 기술을 논의하는 학회임.
(사진 1) 스마트 파스 구조
스마트 파스는 총 4층 구조로 형성 되어 있으며 그 크기는 15cm x 15cm 이다. 가슴에 부착하는 면인 제 1층은 25개의 전극이 형성되어 이 중 4개는 전류 주입 전극으로 16개는 전압 측정 전극으로 5개는 기준 전극으로 사용할 수 있다. 제 2층은 직물형 인덕터(2.2uH, Q=9.2)로 스마트 파스의 무선 데이터 통신을 지원한다. 제 3층은 플렉시블 배터리(1.5V, 30mAh)로 파스를 하루이상 지속적으로 사용할 수 있도록 전원을 공급한다. 제 4층은 직물형 인쇄 회로 기판으로 그 위에 고성능 반도체 칩이 장착되어 있다.
(사진 2) 스마트 파스 사용 예
사용자가 스마트 파스를 가슴에 붙인 모습을 보여 준다. 휴대폰 등의 휴대용 단말기기를 통하여 원격으로 켜고 끌 수 있으며 25개의 전극배열이 피부와 접착되어 있어 심혈관 저항 및 심전도를 여러 가지 형태로 측정하여 내장메모리에 저장 또는 휴대용 단말기기로데이터를 고속으로 송신도 가능하다.
(사진 3) 스마트 파스 측정 예스마트 파스를 통하여 측정된 심전도 신호와 심혈관의 저항의 변화를 보여 준다. 이러한 신호로부터 심장의 수축 이완 능력을 편리하게 일상생활 속에서 측정 가능하다.
(사진 4) 스마트 파스에 장착된 헬스 케어 칩
직물형 인쇄 회로 기판에 장착되어 있는 고성능 반도체칩(헬스케어 칩)의 사진과 제원이다. 본 헬스케어 칩은 최대 3.9mW의 전력을 소모하며 평균 2.4mW의 전력소비로 0.1옴이하의 저항 변화를 고감도 회로를 통하여 검출 가능케 하는 것이 특징이다.
2010.02.10 조회수 24819 김봉수교수, 은나노선 합성법 개발
단결정 銀 나노선 합성법 최초 개발
- 질병진단센서, 바이오센서, 차세대 자성소자 등 광범위한 활용- 화학분야 최고 권위지인 미국화학회지에 지난 18일자 속보로 게재
KAIST(총장 서남표) 화학과 김봉수(金峯秀, 48) 교수 연구팀은 촉매를 전혀 사용하지 않는 새로운 합성법 개발로 ‘단결정 은 나노선 합성’에 최초로 성공했다. 이 연구 결과는 화학분야 최고 권위지인 미국화학회지(Journal of the American Chemical Society)에 지난 18일(수) 속보로 게재됐다.
은(Ag)은 높은 항균효과를 지니며, 전자 및 광학 재료로도 중요하게 사용된다. 은을 완벽한 단결정 나노선으로 만들면 탄소가 다이아몬드로 변하듯 물질의 특성이 변하면서 가치가 크게 높아진다. 보통의 물질은 촉매 등을 사용하면 단결정 나노선 합성이 가능한데 은과 같은 금속의 경우에는 적절한 촉매를 찾아내지 못해서 합성이 불가능했다.
金 교수는 촉매를 사용하지 않고 산화은을 출발물질로 적절한 응결조건을 맞추어줌으로써 은 입자들이 가장 에너지가 낮은 상태를 스스로 찾아가서 저절로 은 나노선이 생긴다는 사실을 발견했다. 이 기술을 이용하면 금속 및 금속화합물 대부분을 단결정 나노선으로 만들 수 있다. 특히 자성물질 나노선 및 열전소자 나노선 개발로 차세대 자성 소자 및 신에너지 핵심 물질을 개발할 수 있는 가능성이 열렸다. 합성된 은 나노섬유는 소독이 필요 없는 의료용 제품 개발, 바이오센서 및 자성메모리 제작 등에 중요한 소재가 될 수 있다.
은에 분자가 흡착되면 빛을 쪼였을 때 산란되는 빛의 세기가 1조배 이상 커진다. 이를 “표면증강 라만 효과”라 하며, 단 하나의 분자만 존재하더라도 검출이 가능하다. 이 효과는 은이 나노입자 크기로 작아지면 더욱 높아지므로 이를 이용한 질병 진단기 개발 연구가 활발하게 진행되고 있다. 특히, 은 나노선은 진단 능력이 보다 뛰어나 질병진단센서로 개발 전망이 높다.
이 연구는 과학기술부「21세기 프론티어연구개발사업」나노소재기술개발사업단에서 지원했으며, 연구 결과는 현재 세계 각국에 특허 출원중이다.
<붙임1. 용어해설>
■ 단결정 은 나노선나노선은 직경이 수 나노미터에서 수백 나노미터 사이에 있는 아주 가늘고 긴 선을 말한다. 단결정은 물질을 이루고 있는 모든 구성원소가 규칙적으로 배열되어 있는 순수하고 독특한 구조인데 다이아몬드 같은 것이 대표적 예다. 은과 같은 금속의 경우에는 적절한 촉매를 찾아내지 못해서 합성이 불가능한데, 이번에 촉매를 사용하지 않고 은이 스스로 단결정 나노선을 이루는 새로운 합성법을 개발했다.
■ 은 나노섬유의 의료분야 응용
은 나노섬유를 이용하여 상처를 보호하기 위해 사용하는 의료용 붕대 등을 제작하면 병균 등의 침투를 근본적으로 방지할 수 있으므로 강력한 의료용 소재가 될 것으로 전망된다.
■ 미국 화학회지(Journal of the American Chemical Society)미국화학회(American Chemical Society)에서 발행하는 대표 학회지로서 가장 역사가 오래되고 권위가 높은 학술지이다. 여기서 특히 긴급하며 중요성이 높은 연구결과는 속보(Communication)로 신속하게 발표된다.
<붙임2. 관련 사진 및 설명>
1. 연구팀이 합성에 성공한 단결정 은 나노선의 전자현미경 사진
2. 하나하나의 원자까지 보여주며 완벽한 은 단결정임을 증명하는 초고전압 전자현미경 사진
2007.07.23 조회수 28542
김봉수교수, 은나노선 합성법 개발
단결정 銀 나노선 합성법 최초 개발
- 질병진단센서, 바이오센서, 차세대 자성소자 등 광범위한 활용- 화학분야 최고 권위지인 미국화학회지에 지난 18일자 속보로 게재
KAIST(총장 서남표) 화학과 김봉수(金峯秀, 48) 교수 연구팀은 촉매를 전혀 사용하지 않는 새로운 합성법 개발로 ‘단결정 은 나노선 합성’에 최초로 성공했다. 이 연구 결과는 화학분야 최고 권위지인 미국화학회지(Journal of the American Chemical Society)에 지난 18일(수) 속보로 게재됐다.
은(Ag)은 높은 항균효과를 지니며, 전자 및 광학 재료로도 중요하게 사용된다. 은을 완벽한 단결정 나노선으로 만들면 탄소가 다이아몬드로 변하듯 물질의 특성이 변하면서 가치가 크게 높아진다. 보통의 물질은 촉매 등을 사용하면 단결정 나노선 합성이 가능한데 은과 같은 금속의 경우에는 적절한 촉매를 찾아내지 못해서 합성이 불가능했다.
金 교수는 촉매를 사용하지 않고 산화은을 출발물질로 적절한 응결조건을 맞추어줌으로써 은 입자들이 가장 에너지가 낮은 상태를 스스로 찾아가서 저절로 은 나노선이 생긴다는 사실을 발견했다. 이 기술을 이용하면 금속 및 금속화합물 대부분을 단결정 나노선으로 만들 수 있다. 특히 자성물질 나노선 및 열전소자 나노선 개발로 차세대 자성 소자 및 신에너지 핵심 물질을 개발할 수 있는 가능성이 열렸다. 합성된 은 나노섬유는 소독이 필요 없는 의료용 제품 개발, 바이오센서 및 자성메모리 제작 등에 중요한 소재가 될 수 있다.
은에 분자가 흡착되면 빛을 쪼였을 때 산란되는 빛의 세기가 1조배 이상 커진다. 이를 “표면증강 라만 효과”라 하며, 단 하나의 분자만 존재하더라도 검출이 가능하다. 이 효과는 은이 나노입자 크기로 작아지면 더욱 높아지므로 이를 이용한 질병 진단기 개발 연구가 활발하게 진행되고 있다. 특히, 은 나노선은 진단 능력이 보다 뛰어나 질병진단센서로 개발 전망이 높다.
이 연구는 과학기술부「21세기 프론티어연구개발사업」나노소재기술개발사업단에서 지원했으며, 연구 결과는 현재 세계 각국에 특허 출원중이다.
<붙임1. 용어해설>
■ 단결정 은 나노선나노선은 직경이 수 나노미터에서 수백 나노미터 사이에 있는 아주 가늘고 긴 선을 말한다. 단결정은 물질을 이루고 있는 모든 구성원소가 규칙적으로 배열되어 있는 순수하고 독특한 구조인데 다이아몬드 같은 것이 대표적 예다. 은과 같은 금속의 경우에는 적절한 촉매를 찾아내지 못해서 합성이 불가능한데, 이번에 촉매를 사용하지 않고 은이 스스로 단결정 나노선을 이루는 새로운 합성법을 개발했다.
■ 은 나노섬유의 의료분야 응용
은 나노섬유를 이용하여 상처를 보호하기 위해 사용하는 의료용 붕대 등을 제작하면 병균 등의 침투를 근본적으로 방지할 수 있으므로 강력한 의료용 소재가 될 것으로 전망된다.
■ 미국 화학회지(Journal of the American Chemical Society)미국화학회(American Chemical Society)에서 발행하는 대표 학회지로서 가장 역사가 오래되고 권위가 높은 학술지이다. 여기서 특히 긴급하며 중요성이 높은 연구결과는 속보(Communication)로 신속하게 발표된다.
<붙임2. 관련 사진 및 설명>
1. 연구팀이 합성에 성공한 단결정 은 나노선의 전자현미경 사진
2. 하나하나의 원자까지 보여주며 완벽한 은 단결정임을 증명하는 초고전압 전자현미경 사진
2007.07.23 조회수 28542 생명화학공학과 이상엽 교수, 획기적인 단백체 분석 기술 개발
과학기술부 시스템생물학 연구개발사업 결실
열충격 단백질이 세포외에서 단백질 분해를 효과적으로 억제하는 현상 최초 규명
기존 단백질 분해 저해제보다 최고 50% 이상 단백질 검출 가능 기술 개발
전세계 특허 출원/등록 중, 단백체 연구분야 권위지 미국화학회 발간 저널 오브 프로테옴 리서치에 게재 예정, 온라인판에 공개
생명화학공학과 이상엽 교수(李相燁, 41, LG화학 석좌교수)가 작은 열충격 단백질의 세포외 단백질 분해 저해 기능을 적용하여 획기적으로 향상된 새로운 단백체 분석 기술을 개발했다.
1. 개발배경
포스트 게놈 시대의 가장 주목 받는 연구 분야로서, 또한 시스템 생물학의 중심이 되는 한 분야로서, 세포의 생리적 변화를 단백질 수준에서 관찰할 수 있는 단백체(프로테옴) 연구에 대한 관심이 집중되고 있다. 단백체 연구의 가장 핵심적인 기술은 세포, 조직, 또는 생물체 유래 샘플을 폴리아크릴아마이드젤(polyacrylamide gel) 상에서 2차원 전기영동방법으로 분리하는 것이다. 이때 전체 단백질들을 분석할 수 있도록 단백질 분해를 막는 것이 매우 중요하다.
이제까지 다양한 단백질 분해 저해제들이 개발되어 실험에 사용되어 왔다. 하지만, 단백체 분석시 2차원 전기영동된 젤(gel)에서는 단백질 분해 등의 현상으로 인해 게놈에서 예측되는 숫자보다 훨씬 적은 수의 단백질들이 발견되어 전체 단백질 대상 연구에 한계를 드러냈다.
2. 개발현황
과학기술부 시스템생물학 연구개발사업으로 진행된 이 연구에서 李 교수팀은 대장균의 전체 전사체와 단백체를 분석하고, 이들을 대사 및 조절회로에 연관시키는 과정에서 작은 열충격 단백질의 새로운 기능을 발견하게 되었다.
직접 대장균에서 작은 열충격 단백질을 생산ㆍ정제하고, 이를 이용한 세포 밖 시험관 (in vitro)에서 작은 열충격 단백질이 다양한 효소에 의한 단백질 분해를 효율적으로 억제함을 규명하였다.
또한, 다른 종에서 유래한 작은 열충격 단백질들도 마찬가지로 단백질 분해를 억제하는데 사용될 수 있음도 밝혀냈다.
李 교수팀은 단백체 연구의 핵심기술 중의 하나인 2차원 전기영동시 단백질이 분해되어 변형되거나 없어지는 문제를 해결하고자 이 발견된 기술을 적용하였다. 2차원 전기영동시 작은 열충격 단백질 첨가로 단백질 분해 현상을 저해시킬 수 있음을 밝혀내었다.
기존에 알려진 단백질 분해 저해제를 적용하였을 때는 검출 되지 않았던 단백질들도 이 새로운 방법을 이용하였을 때 검출 가능하였다. 최고 50% 이상 증가된 숫자의 단백질들이 보일 정도로 획기적인 기술로 평가된다.
또한, 이 방법을 미생물뿐 아니라 사람, 식물 유래의 다양한 단백질 시료에도 적용하여 모든 경우에서 그 효과를 확인함으로써, 이 기술이 매우 광범위한 단백질 시료에 적용 가능함을 보여 주었다.
3. 개발성과 및 향후계획
기존의 방법으로 검출 되지 않았던 단백질들이 새로 개발된 방법으로 검출 가능하므로 단백체를 이용한 세포내 생리 변화 관찰 또는 질병 진단 표지 개발 등에 상당한 고성능의 분해능을 제공해 줄 수 있다. 李 교수는 “모든 단백체 분석에 적용이 가능한 이 기술이 향후 단백체 연구 분야에 획기적인 발전을 가져올 것으로 기대한다”고 말했다.
이 기술은 현재 전 세계 특허 출원/등록 중이고, 미국화학회 (American Chemical Society)에서 발간하는 단백체 분야의 권위 있는 학술지인 저널 오브 프로테옴 리서치 (Journal of Proteome Research)에 실리게 되며, 온라인 판에 게재 되었다.
<사진설명>
작은 열충격 단백질 첨가에 의한 단백질 분해를 최소화시켜 분석가능한 단백질 수를 획기적으로 늘린 결과를 보여주는 젤(gel) 사진 (왼쪽 위부터 시계방향으로)
1. 대장균 단백질 시료에 기존에 시판되는 단백질 분해억제제인 칵테일 인히비터를 첨가하여 2차원 전기영동한 젤
2. 같은 시료에 IbpAEc (대장균 유래의 작은 열충격 단백질)를 첨가하여 2차원 전기영동한 젤
3. 같은 시료에 Hsp26Sc (효모 유래의 작은 열충격 단백질)를 첨가하여 2차원 전기영동한 젤
4. 같은 시료에 IbpBEc (대장균 유래의 또 다른 작은 열충격 단백질)를 첨가하여 2차원 전기영동한 젤
- 각 그림의 원 안은 확대된 이미지로서 작은 열충격 단백질 첨가시 까만점(단백질)의 수가 획기적으로 늘어났음을 볼 수 있음.
2005.11.11 조회수 21217
생명화학공학과 이상엽 교수, 획기적인 단백체 분석 기술 개발
과학기술부 시스템생물학 연구개발사업 결실
열충격 단백질이 세포외에서 단백질 분해를 효과적으로 억제하는 현상 최초 규명
기존 단백질 분해 저해제보다 최고 50% 이상 단백질 검출 가능 기술 개발
전세계 특허 출원/등록 중, 단백체 연구분야 권위지 미국화학회 발간 저널 오브 프로테옴 리서치에 게재 예정, 온라인판에 공개
생명화학공학과 이상엽 교수(李相燁, 41, LG화학 석좌교수)가 작은 열충격 단백질의 세포외 단백질 분해 저해 기능을 적용하여 획기적으로 향상된 새로운 단백체 분석 기술을 개발했다.
1. 개발배경
포스트 게놈 시대의 가장 주목 받는 연구 분야로서, 또한 시스템 생물학의 중심이 되는 한 분야로서, 세포의 생리적 변화를 단백질 수준에서 관찰할 수 있는 단백체(프로테옴) 연구에 대한 관심이 집중되고 있다. 단백체 연구의 가장 핵심적인 기술은 세포, 조직, 또는 생물체 유래 샘플을 폴리아크릴아마이드젤(polyacrylamide gel) 상에서 2차원 전기영동방법으로 분리하는 것이다. 이때 전체 단백질들을 분석할 수 있도록 단백질 분해를 막는 것이 매우 중요하다.
이제까지 다양한 단백질 분해 저해제들이 개발되어 실험에 사용되어 왔다. 하지만, 단백체 분석시 2차원 전기영동된 젤(gel)에서는 단백질 분해 등의 현상으로 인해 게놈에서 예측되는 숫자보다 훨씬 적은 수의 단백질들이 발견되어 전체 단백질 대상 연구에 한계를 드러냈다.
2. 개발현황
과학기술부 시스템생물학 연구개발사업으로 진행된 이 연구에서 李 교수팀은 대장균의 전체 전사체와 단백체를 분석하고, 이들을 대사 및 조절회로에 연관시키는 과정에서 작은 열충격 단백질의 새로운 기능을 발견하게 되었다.
직접 대장균에서 작은 열충격 단백질을 생산ㆍ정제하고, 이를 이용한 세포 밖 시험관 (in vitro)에서 작은 열충격 단백질이 다양한 효소에 의한 단백질 분해를 효율적으로 억제함을 규명하였다.
또한, 다른 종에서 유래한 작은 열충격 단백질들도 마찬가지로 단백질 분해를 억제하는데 사용될 수 있음도 밝혀냈다.
李 교수팀은 단백체 연구의 핵심기술 중의 하나인 2차원 전기영동시 단백질이 분해되어 변형되거나 없어지는 문제를 해결하고자 이 발견된 기술을 적용하였다. 2차원 전기영동시 작은 열충격 단백질 첨가로 단백질 분해 현상을 저해시킬 수 있음을 밝혀내었다.
기존에 알려진 단백질 분해 저해제를 적용하였을 때는 검출 되지 않았던 단백질들도 이 새로운 방법을 이용하였을 때 검출 가능하였다. 최고 50% 이상 증가된 숫자의 단백질들이 보일 정도로 획기적인 기술로 평가된다.
또한, 이 방법을 미생물뿐 아니라 사람, 식물 유래의 다양한 단백질 시료에도 적용하여 모든 경우에서 그 효과를 확인함으로써, 이 기술이 매우 광범위한 단백질 시료에 적용 가능함을 보여 주었다.
3. 개발성과 및 향후계획
기존의 방법으로 검출 되지 않았던 단백질들이 새로 개발된 방법으로 검출 가능하므로 단백체를 이용한 세포내 생리 변화 관찰 또는 질병 진단 표지 개발 등에 상당한 고성능의 분해능을 제공해 줄 수 있다. 李 교수는 “모든 단백체 분석에 적용이 가능한 이 기술이 향후 단백체 연구 분야에 획기적인 발전을 가져올 것으로 기대한다”고 말했다.
이 기술은 현재 전 세계 특허 출원/등록 중이고, 미국화학회 (American Chemical Society)에서 발간하는 단백체 분야의 권위 있는 학술지인 저널 오브 프로테옴 리서치 (Journal of Proteome Research)에 실리게 되며, 온라인 판에 게재 되었다.
<사진설명>
작은 열충격 단백질 첨가에 의한 단백질 분해를 최소화시켜 분석가능한 단백질 수를 획기적으로 늘린 결과를 보여주는 젤(gel) 사진 (왼쪽 위부터 시계방향으로)
1. 대장균 단백질 시료에 기존에 시판되는 단백질 분해억제제인 칵테일 인히비터를 첨가하여 2차원 전기영동한 젤
2. 같은 시료에 IbpAEc (대장균 유래의 작은 열충격 단백질)를 첨가하여 2차원 전기영동한 젤
3. 같은 시료에 Hsp26Sc (효모 유래의 작은 열충격 단백질)를 첨가하여 2차원 전기영동한 젤
4. 같은 시료에 IbpBEc (대장균 유래의 또 다른 작은 열충격 단백질)를 첨가하여 2차원 전기영동한 젤
- 각 그림의 원 안은 확대된 이미지로서 작은 열충격 단백질 첨가시 까만점(단백질)의 수가 획기적으로 늘어났음을 볼 수 있음.
2005.11.11 조회수 21217