-
 장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.07.01
조회수 902
-
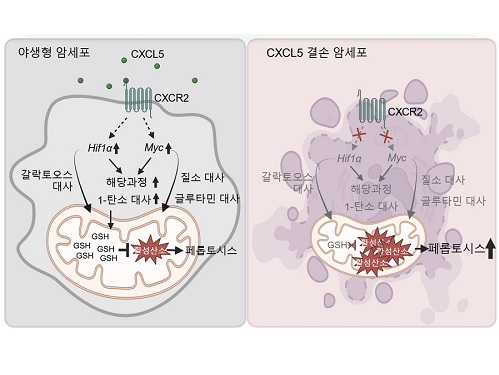 암세포 사멸과 연관된 대사를 관장하는 최상위인자 규명
우리 대학 생명과학과 강석조 교수 연구팀이 3차원 종양미세환경에서 성장한 암세포에서 유래한 케모카인(Chemokine) CXCL5가 암세포의 대사 리프로그래밍(reprogramming)을 조절하며 이를 통하여 지질 과산화물의 축적으로 인해 유도되는 세포 사멸인 페롭토시스(ferroptosis)에 대한 저항성을 획득한다고 7일 밝혔다.
CXCL5는 수용체인 CXCR2와의 결합을 통해 세포의 이동(migration) 및 침습(invasion)을 촉진하는 역할을 하는 케모카인으로, 종양미세환경에서 면역세포들의 침윤에 관여함이 알려져왔다. CXCL5는 여러 암종에서 발현이 증가되어 있음이 보고되었으나 실제 3차원 종양미세환경 내 암세포에서 유래한 CXCL5의 역할에 대해서는 밝혀진 바가 없다.
강 교수 연구팀은 세포외기질의 침착과 대식세포의 침투가 특징적인 암 미세환경을 모사하는 3차원 배양 시스템을 구축해 세포 간, 세포와 세포외기질 간 상호작용 뿐 아니라 종양미세환경 내 암세포의 위치에 따라 생장에 필요한 산소와 영양분의 접근성 차이로 인한 비세포적 요소가 형성될 수 있도록 유도하였다. 연구팀은 IFNγ자극을 받은 대식세포의 분비물이 3차원 환경 특이적으로 암세포의 CXCL5 발현을 증가시킴을 확인하였고, 야생형 암세포와 CXCL5 결손 암세포의 성장을 2차원, 3차원에서 비교한 결과 암세포의 CXCL5의 발현은 3차원 성장에만 필수적임을 확인하였다.
연구팀은 2차원 배양 암세포와 3차원 배양 암세포의 유전자 발현과 대사체를 비교하여 3차원에서 광범위한 대사 과정의 리프로그래밍이 일어남을 확인하였고, CXCL5가 이런 3차원 특이적 대사 리프로그래밍을 관장하는 핵심적 역할을 수행함을 보였다. 기전적으로 CXCL5는 전사인자 HIF-1a와 MYC의 발현을 유도하여 대사 리프로그래밍을 조절하며, 특히 여러 대사 과정 중 해당과정과 1-탄소 대사과정에 영향을 주는 것을 확인하였다.
또한, 연구팀은 저해된 해당과정과 1-탄소 대사과정이 산화-환원 항상성 조절에 중요한 역할을 한다는 이전 연구결과를 바탕으로, 세포 내 산화손상 정도를 측정한 결과 CXCL5 결손 시 미토콘드리아 활성산소와 철분에 의존하여 페롭토시스를 유발하는 지질 과산화물이 증가한 것을 확인하였다. 흥미롭게도 세포자멸사(apoptosis), 염증성 세포사멸인 파이롭토시스(pyroptosis), 그리고 구리 의존적 세포사멸인 큐프롭티시스(cuproptosis)는 CXCL5 결손에 의해 영향을 받지 않는 것을 밝혔다. 또한, HIF-1a와 MYC의 과발현은 CXCL5 결손 세포에서 보이는 활성산소와 지질 과산화물의 증가를 감소시키고 효과적으로 페롭토시스를 억제함을 확인하였다. CXCL5 수용체인 CXCR2를 결손시켰을 경우 동일하게 HIF-1a와 MYC의 발현이 저해되는 것을 확인함으로써, 암세포의 CXCL5-CXCR2 경로 억제를 통한 페롭토시스의 유도는 현재 개발 중인 세포자멸사 유도제의 한계를 극복할 새로운 전략이 될 수 있음을 시사하였다.
강석조 교수는 “본 연구는 3차원 종양미세환경 특이적인 암세포 대사를 보다 광범위하게 밝히고, 암세포에서 유래한 CXCL5가 HIF-1a와 MYC의 발현을 유도하여 3차원 성장을 위한 암대사 리프로그래밍을 총괄하는 지휘자적인 역할을 수행함을 새롭게 밝힌 연구”라고 언급하면서, “본 연구 성과는 암세포 대사 과정과 세포사멸 저항성 획득의 연결고리를 끊을 수 있는 차별적인 기전을 제시함으로써 혁신적인 치료 전략을 제공할 것으로 기대한다”고 전했다.
이번 연구 결과는 세포사멸의 권위있는 국제 학술지 `셀 데쓰 앤 디퍼런시에이션(Cell Death and Differentiation)’에 3월 7일 字 온라인판으로 게재됐다 (논문명: Cancer-intrinsic Cxcl5 orchestrates a global metabolic reprogramming for resistance to oxidative cell death in 3D). KAIST 생명과학과 서라민 박사가 제 1저자로 연구를 주도하였고, 서울대학교 Arvie Camille V. de Guzman 박사와 박성혁 교수, 그리고 한국표준과학연구원의 이지연 박사가 함께 연구에 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 개인기초연구사업(중견연구) 지원을 받아 수행됐다.
암세포 사멸과 연관된 대사를 관장하는 최상위인자 규명
우리 대학 생명과학과 강석조 교수 연구팀이 3차원 종양미세환경에서 성장한 암세포에서 유래한 케모카인(Chemokine) CXCL5가 암세포의 대사 리프로그래밍(reprogramming)을 조절하며 이를 통하여 지질 과산화물의 축적으로 인해 유도되는 세포 사멸인 페롭토시스(ferroptosis)에 대한 저항성을 획득한다고 7일 밝혔다.
CXCL5는 수용체인 CXCR2와의 결합을 통해 세포의 이동(migration) 및 침습(invasion)을 촉진하는 역할을 하는 케모카인으로, 종양미세환경에서 면역세포들의 침윤에 관여함이 알려져왔다. CXCL5는 여러 암종에서 발현이 증가되어 있음이 보고되었으나 실제 3차원 종양미세환경 내 암세포에서 유래한 CXCL5의 역할에 대해서는 밝혀진 바가 없다.
강 교수 연구팀은 세포외기질의 침착과 대식세포의 침투가 특징적인 암 미세환경을 모사하는 3차원 배양 시스템을 구축해 세포 간, 세포와 세포외기질 간 상호작용 뿐 아니라 종양미세환경 내 암세포의 위치에 따라 생장에 필요한 산소와 영양분의 접근성 차이로 인한 비세포적 요소가 형성될 수 있도록 유도하였다. 연구팀은 IFNγ자극을 받은 대식세포의 분비물이 3차원 환경 특이적으로 암세포의 CXCL5 발현을 증가시킴을 확인하였고, 야생형 암세포와 CXCL5 결손 암세포의 성장을 2차원, 3차원에서 비교한 결과 암세포의 CXCL5의 발현은 3차원 성장에만 필수적임을 확인하였다.
연구팀은 2차원 배양 암세포와 3차원 배양 암세포의 유전자 발현과 대사체를 비교하여 3차원에서 광범위한 대사 과정의 리프로그래밍이 일어남을 확인하였고, CXCL5가 이런 3차원 특이적 대사 리프로그래밍을 관장하는 핵심적 역할을 수행함을 보였다. 기전적으로 CXCL5는 전사인자 HIF-1a와 MYC의 발현을 유도하여 대사 리프로그래밍을 조절하며, 특히 여러 대사 과정 중 해당과정과 1-탄소 대사과정에 영향을 주는 것을 확인하였다.
또한, 연구팀은 저해된 해당과정과 1-탄소 대사과정이 산화-환원 항상성 조절에 중요한 역할을 한다는 이전 연구결과를 바탕으로, 세포 내 산화손상 정도를 측정한 결과 CXCL5 결손 시 미토콘드리아 활성산소와 철분에 의존하여 페롭토시스를 유발하는 지질 과산화물이 증가한 것을 확인하였다. 흥미롭게도 세포자멸사(apoptosis), 염증성 세포사멸인 파이롭토시스(pyroptosis), 그리고 구리 의존적 세포사멸인 큐프롭티시스(cuproptosis)는 CXCL5 결손에 의해 영향을 받지 않는 것을 밝혔다. 또한, HIF-1a와 MYC의 과발현은 CXCL5 결손 세포에서 보이는 활성산소와 지질 과산화물의 증가를 감소시키고 효과적으로 페롭토시스를 억제함을 확인하였다. CXCL5 수용체인 CXCR2를 결손시켰을 경우 동일하게 HIF-1a와 MYC의 발현이 저해되는 것을 확인함으로써, 암세포의 CXCL5-CXCR2 경로 억제를 통한 페롭토시스의 유도는 현재 개발 중인 세포자멸사 유도제의 한계를 극복할 새로운 전략이 될 수 있음을 시사하였다.
강석조 교수는 “본 연구는 3차원 종양미세환경 특이적인 암세포 대사를 보다 광범위하게 밝히고, 암세포에서 유래한 CXCL5가 HIF-1a와 MYC의 발현을 유도하여 3차원 성장을 위한 암대사 리프로그래밍을 총괄하는 지휘자적인 역할을 수행함을 새롭게 밝힌 연구”라고 언급하면서, “본 연구 성과는 암세포 대사 과정과 세포사멸 저항성 획득의 연결고리를 끊을 수 있는 차별적인 기전을 제시함으로써 혁신적인 치료 전략을 제공할 것으로 기대한다”고 전했다.
이번 연구 결과는 세포사멸의 권위있는 국제 학술지 `셀 데쓰 앤 디퍼런시에이션(Cell Death and Differentiation)’에 3월 7일 字 온라인판으로 게재됐다 (논문명: Cancer-intrinsic Cxcl5 orchestrates a global metabolic reprogramming for resistance to oxidative cell death in 3D). KAIST 생명과학과 서라민 박사가 제 1저자로 연구를 주도하였고, 서울대학교 Arvie Camille V. de Guzman 박사와 박성혁 교수, 그리고 한국표준과학연구원의 이지연 박사가 함께 연구에 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 개인기초연구사업(중견연구) 지원을 받아 수행됐다.
2025.03.07
조회수 3554
-
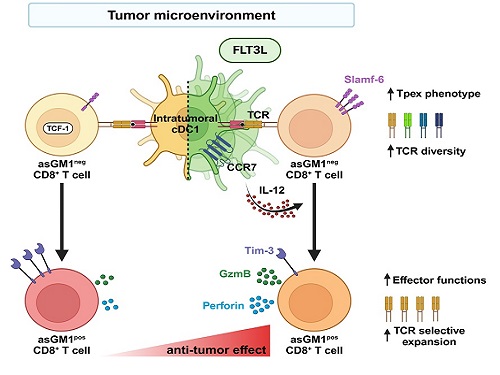 면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2025.01.07
조회수 3917
-
 원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18
조회수 4764
-
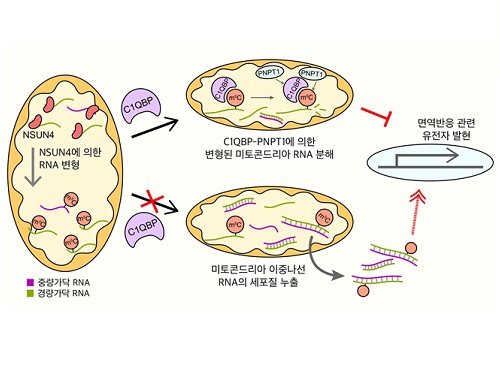 미토콘드리아로 퇴행성 질환까지 제어 가능하다
우리 대학 생명화학공학과 김유식 교수 연구팀이 비정상적 면역 활성을 유발해 염증반응이 동반된 세포 사멸을 일으키는 미토콘드리아 이중나선 RNA의 새로운 조절 기전을 찾아냈다고 22일 밝혔다.
최근 미토콘드리아 이중나선 RNA가 스트레스 환경에서 세포질로 빠져나가 비정상적 면역 활성 및 세포 사멸을 유발한다는 것이 밝혀졌다. 또한 이러한 미토콘드리아 이중나선 RNA로 촉발되는 면역 활성은 관절염 및 헌팅턴 무도병을 비롯한 염증반응이 동반된 퇴행성 질환과 자가면역질환 중 하나인 쇼그렌 증후군의 발병 및 진행에 핵심적인 역할을 한다는 것이 보고됐다.
아직 미토콘드리아 이중나선 RNA의 분자적 조절 기전에 대해서는 보고된 바 없다는 점을 착안해서 연구팀은 미토콘드리아 내에 존재하며 RNA와 결합할 수 있는 단백질에 대해 유전자 가위를 이용해 각 단백질의 발현을 억제한 후 미토콘드리아 이중나선 RNA의 발현량을 조사했다.
이 과정에서 RNA의 구성 물질 중 하나인 시토신의 화학적 변형을 유발하는 엔썬4(NSUN4)*이라는 단백질의 발현을 줄였을 때 미토콘드리아 이중나선 RNA의 발현이 유의미하게 증가하는 것을 확인했다.
*엔썬4 (NSUN4): NOP2/Sun RNA 메틸트랜스퍼라제 4
나아가, 연구팀은 단백질을 생산하지 않는 미토콘드리아 비암호화 RNA의 변형을 가속시키는 것이 동 단백질 엔썬4에 의해서라고 최초로 제시했다.
연구팀은 추가 연구를 통해 미토콘드리아 RNA 단백질들의 발현 감소로 축적된 미토콘드리아 이중나선 RNA의 양이 증가했으며 세포질로 누출된 미토콘드리아 이중나선 RNA는 면역반응을 활성화시켰다. 이를 통해 연구팀은 새로운 세포 내 면역 유발인자로 최근 주목받기 시작한 미토콘드리아 이중나선 RNA의 변형에 의한 발현 조절 기전을 제시했다.
생명화학공학과 김유식 교수는 “이번 연구를 통해 비정상적 면역 활성 유발 인자로 최근 주목받고 있는 미토콘드리아 이중나선 RNA의 형성 및 조절 기전을 밝혔다”면서 “이번 연구의 결과를 바탕으로 면역 계통 질환을 비롯해 다양한 퇴행성 질환의 발병 및 진행 과정을 효과적으로 제어할 수 있는 전략을 제시할 수 있을 것”이라고 말했다.
생명화학공학과 김수진 박사(現 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학(Harvard Medical School) 박사후연구원)와 탄 스테파니(Tan Stephanie) 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 7월 16일 字에 온라인 게재됐다. (논문명 : RNA 5-methylcytosine marks mitochondrial double-stranded RNAs for degradation and cytosolic release).
한편 이번 연구는 한국연구재단 우수신진연구지원사업과 미국 국립보건원의 지원으로 수행됐다.
미토콘드리아로 퇴행성 질환까지 제어 가능하다
우리 대학 생명화학공학과 김유식 교수 연구팀이 비정상적 면역 활성을 유발해 염증반응이 동반된 세포 사멸을 일으키는 미토콘드리아 이중나선 RNA의 새로운 조절 기전을 찾아냈다고 22일 밝혔다.
최근 미토콘드리아 이중나선 RNA가 스트레스 환경에서 세포질로 빠져나가 비정상적 면역 활성 및 세포 사멸을 유발한다는 것이 밝혀졌다. 또한 이러한 미토콘드리아 이중나선 RNA로 촉발되는 면역 활성은 관절염 및 헌팅턴 무도병을 비롯한 염증반응이 동반된 퇴행성 질환과 자가면역질환 중 하나인 쇼그렌 증후군의 발병 및 진행에 핵심적인 역할을 한다는 것이 보고됐다.
아직 미토콘드리아 이중나선 RNA의 분자적 조절 기전에 대해서는 보고된 바 없다는 점을 착안해서 연구팀은 미토콘드리아 내에 존재하며 RNA와 결합할 수 있는 단백질에 대해 유전자 가위를 이용해 각 단백질의 발현을 억제한 후 미토콘드리아 이중나선 RNA의 발현량을 조사했다.
이 과정에서 RNA의 구성 물질 중 하나인 시토신의 화학적 변형을 유발하는 엔썬4(NSUN4)*이라는 단백질의 발현을 줄였을 때 미토콘드리아 이중나선 RNA의 발현이 유의미하게 증가하는 것을 확인했다.
*엔썬4 (NSUN4): NOP2/Sun RNA 메틸트랜스퍼라제 4
나아가, 연구팀은 단백질을 생산하지 않는 미토콘드리아 비암호화 RNA의 변형을 가속시키는 것이 동 단백질 엔썬4에 의해서라고 최초로 제시했다.
연구팀은 추가 연구를 통해 미토콘드리아 RNA 단백질들의 발현 감소로 축적된 미토콘드리아 이중나선 RNA의 양이 증가했으며 세포질로 누출된 미토콘드리아 이중나선 RNA는 면역반응을 활성화시켰다. 이를 통해 연구팀은 새로운 세포 내 면역 유발인자로 최근 주목받기 시작한 미토콘드리아 이중나선 RNA의 변형에 의한 발현 조절 기전을 제시했다.
생명화학공학과 김유식 교수는 “이번 연구를 통해 비정상적 면역 활성 유발 인자로 최근 주목받고 있는 미토콘드리아 이중나선 RNA의 형성 및 조절 기전을 밝혔다”면서 “이번 연구의 결과를 바탕으로 면역 계통 질환을 비롯해 다양한 퇴행성 질환의 발병 및 진행 과정을 효과적으로 제어할 수 있는 전략을 제시할 수 있을 것”이라고 말했다.
생명화학공학과 김수진 박사(現 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학(Harvard Medical School) 박사후연구원)와 탄 스테파니(Tan Stephanie) 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 7월 16일 字에 온라인 게재됐다. (논문명 : RNA 5-methylcytosine marks mitochondrial double-stranded RNAs for degradation and cytosolic release).
한편 이번 연구는 한국연구재단 우수신진연구지원사업과 미국 국립보건원의 지원으로 수행됐다.
2024.07.22
조회수 5637
-
 암세포 약물반응 예측 ‘그레이박스’ 개발
지난 수십 년간 많은 의생명과학자의 집중적인 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 이처럼 암 치료가 난해한 이유는 환자마다 암 발생의 원인이 되는 유전자 돌연변이와 그로 인한 유전자 네트워크 변형이 서로 달라서 전통적인 실험생물학 접근만으로 표적치료를 적용하는 데에는 본질적인 한계가 있기 때문이다. 한편 딥러닝과 같은 소위 블랙박스(black-box) 방식의 인공지능 기술을 활용해 실험을 대체하고 데이터 학습을 통해 약물 반응을 예측할 수 있으나 이에 대한 생물학적 근거를 설명할 수 없어 결과를 신뢰하기 어려웠다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 인공지능과 시스템생물학을 융합해 암세포의 약물 반응 예측 및 메커니즘 분석을 동시에 이룰 수 있는 새로운 개념의 ‘그레이박스’ 기술을 개발했다고 3일 밝혔다.
조광현 교수 연구팀은 높은 예측 성능을 보이지만 그 근거를 알 수 없어 블랙박스로 불리는 딥러닝과 복잡한 대규모 모델의 경우 예측 성능의 한계를 지니지만 예측 결과에 대한 상세한 근거를 제시할 수 있어서 화이트박스로 불리는 시스템생물학 기술을 융합함으로써 두 기술의 한계를 동시에 극복할 수 있는 소위 ‘그레이박스’ 기술을 착안했다.
연구팀은 다양한 암종의 돌연변이 및 표적항암제 타겟 유전자 정보를 집대성해 분자 조절 네트워크 모델을 구축함으로써 여러 암종과 항암제의 약물 반응 예측에 활용될 수 있는 범용적 골격 모델을 우선 정립했다. 특히 다양한 암종에서 돌연변이가 빈번하게 발생하는 유전자들을 중심으로 전암(pan-cancer) 유전자 네트워크를 제작했고 표적항암제별 약물 반응과 관련된 돌연변이 및 연관 유전자들로 구성된 부분네트워크(sub-network)를 추출함으로써 약물 반응 예측을 위한 시스템생물학 모델을 제작했다.
연구팀은 이렇게 제작된 모델의 매개변수를 딥러닝 블랙박스 최적화기를 통해 결정하는 방식으로 트라메티닙, 아파티닙, 팔보시클립 세 개의 표적항암제 및 대장암, 유방암, 위암 세 개의 암종에 대한 그레이박스 모델을 구축했다. 완성된 모델의 약물 반응 컴퓨터시뮬레이션 결과는 각 암종별 약물반응의 민감도 차이를 보이는 세포주(cancer cell lines) 실험을 통해 비교 검증됐다.
특히 개발된 모델은 미국 국립암연구소(National Cancer Institute)의 돌연변이 정보 기반 약물 반응 예측으로는 동일한 반응을 보일 것으로 예상된 암세포주들이 실제로는 서로 다른 약물 반응을 보일 수 있다는 것을 정확히 예측했으며, 약물 반응의 차이가 발생하는 원인 또한 세포 주별 분자 네트워크 동역학의 차이로 상세히 설명할 수 있었다.
이번 연구 성과는 학습에 의한 시뮬레이션 모델 최적화를 통해 블랙박스 모델인 인공지능 기술의 높은 예측력과 화이트박스 모델인 시스템생물학 기술의 해석력을 동시에 달성한 새로운 약물 반응 예측 기술 개발이어서 그 의미가 크다. 특히, 발생 원인이 이질적이고 복잡한 네트워크 질환인 암에 대해 범용적으로 활용가능한 약물 반응 예측 원천기술이므로 향후 기술 고도화를 통해 다양한 종류의 암종 및 환자 맞춤형 치료 전략 제시에 활용될 수 있을 것으로 기대된다.
조광현 교수는 "인공지능 기술의 높은 예측력과 시스템생물학 기술의 우수한 해석력을 동시에 갖춘 새로운 융합원천기술로서 향후 고도화를 통해 신약 개발 산업의 활용이 기대된다ˮ고 말했다.
바이오및뇌공학과 김윤성 박사, 한영현 박사 등이 참여한 이번 연구 결과는 셀 프레스(Cell Press)에서 출간하는 국제저널 `셀 리포트 메소드(Cell Reports Methods)' 5월 20일 字 표지논문으로 출판됐다. (논문명: A grey box framework that optimizes a white box logical model using a black box optimizer for simulating cellular responses to perturbations)
논문링크: https://www.cell.com/cell-reports-methods/fulltext/S2667-2375(24)00117-6
한편 이번 연구는 삼성미래기술육성사업 및 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
암세포 약물반응 예측 ‘그레이박스’ 개발
지난 수십 년간 많은 의생명과학자의 집중적인 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 이처럼 암 치료가 난해한 이유는 환자마다 암 발생의 원인이 되는 유전자 돌연변이와 그로 인한 유전자 네트워크 변형이 서로 달라서 전통적인 실험생물학 접근만으로 표적치료를 적용하는 데에는 본질적인 한계가 있기 때문이다. 한편 딥러닝과 같은 소위 블랙박스(black-box) 방식의 인공지능 기술을 활용해 실험을 대체하고 데이터 학습을 통해 약물 반응을 예측할 수 있으나 이에 대한 생물학적 근거를 설명할 수 없어 결과를 신뢰하기 어려웠다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 인공지능과 시스템생물학을 융합해 암세포의 약물 반응 예측 및 메커니즘 분석을 동시에 이룰 수 있는 새로운 개념의 ‘그레이박스’ 기술을 개발했다고 3일 밝혔다.
조광현 교수 연구팀은 높은 예측 성능을 보이지만 그 근거를 알 수 없어 블랙박스로 불리는 딥러닝과 복잡한 대규모 모델의 경우 예측 성능의 한계를 지니지만 예측 결과에 대한 상세한 근거를 제시할 수 있어서 화이트박스로 불리는 시스템생물학 기술을 융합함으로써 두 기술의 한계를 동시에 극복할 수 있는 소위 ‘그레이박스’ 기술을 착안했다.
연구팀은 다양한 암종의 돌연변이 및 표적항암제 타겟 유전자 정보를 집대성해 분자 조절 네트워크 모델을 구축함으로써 여러 암종과 항암제의 약물 반응 예측에 활용될 수 있는 범용적 골격 모델을 우선 정립했다. 특히 다양한 암종에서 돌연변이가 빈번하게 발생하는 유전자들을 중심으로 전암(pan-cancer) 유전자 네트워크를 제작했고 표적항암제별 약물 반응과 관련된 돌연변이 및 연관 유전자들로 구성된 부분네트워크(sub-network)를 추출함으로써 약물 반응 예측을 위한 시스템생물학 모델을 제작했다.
연구팀은 이렇게 제작된 모델의 매개변수를 딥러닝 블랙박스 최적화기를 통해 결정하는 방식으로 트라메티닙, 아파티닙, 팔보시클립 세 개의 표적항암제 및 대장암, 유방암, 위암 세 개의 암종에 대한 그레이박스 모델을 구축했다. 완성된 모델의 약물 반응 컴퓨터시뮬레이션 결과는 각 암종별 약물반응의 민감도 차이를 보이는 세포주(cancer cell lines) 실험을 통해 비교 검증됐다.
특히 개발된 모델은 미국 국립암연구소(National Cancer Institute)의 돌연변이 정보 기반 약물 반응 예측으로는 동일한 반응을 보일 것으로 예상된 암세포주들이 실제로는 서로 다른 약물 반응을 보일 수 있다는 것을 정확히 예측했으며, 약물 반응의 차이가 발생하는 원인 또한 세포 주별 분자 네트워크 동역학의 차이로 상세히 설명할 수 있었다.
이번 연구 성과는 학습에 의한 시뮬레이션 모델 최적화를 통해 블랙박스 모델인 인공지능 기술의 높은 예측력과 화이트박스 모델인 시스템생물학 기술의 해석력을 동시에 달성한 새로운 약물 반응 예측 기술 개발이어서 그 의미가 크다. 특히, 발생 원인이 이질적이고 복잡한 네트워크 질환인 암에 대해 범용적으로 활용가능한 약물 반응 예측 원천기술이므로 향후 기술 고도화를 통해 다양한 종류의 암종 및 환자 맞춤형 치료 전략 제시에 활용될 수 있을 것으로 기대된다.
조광현 교수는 "인공지능 기술의 높은 예측력과 시스템생물학 기술의 우수한 해석력을 동시에 갖춘 새로운 융합원천기술로서 향후 고도화를 통해 신약 개발 산업의 활용이 기대된다ˮ고 말했다.
바이오및뇌공학과 김윤성 박사, 한영현 박사 등이 참여한 이번 연구 결과는 셀 프레스(Cell Press)에서 출간하는 국제저널 `셀 리포트 메소드(Cell Reports Methods)' 5월 20일 字 표지논문으로 출판됐다. (논문명: A grey box framework that optimizes a white box logical model using a black box optimizer for simulating cellular responses to perturbations)
논문링크: https://www.cell.com/cell-reports-methods/fulltext/S2667-2375(24)00117-6
한편 이번 연구는 삼성미래기술육성사업 및 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2024.06.03
조회수 7631
-
 방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15
조회수 7338
-
 암, 루게릭병 등 난치성 질환 발병 기전 밝혀
단백질 정보를 가진 mRNA 유전자 조절 기전에서 알루 요소(Alu)의 중요성을 제시하고, 나아가 종양 형성, 퇴행성 뇌질환 등 mRNA가 변화하는 다양한 질환에서 역방향 알루 반복구조(IRAlus)라는 새로운 발병 원인을 최초로 제시함으로써 질병 치료에 획기적인 방안을 제시하였다.
우리 대학 생명화학공학과 김유식 교수와 바이오및뇌공학과 이영석 교수 공동 연구팀이 종양 형성과 퇴행성 뇌질환을 유발하는 새로운 유전자 조절 기전을 찾아냈다고 6일 밝혔다.
인간 유전체의 약 10%를 차지하는 반복서열인 알루 요소(Alu element, Alu)는 단백질 정보를 가지는 전령 RNA(messenger RNA, mRNA)의 단백질 생산 효율을 조절할 수 있다. 특히, mRNA가 2개의 알루 요소로 형성된 역방향 알루 반복 구조(Inverted Alu repeats, IRAlus)를 가지게 되면 mRNA의 세포 내 이동이 방해되어 단백질 생산이 감소한다.
연구팀은 질환 특이적으로 mRNA가 변화하는 과정에서 주요 mRNA가 역방향 알루 반복 구조(IRAlus)에 의해 조절받게 하고 이는 mRNA가 가지고 있는 유전자 발현 억제로 이어져 질환을 일으킨다는 새로운 발병 기전을 밝혔다.
알루(Alu)는 유전체의 단백질 정보를 가지고 있지만 유전체 상에서 본인의 서열만을 복제하는 성질이 있어 ‘이기적 서열’로 알려져 있었다. 최근 연구에 의하면 mRNA 내의 존재하는 역방향 알루 반복 구조(IRAlus)는 숙주 mRNA의 세포질로의 이동을 방해하여 해당 유전자의 단백질 번역을 억제한다. 그러나, 해당 유전자 발현 조절 기전의 생물학적 중요성에 대해서는 보고된 바가 없었다.
연구팀은 역방향 알루 반복 구조(IRAlus)를 인지할 수 있는 항체를 활용한 차세대 염기서열 분석법을 사용해 특정 세포 내 활성화된, 기능적인 역방향 알루 반복 구조(IRAlus)를 가지고 있어 역방향 알루 반복 구조(IRAlus)에 의해 단백질 합성이 억제될 수 있는 mRNA 유전자 목록을 완성했다.
종양 형성 과정에서 역방향 알루 반복 구조(IRAlus)의 유전자 조절 기전의 영향을 분석했다. 연구팀은 대표적인 종양억제유전자를 억제하는 종양 유전자 조절을 하고 이는 단백질 발현 증가로 이어지며 결과적으로 종양억제유전자 활성이 억제됨으로써 암 발달을 촉진할 수 있다.
나아가, 특정 mRNA 서열과 상보적으로 결합해 mRNA의 기능을 억제해 다양한 질병 치료 및 조절 도구로 현재 연구되고 있는 혁신 RNA 치료제인 안티센스 올리고뉴클레오타이드(Antisense oligonucleotide, 이하 ASO)를 활용해 단백질 발현을 복구하는 암 치료 전략을 탐색했다.
연구팀은 신경계 세포에서 역방향 알루 반복 구조(IRAlus)로 인한 유전자 조절이 활발하다는 것을 확인했다. 또한, 해당 현상의 과도한 활성과 루게릭병으로 알려진 근위축성 측삭경화증을 비롯한 퇴행성 뇌질환 간의 연관성을 최초로 제시했다.
생명화학공학과 김유식 교수는 “이번 연구는 인간 유전체 내 반복서열인 역방향 알루 반복 구조(IRAlus)를 가지는 유전자를 목록화하는 것을 넘어서 해당 유전자 발현 조절이 인간 질환, 특히 종양 형성 및 퇴행성 뇌질환 발병과정에서 핵심적인 역할을 하는 것을 최초로 확인했다”면서 “이번 연구에서 제시한 역방향 알루 반복 구조(IRAlus)라는 새로운 타겟 물질을 활용하면 종양과 노화를 비롯해 다양한 퇴행성 질환의 발병 기전 분석에 근본적이고 효과적인 치료전략을 마련하는 데 유용할 것”이라고 말했다.
생명화학공학과 구자영 박사(현 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학 (Harvard Medical School) 박사후연구원)와 이건용 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 2월 2일 字에 온라인 게재됐다. (논문명 : Alternative Polyadenylation Determines the Functional Landscape of Inverted Alu Repeats).
우리 대학 생명과학과 임정훈 교수 연구팀과 의과학대학원 한진주 교수 연구팀이 참여한 이번 연구는 한국연구재단 기초연구실 지원사업과 KAIST 도약연구사업의 지원을 받아 수행됐다.
암, 루게릭병 등 난치성 질환 발병 기전 밝혀
단백질 정보를 가진 mRNA 유전자 조절 기전에서 알루 요소(Alu)의 중요성을 제시하고, 나아가 종양 형성, 퇴행성 뇌질환 등 mRNA가 변화하는 다양한 질환에서 역방향 알루 반복구조(IRAlus)라는 새로운 발병 원인을 최초로 제시함으로써 질병 치료에 획기적인 방안을 제시하였다.
우리 대학 생명화학공학과 김유식 교수와 바이오및뇌공학과 이영석 교수 공동 연구팀이 종양 형성과 퇴행성 뇌질환을 유발하는 새로운 유전자 조절 기전을 찾아냈다고 6일 밝혔다.
인간 유전체의 약 10%를 차지하는 반복서열인 알루 요소(Alu element, Alu)는 단백질 정보를 가지는 전령 RNA(messenger RNA, mRNA)의 단백질 생산 효율을 조절할 수 있다. 특히, mRNA가 2개의 알루 요소로 형성된 역방향 알루 반복 구조(Inverted Alu repeats, IRAlus)를 가지게 되면 mRNA의 세포 내 이동이 방해되어 단백질 생산이 감소한다.
연구팀은 질환 특이적으로 mRNA가 변화하는 과정에서 주요 mRNA가 역방향 알루 반복 구조(IRAlus)에 의해 조절받게 하고 이는 mRNA가 가지고 있는 유전자 발현 억제로 이어져 질환을 일으킨다는 새로운 발병 기전을 밝혔다.
알루(Alu)는 유전체의 단백질 정보를 가지고 있지만 유전체 상에서 본인의 서열만을 복제하는 성질이 있어 ‘이기적 서열’로 알려져 있었다. 최근 연구에 의하면 mRNA 내의 존재하는 역방향 알루 반복 구조(IRAlus)는 숙주 mRNA의 세포질로의 이동을 방해하여 해당 유전자의 단백질 번역을 억제한다. 그러나, 해당 유전자 발현 조절 기전의 생물학적 중요성에 대해서는 보고된 바가 없었다.
연구팀은 역방향 알루 반복 구조(IRAlus)를 인지할 수 있는 항체를 활용한 차세대 염기서열 분석법을 사용해 특정 세포 내 활성화된, 기능적인 역방향 알루 반복 구조(IRAlus)를 가지고 있어 역방향 알루 반복 구조(IRAlus)에 의해 단백질 합성이 억제될 수 있는 mRNA 유전자 목록을 완성했다.
종양 형성 과정에서 역방향 알루 반복 구조(IRAlus)의 유전자 조절 기전의 영향을 분석했다. 연구팀은 대표적인 종양억제유전자를 억제하는 종양 유전자 조절을 하고 이는 단백질 발현 증가로 이어지며 결과적으로 종양억제유전자 활성이 억제됨으로써 암 발달을 촉진할 수 있다.
나아가, 특정 mRNA 서열과 상보적으로 결합해 mRNA의 기능을 억제해 다양한 질병 치료 및 조절 도구로 현재 연구되고 있는 혁신 RNA 치료제인 안티센스 올리고뉴클레오타이드(Antisense oligonucleotide, 이하 ASO)를 활용해 단백질 발현을 복구하는 암 치료 전략을 탐색했다.
연구팀은 신경계 세포에서 역방향 알루 반복 구조(IRAlus)로 인한 유전자 조절이 활발하다는 것을 확인했다. 또한, 해당 현상의 과도한 활성과 루게릭병으로 알려진 근위축성 측삭경화증을 비롯한 퇴행성 뇌질환 간의 연관성을 최초로 제시했다.
생명화학공학과 김유식 교수는 “이번 연구는 인간 유전체 내 반복서열인 역방향 알루 반복 구조(IRAlus)를 가지는 유전자를 목록화하는 것을 넘어서 해당 유전자 발현 조절이 인간 질환, 특히 종양 형성 및 퇴행성 뇌질환 발병과정에서 핵심적인 역할을 하는 것을 최초로 확인했다”면서 “이번 연구에서 제시한 역방향 알루 반복 구조(IRAlus)라는 새로운 타겟 물질을 활용하면 종양과 노화를 비롯해 다양한 퇴행성 질환의 발병 기전 분석에 근본적이고 효과적인 치료전략을 마련하는 데 유용할 것”이라고 말했다.
생명화학공학과 구자영 박사(현 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학 (Harvard Medical School) 박사후연구원)와 이건용 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 2월 2일 字에 온라인 게재됐다. (논문명 : Alternative Polyadenylation Determines the Functional Landscape of Inverted Alu Repeats).
우리 대학 생명과학과 임정훈 교수 연구팀과 의과학대학원 한진주 교수 연구팀이 참여한 이번 연구는 한국연구재단 기초연구실 지원사업과 KAIST 도약연구사업의 지원을 받아 수행됐다.
2024.02.06
조회수 6710
-
 인공지능으로 인간 추론 능력 극대화시키다
최근 인공지능 기술이 인식, 생성, 제어, 대화와 같은 실제 문제를 빠르게 해결해 나감에 따라 인간의 역할과 일자리 생태계가 변화하고 있다. 인공지능의 발전 속도를 본다면 가까운 미래에는 인공지능이 인간보다 똑똑해질 수도 있다. 이와 반대로 인공지능을 이용해 인간의 사고력 자체를 향상시킬 순 없을까?
우리 대학 뇌인지과학과 이상완 교수(신경과학-인공지능 융합연구센터장) 연구팀이 인간의 빠른 추론 능력을 유도해 인과관계의 학습 효율을 향상할 수 있는 뇌 기반 인공지능 기술 개발에 성공했다고 31일 밝혔다.
우리는 일상생활에서 다양한 사건을 경험하며 세상의 다양한 요소에 대한 인과관계를 학습해 나가고, 공부할 때는 지식 조각들을 조합하며 통합적인 지식을 습득한다. 이러한 과정은 점진적으로 추론하는 베이시안 모델 또는 특정한 상황에서 한 번의 경험으로부터 빠르게 결론을 도출하는 고속추론 또는 원샷 추론이 있다.
연구팀은 이전 연구에서 인간의 원샷 추론 과정을 모델링하고 전두엽과 해마가 이러한 과정에 관여하고 있음을 규명한 바 있다. 이번 연구에서 이 모델에 인간의 원샷 추론 과정을 특정한 상태로 유도하기 위해 알파고에 사용된 바 있는 심층 강화학습 기술을 접목했다. 이는 강화학습 알고리즘이 인간의 원샷 추론 과정을 수없이 시뮬레이션하면서 전두엽과 해마가 가장 효율적으로 학습할 수 있는 최적의 조건을 탐색하는 과정으로 볼 수 있다.
연구팀은 126명의 인간 피험자를 대상으로 한 인과관계 학습 및 추론 실험에서 제안 기술을 사용해 학습했을 때 단순 반복 학습 대비 최대 약 40%까지 학습 효율이 향상됨을 보였다. 더 나아가 오랜 시간에 걸쳐 신중하게 학습하거나 몇 가지 단서만을 조합해 빠르게 결론을 도출하는 것 같은 개인별 학습 성향을 고려한 맞춤형 설계가 가능함을 보였다.
인간의 사고체계에 대한 뇌과학적인 이해를 바탕으로 원샷 추론과 같은 인간의 잠재적 능력을 극대화하는 이 기술은 차세대 인공지능의 중요한 도전과제 중 하나이며, 뇌 기반 인공지능 기술은 인간과 유사한 사고체계를 바탕으로 가치판단을 할 수 있으므로 장기적으로 인간과 인공지능이 협업하는 분야에서 인공지능의 신뢰성 및 윤리성을 높이는 데도 기여할 수 있을 것으로 기대된다.
개발 기술은 스마트 교육, 게임 콘텐츠 개발, 추론 능력 측정, 인지훈련 등 인간의 추론 학습과 관련된 모든 분야에 적용될 수 있다. 기존 기술은 단편적인 기억회상, 특정 인지기능, 정답률 증가와 같은 행동적 측면에 집중해 왔다면, 이번 기술은 인공지능을 이용해 과거의 경험을 일반화시키는 인간의 사고체계 자체를 높이는 가능성을 확인한 최초의 사례로 평가된다.
KAIST에서 연구를 주도한 제1 저자 이지항 교수(현 상명대 서울캠퍼스 조교수)는 "이번 연구를 통해 인간의 인지기능을 인공지능에 이식하여 뇌 기반 인공지능을 실현하는 사례를 보였고, 이를 통해 인간의 고위 수준 인지를 적절한 방향으로 유도할 수 있는 새로운 인간-인공지능 상호작용 패러다임을 제시했다ˮ라고 강조하며, 추후 "인간중심 인공지능 연구 개발뿐만 아니라 바이오메디컬 분야, 특히 정신 건강과 관련된 디지털 치료 분야에 적용했을 때 큰 파급력을 보일 것ˮ이라고 말했다.
연구 책임자인 이상완 교수는 "이번 기술의 잠재력은 인공지능의 방대한 지식을 인간이 빠르게 흡수할 수 있는 형태로 변환할 수 있다는 데 있다ˮ며, "챗 GPT, GPT-4와 같은 언어 인공지능에서 추출되는 다양한 정보를 인간이 빠르게 추론 학습할 수 있게 변환하거나, 게임이나 가상현실의 콘텐츠를 인간의 추론 과정에 맞게 최적화해 몰입도를 높일 수 있고, 반대로 몰입도를 적절한 수준에서 제어할 경우 중독을 완화하는 효과를 기대할 수 있다ˮ라고 말했다.
관련 기술은 국내 및 해외에 특허 출원된 상태이며, KAIST 기술설명회(테크페어)에 소개된 바 있다. 이상완 교수 연구팀은 이러한 뇌 기반 인공지능 원천기술의 파급력을 높이기 위해 2019년 KAIST 신경과학-인공지능 융합연구센터를 설립하고, 구글 딥마인드, 마이크로소프트 연구소, IBM 연구소, 옥스퍼드 대학 등 다양한 해외 연구팀들과 함께 국제공동연구를 수행해 오고 있다.
이번 연구는 `시뮬레이션 기반 실험 디자인을 이용한 인간의 인과관계 추론과정 제어'라는 제목으로 국제 학술지 셀(Cell)의 오픈 액세스 저널인 `셀 리포트(Cell Reports)'에 1월 호 온라인판에 1월 30일 자 게재됐다. (논문명: Controlling human causal inference through in-silico task design)
한편 이번 연구는 삼성전자 미래기술육성센터, 과학기술정보통신부 정보통신기획평가원 SW스타랩 및 한국연구재단의 지원을 받아 수행됐다.
인공지능으로 인간 추론 능력 극대화시키다
최근 인공지능 기술이 인식, 생성, 제어, 대화와 같은 실제 문제를 빠르게 해결해 나감에 따라 인간의 역할과 일자리 생태계가 변화하고 있다. 인공지능의 발전 속도를 본다면 가까운 미래에는 인공지능이 인간보다 똑똑해질 수도 있다. 이와 반대로 인공지능을 이용해 인간의 사고력 자체를 향상시킬 순 없을까?
우리 대학 뇌인지과학과 이상완 교수(신경과학-인공지능 융합연구센터장) 연구팀이 인간의 빠른 추론 능력을 유도해 인과관계의 학습 효율을 향상할 수 있는 뇌 기반 인공지능 기술 개발에 성공했다고 31일 밝혔다.
우리는 일상생활에서 다양한 사건을 경험하며 세상의 다양한 요소에 대한 인과관계를 학습해 나가고, 공부할 때는 지식 조각들을 조합하며 통합적인 지식을 습득한다. 이러한 과정은 점진적으로 추론하는 베이시안 모델 또는 특정한 상황에서 한 번의 경험으로부터 빠르게 결론을 도출하는 고속추론 또는 원샷 추론이 있다.
연구팀은 이전 연구에서 인간의 원샷 추론 과정을 모델링하고 전두엽과 해마가 이러한 과정에 관여하고 있음을 규명한 바 있다. 이번 연구에서 이 모델에 인간의 원샷 추론 과정을 특정한 상태로 유도하기 위해 알파고에 사용된 바 있는 심층 강화학습 기술을 접목했다. 이는 강화학습 알고리즘이 인간의 원샷 추론 과정을 수없이 시뮬레이션하면서 전두엽과 해마가 가장 효율적으로 학습할 수 있는 최적의 조건을 탐색하는 과정으로 볼 수 있다.
연구팀은 126명의 인간 피험자를 대상으로 한 인과관계 학습 및 추론 실험에서 제안 기술을 사용해 학습했을 때 단순 반복 학습 대비 최대 약 40%까지 학습 효율이 향상됨을 보였다. 더 나아가 오랜 시간에 걸쳐 신중하게 학습하거나 몇 가지 단서만을 조합해 빠르게 결론을 도출하는 것 같은 개인별 학습 성향을 고려한 맞춤형 설계가 가능함을 보였다.
인간의 사고체계에 대한 뇌과학적인 이해를 바탕으로 원샷 추론과 같은 인간의 잠재적 능력을 극대화하는 이 기술은 차세대 인공지능의 중요한 도전과제 중 하나이며, 뇌 기반 인공지능 기술은 인간과 유사한 사고체계를 바탕으로 가치판단을 할 수 있으므로 장기적으로 인간과 인공지능이 협업하는 분야에서 인공지능의 신뢰성 및 윤리성을 높이는 데도 기여할 수 있을 것으로 기대된다.
개발 기술은 스마트 교육, 게임 콘텐츠 개발, 추론 능력 측정, 인지훈련 등 인간의 추론 학습과 관련된 모든 분야에 적용될 수 있다. 기존 기술은 단편적인 기억회상, 특정 인지기능, 정답률 증가와 같은 행동적 측면에 집중해 왔다면, 이번 기술은 인공지능을 이용해 과거의 경험을 일반화시키는 인간의 사고체계 자체를 높이는 가능성을 확인한 최초의 사례로 평가된다.
KAIST에서 연구를 주도한 제1 저자 이지항 교수(현 상명대 서울캠퍼스 조교수)는 "이번 연구를 통해 인간의 인지기능을 인공지능에 이식하여 뇌 기반 인공지능을 실현하는 사례를 보였고, 이를 통해 인간의 고위 수준 인지를 적절한 방향으로 유도할 수 있는 새로운 인간-인공지능 상호작용 패러다임을 제시했다ˮ라고 강조하며, 추후 "인간중심 인공지능 연구 개발뿐만 아니라 바이오메디컬 분야, 특히 정신 건강과 관련된 디지털 치료 분야에 적용했을 때 큰 파급력을 보일 것ˮ이라고 말했다.
연구 책임자인 이상완 교수는 "이번 기술의 잠재력은 인공지능의 방대한 지식을 인간이 빠르게 흡수할 수 있는 형태로 변환할 수 있다는 데 있다ˮ며, "챗 GPT, GPT-4와 같은 언어 인공지능에서 추출되는 다양한 정보를 인간이 빠르게 추론 학습할 수 있게 변환하거나, 게임이나 가상현실의 콘텐츠를 인간의 추론 과정에 맞게 최적화해 몰입도를 높일 수 있고, 반대로 몰입도를 적절한 수준에서 제어할 경우 중독을 완화하는 효과를 기대할 수 있다ˮ라고 말했다.
관련 기술은 국내 및 해외에 특허 출원된 상태이며, KAIST 기술설명회(테크페어)에 소개된 바 있다. 이상완 교수 연구팀은 이러한 뇌 기반 인공지능 원천기술의 파급력을 높이기 위해 2019년 KAIST 신경과학-인공지능 융합연구센터를 설립하고, 구글 딥마인드, 마이크로소프트 연구소, IBM 연구소, 옥스퍼드 대학 등 다양한 해외 연구팀들과 함께 국제공동연구를 수행해 오고 있다.
이번 연구는 `시뮬레이션 기반 실험 디자인을 이용한 인간의 인과관계 추론과정 제어'라는 제목으로 국제 학술지 셀(Cell)의 오픈 액세스 저널인 `셀 리포트(Cell Reports)'에 1월 호 온라인판에 1월 30일 자 게재됐다. (논문명: Controlling human causal inference through in-silico task design)
한편 이번 연구는 삼성전자 미래기술육성센터, 과학기술정보통신부 정보통신기획평가원 SW스타랩 및 한국연구재단의 지원을 받아 수행됐다.
2024.01.31
조회수 7380
-
 화학공장 대체 방안 ‘아이브릿지’에서 찾다
기후 변화와 환경 문제가 심각하게 대두됨에 따라 현재의 화학 공장을 대체할 수 있는 지속가능한 미생물 세포공장이 크게 주목받고 있다. 미생물 세포공장으로 활용할 미생물을 개량하기 위해선 미생물이 가진 유전자들의 발현을 증폭 또는 억제해 유용한 화합물을 생산하도록 미생물 대사 메커니즘을 개량해야 하지만, 어떠한 유전자를 증폭하고 억제할 것인지 결정하는 것은 지금까지 어려운 문제로 남아있다.
우리 대학 이상엽 특훈교수 연구팀이 아이브릿지(iBridge)라는 시뮬레이션 프로그램을 개발하여 생산하고자 하는 화합물에 맞춤형 미생물 공장을 구축할 수 있도록 과발현 및 억제 유전자들을 예측함으로써 미생물 공장을 적은 비용으로 빠르고 효율적으로 구축하는 방법을 제시했다고 9일 밝혔다.
이상엽 특훈교수가 창시한 시스템 대사공학은 유전공학, 합성생물학, 시스템생물학, 발효공학 등을 접목해 개량한 미생물을 이용해 유용한 화합물들을 생산하는 분야다. 미생물을 목표로 하는 유용한 화합물을 생산하도록 개량하기 위해선 미생물의 유전자들을 삭제, 발현억제, 과발현 등이 필수적이지만, 이를 일일이 실험적으로 확인하지 않고서는 여전히 전문가들조차 판별하기 어려워 많은 시간과 자원이 소모된다.
연구팀은 신규 개발된 아이브릿지(iBridge) 시뮬레이션을 활용해 세 가지의 유용한 화합물을 세계 최고 수준으로 생산하는 대장균 미생물 세포공장을 구축하는 데 성공했다. 연구팀은 많은 화장품에서 보습제 역할을 하는 판테놀, 나일론의 원료인 퓨트레신, 항균성 식품첨가제인 4-하이드록시페닐젖산 등을 생산하는 대장균 균주를 개발하고, 신규 개발된 시뮬레이션 아이브릿지(iBridge)를 활용해 세계 최고 농도로 이들 화합물을 생산하는 공정을 개발했다. 그뿐만 아니라 연구팀은 이들 세 가지 외에도 산업적으로 유용한 화합물 298 여종의 미생물 공장을 구축하기 위한 과발현 및 억제 유전자들을 예측해 제시했다.
이번 논문의 공동 제1 저자인 우리 대학 이영준 박사는 “이번에 개발된 시뮬레이션을 이용하니 여러 가지 미생물 공장들이 기존방법보다 월등히 빠른 속도로 구축됐다”며 “더 다양한 유용한 화합물들을 생산하는 미생물 세포공장들이 이 기술을 활용해 빠르게 구축될 수 있을 것”이라고 말했다.
또한 이상엽 특훈교수는 “시스템 대사공학은 현재 우리가 해결해야 할 기후변화문제에 접근하는 매우 중요한 기술”이라며 “이 시뮬레이션은 기존의 화학 공장을 친환경 미생물 공장으로 대체하는 시기를 앞당기는 데 크게 기여할 수 있을 것”이라고 밝혔다.
생물공정연구센터 김원준 박사, 이영준 박사, 생명화학공학과 김현욱 교수와 이상엽 특훈교수가 참여한 이번 논문은 셀 (Cell) 誌가 발행하는 `셀 시스템즈 (Cell Systems)'에 동료심사를 거쳐 11월 6일 온라인판에 게재됐다.
※ 논문명 : 세포 내 화학반응 속도의 공분산의 합을 활용한 게놈 수준 과발현 및 억제 유전자 예측 (Genome-Wide Identification of Overexpression and Downregulation Gene Targets Based on the Sum of Covariances of the Outgoing Reaction Fluxes)
※ 저자 정보 : 김원준 (한국과학기술원, 공동 제1 저자), 이영준 (한국과학기술원, 공동 제1 저자), 김현욱 (한국과학기술원, 공동 제1 저자) 및 이상엽(한국과학기술원, 교신저자) 포함 총 6 명
한편, 이번 연구는 과기정통부가 지원하는 ‘석유대체 친환경 화학기술개발사업의 ‘바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발’ 과제(과제책임자 KAIST 이상엽 특훈교수) 및 바이오매스기반 탄소중립형 바이오플라스틱 제품기술개발사업’ 과제(과제책임자 KAIST 최소영 연구교수)의 지원을 받아 수행됐다.
아이브릿지 사이트: https://github.com/kaistsystemsbiology/iBridge.git
화학공장 대체 방안 ‘아이브릿지’에서 찾다
기후 변화와 환경 문제가 심각하게 대두됨에 따라 현재의 화학 공장을 대체할 수 있는 지속가능한 미생물 세포공장이 크게 주목받고 있다. 미생물 세포공장으로 활용할 미생물을 개량하기 위해선 미생물이 가진 유전자들의 발현을 증폭 또는 억제해 유용한 화합물을 생산하도록 미생물 대사 메커니즘을 개량해야 하지만, 어떠한 유전자를 증폭하고 억제할 것인지 결정하는 것은 지금까지 어려운 문제로 남아있다.
우리 대학 이상엽 특훈교수 연구팀이 아이브릿지(iBridge)라는 시뮬레이션 프로그램을 개발하여 생산하고자 하는 화합물에 맞춤형 미생물 공장을 구축할 수 있도록 과발현 및 억제 유전자들을 예측함으로써 미생물 공장을 적은 비용으로 빠르고 효율적으로 구축하는 방법을 제시했다고 9일 밝혔다.
이상엽 특훈교수가 창시한 시스템 대사공학은 유전공학, 합성생물학, 시스템생물학, 발효공학 등을 접목해 개량한 미생물을 이용해 유용한 화합물들을 생산하는 분야다. 미생물을 목표로 하는 유용한 화합물을 생산하도록 개량하기 위해선 미생물의 유전자들을 삭제, 발현억제, 과발현 등이 필수적이지만, 이를 일일이 실험적으로 확인하지 않고서는 여전히 전문가들조차 판별하기 어려워 많은 시간과 자원이 소모된다.
연구팀은 신규 개발된 아이브릿지(iBridge) 시뮬레이션을 활용해 세 가지의 유용한 화합물을 세계 최고 수준으로 생산하는 대장균 미생물 세포공장을 구축하는 데 성공했다. 연구팀은 많은 화장품에서 보습제 역할을 하는 판테놀, 나일론의 원료인 퓨트레신, 항균성 식품첨가제인 4-하이드록시페닐젖산 등을 생산하는 대장균 균주를 개발하고, 신규 개발된 시뮬레이션 아이브릿지(iBridge)를 활용해 세계 최고 농도로 이들 화합물을 생산하는 공정을 개발했다. 그뿐만 아니라 연구팀은 이들 세 가지 외에도 산업적으로 유용한 화합물 298 여종의 미생물 공장을 구축하기 위한 과발현 및 억제 유전자들을 예측해 제시했다.
이번 논문의 공동 제1 저자인 우리 대학 이영준 박사는 “이번에 개발된 시뮬레이션을 이용하니 여러 가지 미생물 공장들이 기존방법보다 월등히 빠른 속도로 구축됐다”며 “더 다양한 유용한 화합물들을 생산하는 미생물 세포공장들이 이 기술을 활용해 빠르게 구축될 수 있을 것”이라고 말했다.
또한 이상엽 특훈교수는 “시스템 대사공학은 현재 우리가 해결해야 할 기후변화문제에 접근하는 매우 중요한 기술”이라며 “이 시뮬레이션은 기존의 화학 공장을 친환경 미생물 공장으로 대체하는 시기를 앞당기는 데 크게 기여할 수 있을 것”이라고 밝혔다.
생물공정연구센터 김원준 박사, 이영준 박사, 생명화학공학과 김현욱 교수와 이상엽 특훈교수가 참여한 이번 논문은 셀 (Cell) 誌가 발행하는 `셀 시스템즈 (Cell Systems)'에 동료심사를 거쳐 11월 6일 온라인판에 게재됐다.
※ 논문명 : 세포 내 화학반응 속도의 공분산의 합을 활용한 게놈 수준 과발현 및 억제 유전자 예측 (Genome-Wide Identification of Overexpression and Downregulation Gene Targets Based on the Sum of Covariances of the Outgoing Reaction Fluxes)
※ 저자 정보 : 김원준 (한국과학기술원, 공동 제1 저자), 이영준 (한국과학기술원, 공동 제1 저자), 김현욱 (한국과학기술원, 공동 제1 저자) 및 이상엽(한국과학기술원, 교신저자) 포함 총 6 명
한편, 이번 연구는 과기정통부가 지원하는 ‘석유대체 친환경 화학기술개발사업의 ‘바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발’ 과제(과제책임자 KAIST 이상엽 특훈교수) 및 바이오매스기반 탄소중립형 바이오플라스틱 제품기술개발사업’ 과제(과제책임자 KAIST 최소영 연구교수)의 지원을 받아 수행됐다.
아이브릿지 사이트: https://github.com/kaistsystemsbiology/iBridge.git
2023.11.09
조회수 7824
-
 뇌종양 면역치료를 고 포도당 음료로?
뇌에서 발생하는 가장 흔한 악성 뇌종양인 교모세포종은 현재 수술, 항암화학요법, 그리고 방사선치료로 대표되는 암치료요법을 모두 동원해도 평균 생존 기간이 평균 15개월 정도밖에 되지 않는 치료가 매우 힘든 암종이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 실험 쥐 모델에서 고 포도당 음료 보충을 통해 뇌종양의 성장이 억제되는 현상을 관측했고 이에 더해 이러한 억제 효과가 장내 미생물의 특정 균주 변화를 통해 암세포 증식을 억제하는 항종양 면역반응을 증진한 작용원리를 규명했다고 16일 밝혔다.
장내 미생물은 우리 몸과 긴밀한 관련이 있으며, 악성종양에 대한 항종양 면역반응을 조절하는 데 중요한 역할을 하는 것으로 최근 연구에서 알려졌다. 하지만 대다수의 연구가 항종양 면역반응이 활성화된 흑색종과 같은 암종에서 연구가 이뤄졌으며, 뇌종양에 미치는 영향에 대해서는 거의 알려진 바가 없었다.
이번 연구에서 연구팀은 고 포도당 음료와 특정 균주의 복합처리가 뇌종양 내 면역세포 중 T 세포, 특히 CD4+ T 세포의 아형에서 세포독성 기능이 증대되는 것을 단일 세포 전사체 분석을 통해 확인했고, 더 나아가 암미세환경에서 탈진한 T 세포를 재활성화하는 면역관문억제제인 항 PD-1 항체와 복합처리시 탈진된 T세포 표면에 있는 단백질(PD-1)과 결합하여 T 세포 재활성을 유도하여 항암면역 치료의 효과를 더 증진함을 확인했다.
이러한 연구 결과는 기존 면역관문억제제의 효과가 미미했던 교모세포종에서 장내 미생물, 장내 미생물 유래 대사체, 또는 균주 유래 물질의 복합처리를 통해 항종양 면역기능을 향상하는 방식의 뇌종양 치료가 가능하다는 것을 보여주는 결과로, 추후 교모세포종에 항 PD-1 항체와 같은 면역관문억제제 치료를 적용하는데 응용될 수 있을 것으로 기대된다.
이번 연구를 주도한 KAIST 의과학대학원 김재호 박사는 "그동안 잘 알려지지 않은 장내 미생물 분석을 통해 뇌종양 성장을 억제할 수 있는 균주를 확보했으며 이러한 균주에 의한 항 뇌종양 면역조절 기전을 규명한 중요한 연구”라고 설명했다. 이흥규 교수는 “면역관문 치료제에 의한 뇌종양 치료 임상 시험 실패를 극복할 수 있는 대안으로 면역관문 치료제와 뇌종양 억제 유용 균주의 복합 치료를 통해 뇌종양 치료의 가능성을 보여준 동물실험 결과로 향후 장내 미생물을 이용한 항암 치료제 개발의 실마리를 제공할 것으로 기대한다ˮ 라고 연구 결과를 소개했다.
의과학대학원 김재호 박사(現, 미국 LA 소재 시티오브호프 암센터 방사선종양학과 박사후연구원)가 제1 저자로 참여한 이번 연구는 생명과학 분야 국제 학술지 `셀 리포트 (Cell Reports)'에 10월 6일 字 온라인판에 게재됐다. (논문명: Supplementation with a high-glucose drink stimulates anti-tumor immune responses to glioblastoma via gut microbiota modulation)
한편 이번 연구는 한국연구재단 바이오의료기술개발사업의 지원을 받아 수행됐다.
뇌종양 면역치료를 고 포도당 음료로?
뇌에서 발생하는 가장 흔한 악성 뇌종양인 교모세포종은 현재 수술, 항암화학요법, 그리고 방사선치료로 대표되는 암치료요법을 모두 동원해도 평균 생존 기간이 평균 15개월 정도밖에 되지 않는 치료가 매우 힘든 암종이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 실험 쥐 모델에서 고 포도당 음료 보충을 통해 뇌종양의 성장이 억제되는 현상을 관측했고 이에 더해 이러한 억제 효과가 장내 미생물의 특정 균주 변화를 통해 암세포 증식을 억제하는 항종양 면역반응을 증진한 작용원리를 규명했다고 16일 밝혔다.
장내 미생물은 우리 몸과 긴밀한 관련이 있으며, 악성종양에 대한 항종양 면역반응을 조절하는 데 중요한 역할을 하는 것으로 최근 연구에서 알려졌다. 하지만 대다수의 연구가 항종양 면역반응이 활성화된 흑색종과 같은 암종에서 연구가 이뤄졌으며, 뇌종양에 미치는 영향에 대해서는 거의 알려진 바가 없었다.
이번 연구에서 연구팀은 고 포도당 음료와 특정 균주의 복합처리가 뇌종양 내 면역세포 중 T 세포, 특히 CD4+ T 세포의 아형에서 세포독성 기능이 증대되는 것을 단일 세포 전사체 분석을 통해 확인했고, 더 나아가 암미세환경에서 탈진한 T 세포를 재활성화하는 면역관문억제제인 항 PD-1 항체와 복합처리시 탈진된 T세포 표면에 있는 단백질(PD-1)과 결합하여 T 세포 재활성을 유도하여 항암면역 치료의 효과를 더 증진함을 확인했다.
이러한 연구 결과는 기존 면역관문억제제의 효과가 미미했던 교모세포종에서 장내 미생물, 장내 미생물 유래 대사체, 또는 균주 유래 물질의 복합처리를 통해 항종양 면역기능을 향상하는 방식의 뇌종양 치료가 가능하다는 것을 보여주는 결과로, 추후 교모세포종에 항 PD-1 항체와 같은 면역관문억제제 치료를 적용하는데 응용될 수 있을 것으로 기대된다.
이번 연구를 주도한 KAIST 의과학대학원 김재호 박사는 "그동안 잘 알려지지 않은 장내 미생물 분석을 통해 뇌종양 성장을 억제할 수 있는 균주를 확보했으며 이러한 균주에 의한 항 뇌종양 면역조절 기전을 규명한 중요한 연구”라고 설명했다. 이흥규 교수는 “면역관문 치료제에 의한 뇌종양 치료 임상 시험 실패를 극복할 수 있는 대안으로 면역관문 치료제와 뇌종양 억제 유용 균주의 복합 치료를 통해 뇌종양 치료의 가능성을 보여준 동물실험 결과로 향후 장내 미생물을 이용한 항암 치료제 개발의 실마리를 제공할 것으로 기대한다ˮ 라고 연구 결과를 소개했다.
의과학대학원 김재호 박사(現, 미국 LA 소재 시티오브호프 암센터 방사선종양학과 박사후연구원)가 제1 저자로 참여한 이번 연구는 생명과학 분야 국제 학술지 `셀 리포트 (Cell Reports)'에 10월 6일 字 온라인판에 게재됐다. (논문명: Supplementation with a high-glucose drink stimulates anti-tumor immune responses to glioblastoma via gut microbiota modulation)
한편 이번 연구는 한국연구재단 바이오의료기술개발사업의 지원을 받아 수행됐다.
2023.10.16
조회수 7458
-
 뇌의 선천적 수량 비교 원리 규명
뇌의 선천적 인지 기능들은 학습이나 훈련 없이 신경망의 구조적 특성으로부터 자발적으로 발생할 수 있는 것인가?
우리 대학 뇌인지과학과 백세범 교수 연구팀이 두뇌에서 발견되는 선천적 수량 비교 능력이 자발적으로 형성되는 원리를 설명했다고 7일 밝혔다.
주어진 사물들의 수량을 비교하는 기능은 동물이나 인간의 생존에 필수적인 능력이다. 동물 그룹 간 다툼, 사냥, 먹이 수집 등 많은 상황에서 주어진 변수들의 수량 비율이나 차이에 따라 동물들의 의사결정 및 행동이 달라져야 하기 때문이다. 학습을 거치지 않은 어린 개체들의 행동 관찰로부터 수량 비교 능력은 두뇌의 선천적 기능이라는 가능성이 제기됐지만 이러한 능력이 학습 없이 발생하는 원리에 대한 설명은 아직 제시되지 않았다.
백세범 교수 연구팀은 두뇌 모사 인공신경망 모델을 활용해, 학습이 전혀 이뤄지지 않은 심층신경망 구조에서 시각적 수량 비율 및 차이 정보의 인지 기능이 자발적으로 발생할 수 있음을 증명했다. 또한 두 수량의 비율과 차이라는 서로 다른 종류의 정보를 비교하는 기능이 하나의 공통적인 발생 원리로부터 파생될 수 있다고 설명했다.
우리 대학 바이오및뇌공학과 이현수 박사과정, NYU 신경과학과 최우철 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘셀(Cell)’의 온라인 자매지 ‘셀 리포츠(Cell Reports)’ 7월 29일 자에 게재됐다. (논문명: Comparison of visual quantities in untrained neural networks)
연구팀은 먼저 전혀 학습을 거치지 않은 신경망에서 두 수량의 비율과 차이에 선택적으로 반응하는 개별 신경세포가 자발적으로 발생하는 것을 발견했다. 초기화된 심층신경망에서 다양한 비율 혹은 차이를 가지는 시각적 수량 정보가 주어졌을 때, 이에 선택적으로 반응하는 신경세포들이 다수 발견되며, 이들로부터 측정된 신경 활동은 실제 동물 실험에서 관측된 신경 활동 특성과 매우 유사함을 확인하였다. 또한 연구팀은 이를 이용하여 지금까지 보고되어 온 동물들의 수량 비교 행동 특성을 상당 부분 재현할 수 있음을 확인했다.
이에 더해, 연구팀은 수량 비교 기능 신경세포 회로 구조의 발생 원리를 계산신경과학적 모델을 통해 설명하고 검증했다. 신경망에서 발견된 비율/차이 선택적 신경세포의 특징적 연결구조를 분석해, 특정 값에 대한 선택성이 신경망 하위 계층에서 자발적으로 발생된 단순 증가, 단순 감소 신경 활동의 결합을 통해 형성될 수 있음을 보였다. 또한 이러한 신경 활동이 증가, 감소할 때 관찰되는 비선형성의 타입에 따라 각각 수량 비율 또는 수량 차이를 인지하는 신경세포로 분화될 수 있음을 연구팀은 확인했다.
이러한 결과들을 통해 연구팀은 학습이 전혀 이뤄지지 않은 두뇌에서 비율/차이 인지와 같은 선천적 수량 비교 기능이 발생하는 원리에 대한 근본적인 이해를 제시했다.
백세범 교수는 “이번 연구는 상당한 정도의 학습 과정이 필요할 것이라 여겨지던 두뇌의 수량 인지 및 비교, 연산 기능이 그 어떤 학습도 이뤄지지 않은 초기 두뇌의 구조에서 자발적으로 발생할 수 있음을 보이는 연구”라며, “발생 초기 신경망의 구조적/물리적 특성으로부터 다양한 선천적 고등 인지 기능이 발생할 수 있음을 시사함으로써 뇌신경과학 연구뿐 아니라 새로운 개념의 인공지능 연구에도 의미있는 방향을 제시할 수 있을 것이라 기대한다”고 언급했다.
한편 이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업, KAIST 특이점교수 사업의 지원을 받아 수행됐다.
뇌의 선천적 수량 비교 원리 규명
뇌의 선천적 인지 기능들은 학습이나 훈련 없이 신경망의 구조적 특성으로부터 자발적으로 발생할 수 있는 것인가?
우리 대학 뇌인지과학과 백세범 교수 연구팀이 두뇌에서 발견되는 선천적 수량 비교 능력이 자발적으로 형성되는 원리를 설명했다고 7일 밝혔다.
주어진 사물들의 수량을 비교하는 기능은 동물이나 인간의 생존에 필수적인 능력이다. 동물 그룹 간 다툼, 사냥, 먹이 수집 등 많은 상황에서 주어진 변수들의 수량 비율이나 차이에 따라 동물들의 의사결정 및 행동이 달라져야 하기 때문이다. 학습을 거치지 않은 어린 개체들의 행동 관찰로부터 수량 비교 능력은 두뇌의 선천적 기능이라는 가능성이 제기됐지만 이러한 능력이 학습 없이 발생하는 원리에 대한 설명은 아직 제시되지 않았다.
백세범 교수 연구팀은 두뇌 모사 인공신경망 모델을 활용해, 학습이 전혀 이뤄지지 않은 심층신경망 구조에서 시각적 수량 비율 및 차이 정보의 인지 기능이 자발적으로 발생할 수 있음을 증명했다. 또한 두 수량의 비율과 차이라는 서로 다른 종류의 정보를 비교하는 기능이 하나의 공통적인 발생 원리로부터 파생될 수 있다고 설명했다.
우리 대학 바이오및뇌공학과 이현수 박사과정, NYU 신경과학과 최우철 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘셀(Cell)’의 온라인 자매지 ‘셀 리포츠(Cell Reports)’ 7월 29일 자에 게재됐다. (논문명: Comparison of visual quantities in untrained neural networks)
연구팀은 먼저 전혀 학습을 거치지 않은 신경망에서 두 수량의 비율과 차이에 선택적으로 반응하는 개별 신경세포가 자발적으로 발생하는 것을 발견했다. 초기화된 심층신경망에서 다양한 비율 혹은 차이를 가지는 시각적 수량 정보가 주어졌을 때, 이에 선택적으로 반응하는 신경세포들이 다수 발견되며, 이들로부터 측정된 신경 활동은 실제 동물 실험에서 관측된 신경 활동 특성과 매우 유사함을 확인하였다. 또한 연구팀은 이를 이용하여 지금까지 보고되어 온 동물들의 수량 비교 행동 특성을 상당 부분 재현할 수 있음을 확인했다.
이에 더해, 연구팀은 수량 비교 기능 신경세포 회로 구조의 발생 원리를 계산신경과학적 모델을 통해 설명하고 검증했다. 신경망에서 발견된 비율/차이 선택적 신경세포의 특징적 연결구조를 분석해, 특정 값에 대한 선택성이 신경망 하위 계층에서 자발적으로 발생된 단순 증가, 단순 감소 신경 활동의 결합을 통해 형성될 수 있음을 보였다. 또한 이러한 신경 활동이 증가, 감소할 때 관찰되는 비선형성의 타입에 따라 각각 수량 비율 또는 수량 차이를 인지하는 신경세포로 분화될 수 있음을 연구팀은 확인했다.
이러한 결과들을 통해 연구팀은 학습이 전혀 이뤄지지 않은 두뇌에서 비율/차이 인지와 같은 선천적 수량 비교 기능이 발생하는 원리에 대한 근본적인 이해를 제시했다.
백세범 교수는 “이번 연구는 상당한 정도의 학습 과정이 필요할 것이라 여겨지던 두뇌의 수량 인지 및 비교, 연산 기능이 그 어떤 학습도 이뤄지지 않은 초기 두뇌의 구조에서 자발적으로 발생할 수 있음을 보이는 연구”라며, “발생 초기 신경망의 구조적/물리적 특성으로부터 다양한 선천적 고등 인지 기능이 발생할 수 있음을 시사함으로써 뇌신경과학 연구뿐 아니라 새로운 개념의 인공지능 연구에도 의미있는 방향을 제시할 수 있을 것이라 기대한다”고 언급했다.
한편 이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업, KAIST 특이점교수 사업의 지원을 받아 수행됐다.
2023.08.07
조회수 7266
 장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.07.01 조회수 902
장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.07.01 조회수 902 암세포 사멸과 연관된 대사를 관장하는 최상위인자 규명
우리 대학 생명과학과 강석조 교수 연구팀이 3차원 종양미세환경에서 성장한 암세포에서 유래한 케모카인(Chemokine) CXCL5가 암세포의 대사 리프로그래밍(reprogramming)을 조절하며 이를 통하여 지질 과산화물의 축적으로 인해 유도되는 세포 사멸인 페롭토시스(ferroptosis)에 대한 저항성을 획득한다고 7일 밝혔다.
CXCL5는 수용체인 CXCR2와의 결합을 통해 세포의 이동(migration) 및 침습(invasion)을 촉진하는 역할을 하는 케모카인으로, 종양미세환경에서 면역세포들의 침윤에 관여함이 알려져왔다. CXCL5는 여러 암종에서 발현이 증가되어 있음이 보고되었으나 실제 3차원 종양미세환경 내 암세포에서 유래한 CXCL5의 역할에 대해서는 밝혀진 바가 없다.
강 교수 연구팀은 세포외기질의 침착과 대식세포의 침투가 특징적인 암 미세환경을 모사하는 3차원 배양 시스템을 구축해 세포 간, 세포와 세포외기질 간 상호작용 뿐 아니라 종양미세환경 내 암세포의 위치에 따라 생장에 필요한 산소와 영양분의 접근성 차이로 인한 비세포적 요소가 형성될 수 있도록 유도하였다. 연구팀은 IFNγ자극을 받은 대식세포의 분비물이 3차원 환경 특이적으로 암세포의 CXCL5 발현을 증가시킴을 확인하였고, 야생형 암세포와 CXCL5 결손 암세포의 성장을 2차원, 3차원에서 비교한 결과 암세포의 CXCL5의 발현은 3차원 성장에만 필수적임을 확인하였다.
연구팀은 2차원 배양 암세포와 3차원 배양 암세포의 유전자 발현과 대사체를 비교하여 3차원에서 광범위한 대사 과정의 리프로그래밍이 일어남을 확인하였고, CXCL5가 이런 3차원 특이적 대사 리프로그래밍을 관장하는 핵심적 역할을 수행함을 보였다. 기전적으로 CXCL5는 전사인자 HIF-1a와 MYC의 발현을 유도하여 대사 리프로그래밍을 조절하며, 특히 여러 대사 과정 중 해당과정과 1-탄소 대사과정에 영향을 주는 것을 확인하였다.
또한, 연구팀은 저해된 해당과정과 1-탄소 대사과정이 산화-환원 항상성 조절에 중요한 역할을 한다는 이전 연구결과를 바탕으로, 세포 내 산화손상 정도를 측정한 결과 CXCL5 결손 시 미토콘드리아 활성산소와 철분에 의존하여 페롭토시스를 유발하는 지질 과산화물이 증가한 것을 확인하였다. 흥미롭게도 세포자멸사(apoptosis), 염증성 세포사멸인 파이롭토시스(pyroptosis), 그리고 구리 의존적 세포사멸인 큐프롭티시스(cuproptosis)는 CXCL5 결손에 의해 영향을 받지 않는 것을 밝혔다. 또한, HIF-1a와 MYC의 과발현은 CXCL5 결손 세포에서 보이는 활성산소와 지질 과산화물의 증가를 감소시키고 효과적으로 페롭토시스를 억제함을 확인하였다. CXCL5 수용체인 CXCR2를 결손시켰을 경우 동일하게 HIF-1a와 MYC의 발현이 저해되는 것을 확인함으로써, 암세포의 CXCL5-CXCR2 경로 억제를 통한 페롭토시스의 유도는 현재 개발 중인 세포자멸사 유도제의 한계를 극복할 새로운 전략이 될 수 있음을 시사하였다.
강석조 교수는 “본 연구는 3차원 종양미세환경 특이적인 암세포 대사를 보다 광범위하게 밝히고, 암세포에서 유래한 CXCL5가 HIF-1a와 MYC의 발현을 유도하여 3차원 성장을 위한 암대사 리프로그래밍을 총괄하는 지휘자적인 역할을 수행함을 새롭게 밝힌 연구”라고 언급하면서, “본 연구 성과는 암세포 대사 과정과 세포사멸 저항성 획득의 연결고리를 끊을 수 있는 차별적인 기전을 제시함으로써 혁신적인 치료 전략을 제공할 것으로 기대한다”고 전했다.
이번 연구 결과는 세포사멸의 권위있는 국제 학술지 `셀 데쓰 앤 디퍼런시에이션(Cell Death and Differentiation)’에 3월 7일 字 온라인판으로 게재됐다 (논문명: Cancer-intrinsic Cxcl5 orchestrates a global metabolic reprogramming for resistance to oxidative cell death in 3D). KAIST 생명과학과 서라민 박사가 제 1저자로 연구를 주도하였고, 서울대학교 Arvie Camille V. de Guzman 박사와 박성혁 교수, 그리고 한국표준과학연구원의 이지연 박사가 함께 연구에 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 개인기초연구사업(중견연구) 지원을 받아 수행됐다.
2025.03.07 조회수 3554
암세포 사멸과 연관된 대사를 관장하는 최상위인자 규명
우리 대학 생명과학과 강석조 교수 연구팀이 3차원 종양미세환경에서 성장한 암세포에서 유래한 케모카인(Chemokine) CXCL5가 암세포의 대사 리프로그래밍(reprogramming)을 조절하며 이를 통하여 지질 과산화물의 축적으로 인해 유도되는 세포 사멸인 페롭토시스(ferroptosis)에 대한 저항성을 획득한다고 7일 밝혔다.
CXCL5는 수용체인 CXCR2와의 결합을 통해 세포의 이동(migration) 및 침습(invasion)을 촉진하는 역할을 하는 케모카인으로, 종양미세환경에서 면역세포들의 침윤에 관여함이 알려져왔다. CXCL5는 여러 암종에서 발현이 증가되어 있음이 보고되었으나 실제 3차원 종양미세환경 내 암세포에서 유래한 CXCL5의 역할에 대해서는 밝혀진 바가 없다.
강 교수 연구팀은 세포외기질의 침착과 대식세포의 침투가 특징적인 암 미세환경을 모사하는 3차원 배양 시스템을 구축해 세포 간, 세포와 세포외기질 간 상호작용 뿐 아니라 종양미세환경 내 암세포의 위치에 따라 생장에 필요한 산소와 영양분의 접근성 차이로 인한 비세포적 요소가 형성될 수 있도록 유도하였다. 연구팀은 IFNγ자극을 받은 대식세포의 분비물이 3차원 환경 특이적으로 암세포의 CXCL5 발현을 증가시킴을 확인하였고, 야생형 암세포와 CXCL5 결손 암세포의 성장을 2차원, 3차원에서 비교한 결과 암세포의 CXCL5의 발현은 3차원 성장에만 필수적임을 확인하였다.
연구팀은 2차원 배양 암세포와 3차원 배양 암세포의 유전자 발현과 대사체를 비교하여 3차원에서 광범위한 대사 과정의 리프로그래밍이 일어남을 확인하였고, CXCL5가 이런 3차원 특이적 대사 리프로그래밍을 관장하는 핵심적 역할을 수행함을 보였다. 기전적으로 CXCL5는 전사인자 HIF-1a와 MYC의 발현을 유도하여 대사 리프로그래밍을 조절하며, 특히 여러 대사 과정 중 해당과정과 1-탄소 대사과정에 영향을 주는 것을 확인하였다.
또한, 연구팀은 저해된 해당과정과 1-탄소 대사과정이 산화-환원 항상성 조절에 중요한 역할을 한다는 이전 연구결과를 바탕으로, 세포 내 산화손상 정도를 측정한 결과 CXCL5 결손 시 미토콘드리아 활성산소와 철분에 의존하여 페롭토시스를 유발하는 지질 과산화물이 증가한 것을 확인하였다. 흥미롭게도 세포자멸사(apoptosis), 염증성 세포사멸인 파이롭토시스(pyroptosis), 그리고 구리 의존적 세포사멸인 큐프롭티시스(cuproptosis)는 CXCL5 결손에 의해 영향을 받지 않는 것을 밝혔다. 또한, HIF-1a와 MYC의 과발현은 CXCL5 결손 세포에서 보이는 활성산소와 지질 과산화물의 증가를 감소시키고 효과적으로 페롭토시스를 억제함을 확인하였다. CXCL5 수용체인 CXCR2를 결손시켰을 경우 동일하게 HIF-1a와 MYC의 발현이 저해되는 것을 확인함으로써, 암세포의 CXCL5-CXCR2 경로 억제를 통한 페롭토시스의 유도는 현재 개발 중인 세포자멸사 유도제의 한계를 극복할 새로운 전략이 될 수 있음을 시사하였다.
강석조 교수는 “본 연구는 3차원 종양미세환경 특이적인 암세포 대사를 보다 광범위하게 밝히고, 암세포에서 유래한 CXCL5가 HIF-1a와 MYC의 발현을 유도하여 3차원 성장을 위한 암대사 리프로그래밍을 총괄하는 지휘자적인 역할을 수행함을 새롭게 밝힌 연구”라고 언급하면서, “본 연구 성과는 암세포 대사 과정과 세포사멸 저항성 획득의 연결고리를 끊을 수 있는 차별적인 기전을 제시함으로써 혁신적인 치료 전략을 제공할 것으로 기대한다”고 전했다.
이번 연구 결과는 세포사멸의 권위있는 국제 학술지 `셀 데쓰 앤 디퍼런시에이션(Cell Death and Differentiation)’에 3월 7일 字 온라인판으로 게재됐다 (논문명: Cancer-intrinsic Cxcl5 orchestrates a global metabolic reprogramming for resistance to oxidative cell death in 3D). KAIST 생명과학과 서라민 박사가 제 1저자로 연구를 주도하였고, 서울대학교 Arvie Camille V. de Guzman 박사와 박성혁 교수, 그리고 한국표준과학연구원의 이지연 박사가 함께 연구에 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 개인기초연구사업(중견연구) 지원을 받아 수행됐다.
2025.03.07 조회수 3554 면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2025.01.07 조회수 3917
면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2025.01.07 조회수 3917 원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18 조회수 4764
원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18 조회수 4764 미토콘드리아로 퇴행성 질환까지 제어 가능하다
우리 대학 생명화학공학과 김유식 교수 연구팀이 비정상적 면역 활성을 유발해 염증반응이 동반된 세포 사멸을 일으키는 미토콘드리아 이중나선 RNA의 새로운 조절 기전을 찾아냈다고 22일 밝혔다.
최근 미토콘드리아 이중나선 RNA가 스트레스 환경에서 세포질로 빠져나가 비정상적 면역 활성 및 세포 사멸을 유발한다는 것이 밝혀졌다. 또한 이러한 미토콘드리아 이중나선 RNA로 촉발되는 면역 활성은 관절염 및 헌팅턴 무도병을 비롯한 염증반응이 동반된 퇴행성 질환과 자가면역질환 중 하나인 쇼그렌 증후군의 발병 및 진행에 핵심적인 역할을 한다는 것이 보고됐다.
아직 미토콘드리아 이중나선 RNA의 분자적 조절 기전에 대해서는 보고된 바 없다는 점을 착안해서 연구팀은 미토콘드리아 내에 존재하며 RNA와 결합할 수 있는 단백질에 대해 유전자 가위를 이용해 각 단백질의 발현을 억제한 후 미토콘드리아 이중나선 RNA의 발현량을 조사했다.
이 과정에서 RNA의 구성 물질 중 하나인 시토신의 화학적 변형을 유발하는 엔썬4(NSUN4)*이라는 단백질의 발현을 줄였을 때 미토콘드리아 이중나선 RNA의 발현이 유의미하게 증가하는 것을 확인했다.
*엔썬4 (NSUN4): NOP2/Sun RNA 메틸트랜스퍼라제 4
나아가, 연구팀은 단백질을 생산하지 않는 미토콘드리아 비암호화 RNA의 변형을 가속시키는 것이 동 단백질 엔썬4에 의해서라고 최초로 제시했다.
연구팀은 추가 연구를 통해 미토콘드리아 RNA 단백질들의 발현 감소로 축적된 미토콘드리아 이중나선 RNA의 양이 증가했으며 세포질로 누출된 미토콘드리아 이중나선 RNA는 면역반응을 활성화시켰다. 이를 통해 연구팀은 새로운 세포 내 면역 유발인자로 최근 주목받기 시작한 미토콘드리아 이중나선 RNA의 변형에 의한 발현 조절 기전을 제시했다.
생명화학공학과 김유식 교수는 “이번 연구를 통해 비정상적 면역 활성 유발 인자로 최근 주목받고 있는 미토콘드리아 이중나선 RNA의 형성 및 조절 기전을 밝혔다”면서 “이번 연구의 결과를 바탕으로 면역 계통 질환을 비롯해 다양한 퇴행성 질환의 발병 및 진행 과정을 효과적으로 제어할 수 있는 전략을 제시할 수 있을 것”이라고 말했다.
생명화학공학과 김수진 박사(現 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학(Harvard Medical School) 박사후연구원)와 탄 스테파니(Tan Stephanie) 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 7월 16일 字에 온라인 게재됐다. (논문명 : RNA 5-methylcytosine marks mitochondrial double-stranded RNAs for degradation and cytosolic release).
한편 이번 연구는 한국연구재단 우수신진연구지원사업과 미국 국립보건원의 지원으로 수행됐다.
2024.07.22 조회수 5637
미토콘드리아로 퇴행성 질환까지 제어 가능하다
우리 대학 생명화학공학과 김유식 교수 연구팀이 비정상적 면역 활성을 유발해 염증반응이 동반된 세포 사멸을 일으키는 미토콘드리아 이중나선 RNA의 새로운 조절 기전을 찾아냈다고 22일 밝혔다.
최근 미토콘드리아 이중나선 RNA가 스트레스 환경에서 세포질로 빠져나가 비정상적 면역 활성 및 세포 사멸을 유발한다는 것이 밝혀졌다. 또한 이러한 미토콘드리아 이중나선 RNA로 촉발되는 면역 활성은 관절염 및 헌팅턴 무도병을 비롯한 염증반응이 동반된 퇴행성 질환과 자가면역질환 중 하나인 쇼그렌 증후군의 발병 및 진행에 핵심적인 역할을 한다는 것이 보고됐다.
아직 미토콘드리아 이중나선 RNA의 분자적 조절 기전에 대해서는 보고된 바 없다는 점을 착안해서 연구팀은 미토콘드리아 내에 존재하며 RNA와 결합할 수 있는 단백질에 대해 유전자 가위를 이용해 각 단백질의 발현을 억제한 후 미토콘드리아 이중나선 RNA의 발현량을 조사했다.
이 과정에서 RNA의 구성 물질 중 하나인 시토신의 화학적 변형을 유발하는 엔썬4(NSUN4)*이라는 단백질의 발현을 줄였을 때 미토콘드리아 이중나선 RNA의 발현이 유의미하게 증가하는 것을 확인했다.
*엔썬4 (NSUN4): NOP2/Sun RNA 메틸트랜스퍼라제 4
나아가, 연구팀은 단백질을 생산하지 않는 미토콘드리아 비암호화 RNA의 변형을 가속시키는 것이 동 단백질 엔썬4에 의해서라고 최초로 제시했다.
연구팀은 추가 연구를 통해 미토콘드리아 RNA 단백질들의 발현 감소로 축적된 미토콘드리아 이중나선 RNA의 양이 증가했으며 세포질로 누출된 미토콘드리아 이중나선 RNA는 면역반응을 활성화시켰다. 이를 통해 연구팀은 새로운 세포 내 면역 유발인자로 최근 주목받기 시작한 미토콘드리아 이중나선 RNA의 변형에 의한 발현 조절 기전을 제시했다.
생명화학공학과 김유식 교수는 “이번 연구를 통해 비정상적 면역 활성 유발 인자로 최근 주목받고 있는 미토콘드리아 이중나선 RNA의 형성 및 조절 기전을 밝혔다”면서 “이번 연구의 결과를 바탕으로 면역 계통 질환을 비롯해 다양한 퇴행성 질환의 발병 및 진행 과정을 효과적으로 제어할 수 있는 전략을 제시할 수 있을 것”이라고 말했다.
생명화학공학과 김수진 박사(現 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학(Harvard Medical School) 박사후연구원)와 탄 스테파니(Tan Stephanie) 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 7월 16일 字에 온라인 게재됐다. (논문명 : RNA 5-methylcytosine marks mitochondrial double-stranded RNAs for degradation and cytosolic release).
한편 이번 연구는 한국연구재단 우수신진연구지원사업과 미국 국립보건원의 지원으로 수행됐다.
2024.07.22 조회수 5637 암세포 약물반응 예측 ‘그레이박스’ 개발
지난 수십 년간 많은 의생명과학자의 집중적인 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 이처럼 암 치료가 난해한 이유는 환자마다 암 발생의 원인이 되는 유전자 돌연변이와 그로 인한 유전자 네트워크 변형이 서로 달라서 전통적인 실험생물학 접근만으로 표적치료를 적용하는 데에는 본질적인 한계가 있기 때문이다. 한편 딥러닝과 같은 소위 블랙박스(black-box) 방식의 인공지능 기술을 활용해 실험을 대체하고 데이터 학습을 통해 약물 반응을 예측할 수 있으나 이에 대한 생물학적 근거를 설명할 수 없어 결과를 신뢰하기 어려웠다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 인공지능과 시스템생물학을 융합해 암세포의 약물 반응 예측 및 메커니즘 분석을 동시에 이룰 수 있는 새로운 개념의 ‘그레이박스’ 기술을 개발했다고 3일 밝혔다.
조광현 교수 연구팀은 높은 예측 성능을 보이지만 그 근거를 알 수 없어 블랙박스로 불리는 딥러닝과 복잡한 대규모 모델의 경우 예측 성능의 한계를 지니지만 예측 결과에 대한 상세한 근거를 제시할 수 있어서 화이트박스로 불리는 시스템생물학 기술을 융합함으로써 두 기술의 한계를 동시에 극복할 수 있는 소위 ‘그레이박스’ 기술을 착안했다.
연구팀은 다양한 암종의 돌연변이 및 표적항암제 타겟 유전자 정보를 집대성해 분자 조절 네트워크 모델을 구축함으로써 여러 암종과 항암제의 약물 반응 예측에 활용될 수 있는 범용적 골격 모델을 우선 정립했다. 특히 다양한 암종에서 돌연변이가 빈번하게 발생하는 유전자들을 중심으로 전암(pan-cancer) 유전자 네트워크를 제작했고 표적항암제별 약물 반응과 관련된 돌연변이 및 연관 유전자들로 구성된 부분네트워크(sub-network)를 추출함으로써 약물 반응 예측을 위한 시스템생물학 모델을 제작했다.
연구팀은 이렇게 제작된 모델의 매개변수를 딥러닝 블랙박스 최적화기를 통해 결정하는 방식으로 트라메티닙, 아파티닙, 팔보시클립 세 개의 표적항암제 및 대장암, 유방암, 위암 세 개의 암종에 대한 그레이박스 모델을 구축했다. 완성된 모델의 약물 반응 컴퓨터시뮬레이션 결과는 각 암종별 약물반응의 민감도 차이를 보이는 세포주(cancer cell lines) 실험을 통해 비교 검증됐다.
특히 개발된 모델은 미국 국립암연구소(National Cancer Institute)의 돌연변이 정보 기반 약물 반응 예측으로는 동일한 반응을 보일 것으로 예상된 암세포주들이 실제로는 서로 다른 약물 반응을 보일 수 있다는 것을 정확히 예측했으며, 약물 반응의 차이가 발생하는 원인 또한 세포 주별 분자 네트워크 동역학의 차이로 상세히 설명할 수 있었다.
이번 연구 성과는 학습에 의한 시뮬레이션 모델 최적화를 통해 블랙박스 모델인 인공지능 기술의 높은 예측력과 화이트박스 모델인 시스템생물학 기술의 해석력을 동시에 달성한 새로운 약물 반응 예측 기술 개발이어서 그 의미가 크다. 특히, 발생 원인이 이질적이고 복잡한 네트워크 질환인 암에 대해 범용적으로 활용가능한 약물 반응 예측 원천기술이므로 향후 기술 고도화를 통해 다양한 종류의 암종 및 환자 맞춤형 치료 전략 제시에 활용될 수 있을 것으로 기대된다.
조광현 교수는 "인공지능 기술의 높은 예측력과 시스템생물학 기술의 우수한 해석력을 동시에 갖춘 새로운 융합원천기술로서 향후 고도화를 통해 신약 개발 산업의 활용이 기대된다ˮ고 말했다.
바이오및뇌공학과 김윤성 박사, 한영현 박사 등이 참여한 이번 연구 결과는 셀 프레스(Cell Press)에서 출간하는 국제저널 `셀 리포트 메소드(Cell Reports Methods)' 5월 20일 字 표지논문으로 출판됐다. (논문명: A grey box framework that optimizes a white box logical model using a black box optimizer for simulating cellular responses to perturbations)
논문링크: https://www.cell.com/cell-reports-methods/fulltext/S2667-2375(24)00117-6
한편 이번 연구는 삼성미래기술육성사업 및 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2024.06.03 조회수 7631
암세포 약물반응 예측 ‘그레이박스’ 개발
지난 수십 년간 많은 의생명과학자의 집중적인 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 이처럼 암 치료가 난해한 이유는 환자마다 암 발생의 원인이 되는 유전자 돌연변이와 그로 인한 유전자 네트워크 변형이 서로 달라서 전통적인 실험생물학 접근만으로 표적치료를 적용하는 데에는 본질적인 한계가 있기 때문이다. 한편 딥러닝과 같은 소위 블랙박스(black-box) 방식의 인공지능 기술을 활용해 실험을 대체하고 데이터 학습을 통해 약물 반응을 예측할 수 있으나 이에 대한 생물학적 근거를 설명할 수 없어 결과를 신뢰하기 어려웠다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 인공지능과 시스템생물학을 융합해 암세포의 약물 반응 예측 및 메커니즘 분석을 동시에 이룰 수 있는 새로운 개념의 ‘그레이박스’ 기술을 개발했다고 3일 밝혔다.
조광현 교수 연구팀은 높은 예측 성능을 보이지만 그 근거를 알 수 없어 블랙박스로 불리는 딥러닝과 복잡한 대규모 모델의 경우 예측 성능의 한계를 지니지만 예측 결과에 대한 상세한 근거를 제시할 수 있어서 화이트박스로 불리는 시스템생물학 기술을 융합함으로써 두 기술의 한계를 동시에 극복할 수 있는 소위 ‘그레이박스’ 기술을 착안했다.
연구팀은 다양한 암종의 돌연변이 및 표적항암제 타겟 유전자 정보를 집대성해 분자 조절 네트워크 모델을 구축함으로써 여러 암종과 항암제의 약물 반응 예측에 활용될 수 있는 범용적 골격 모델을 우선 정립했다. 특히 다양한 암종에서 돌연변이가 빈번하게 발생하는 유전자들을 중심으로 전암(pan-cancer) 유전자 네트워크를 제작했고 표적항암제별 약물 반응과 관련된 돌연변이 및 연관 유전자들로 구성된 부분네트워크(sub-network)를 추출함으로써 약물 반응 예측을 위한 시스템생물학 모델을 제작했다.
연구팀은 이렇게 제작된 모델의 매개변수를 딥러닝 블랙박스 최적화기를 통해 결정하는 방식으로 트라메티닙, 아파티닙, 팔보시클립 세 개의 표적항암제 및 대장암, 유방암, 위암 세 개의 암종에 대한 그레이박스 모델을 구축했다. 완성된 모델의 약물 반응 컴퓨터시뮬레이션 결과는 각 암종별 약물반응의 민감도 차이를 보이는 세포주(cancer cell lines) 실험을 통해 비교 검증됐다.
특히 개발된 모델은 미국 국립암연구소(National Cancer Institute)의 돌연변이 정보 기반 약물 반응 예측으로는 동일한 반응을 보일 것으로 예상된 암세포주들이 실제로는 서로 다른 약물 반응을 보일 수 있다는 것을 정확히 예측했으며, 약물 반응의 차이가 발생하는 원인 또한 세포 주별 분자 네트워크 동역학의 차이로 상세히 설명할 수 있었다.
이번 연구 성과는 학습에 의한 시뮬레이션 모델 최적화를 통해 블랙박스 모델인 인공지능 기술의 높은 예측력과 화이트박스 모델인 시스템생물학 기술의 해석력을 동시에 달성한 새로운 약물 반응 예측 기술 개발이어서 그 의미가 크다. 특히, 발생 원인이 이질적이고 복잡한 네트워크 질환인 암에 대해 범용적으로 활용가능한 약물 반응 예측 원천기술이므로 향후 기술 고도화를 통해 다양한 종류의 암종 및 환자 맞춤형 치료 전략 제시에 활용될 수 있을 것으로 기대된다.
조광현 교수는 "인공지능 기술의 높은 예측력과 시스템생물학 기술의 우수한 해석력을 동시에 갖춘 새로운 융합원천기술로서 향후 고도화를 통해 신약 개발 산업의 활용이 기대된다ˮ고 말했다.
바이오및뇌공학과 김윤성 박사, 한영현 박사 등이 참여한 이번 연구 결과는 셀 프레스(Cell Press)에서 출간하는 국제저널 `셀 리포트 메소드(Cell Reports Methods)' 5월 20일 字 표지논문으로 출판됐다. (논문명: A grey box framework that optimizes a white box logical model using a black box optimizer for simulating cellular responses to perturbations)
논문링크: https://www.cell.com/cell-reports-methods/fulltext/S2667-2375(24)00117-6
한편 이번 연구는 삼성미래기술육성사업 및 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2024.06.03 조회수 7631 방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15 조회수 7338
방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15 조회수 7338 암, 루게릭병 등 난치성 질환 발병 기전 밝혀
단백질 정보를 가진 mRNA 유전자 조절 기전에서 알루 요소(Alu)의 중요성을 제시하고, 나아가 종양 형성, 퇴행성 뇌질환 등 mRNA가 변화하는 다양한 질환에서 역방향 알루 반복구조(IRAlus)라는 새로운 발병 원인을 최초로 제시함으로써 질병 치료에 획기적인 방안을 제시하였다.
우리 대학 생명화학공학과 김유식 교수와 바이오및뇌공학과 이영석 교수 공동 연구팀이 종양 형성과 퇴행성 뇌질환을 유발하는 새로운 유전자 조절 기전을 찾아냈다고 6일 밝혔다.
인간 유전체의 약 10%를 차지하는 반복서열인 알루 요소(Alu element, Alu)는 단백질 정보를 가지는 전령 RNA(messenger RNA, mRNA)의 단백질 생산 효율을 조절할 수 있다. 특히, mRNA가 2개의 알루 요소로 형성된 역방향 알루 반복 구조(Inverted Alu repeats, IRAlus)를 가지게 되면 mRNA의 세포 내 이동이 방해되어 단백질 생산이 감소한다.
연구팀은 질환 특이적으로 mRNA가 변화하는 과정에서 주요 mRNA가 역방향 알루 반복 구조(IRAlus)에 의해 조절받게 하고 이는 mRNA가 가지고 있는 유전자 발현 억제로 이어져 질환을 일으킨다는 새로운 발병 기전을 밝혔다.
알루(Alu)는 유전체의 단백질 정보를 가지고 있지만 유전체 상에서 본인의 서열만을 복제하는 성질이 있어 ‘이기적 서열’로 알려져 있었다. 최근 연구에 의하면 mRNA 내의 존재하는 역방향 알루 반복 구조(IRAlus)는 숙주 mRNA의 세포질로의 이동을 방해하여 해당 유전자의 단백질 번역을 억제한다. 그러나, 해당 유전자 발현 조절 기전의 생물학적 중요성에 대해서는 보고된 바가 없었다.
연구팀은 역방향 알루 반복 구조(IRAlus)를 인지할 수 있는 항체를 활용한 차세대 염기서열 분석법을 사용해 특정 세포 내 활성화된, 기능적인 역방향 알루 반복 구조(IRAlus)를 가지고 있어 역방향 알루 반복 구조(IRAlus)에 의해 단백질 합성이 억제될 수 있는 mRNA 유전자 목록을 완성했다.
종양 형성 과정에서 역방향 알루 반복 구조(IRAlus)의 유전자 조절 기전의 영향을 분석했다. 연구팀은 대표적인 종양억제유전자를 억제하는 종양 유전자 조절을 하고 이는 단백질 발현 증가로 이어지며 결과적으로 종양억제유전자 활성이 억제됨으로써 암 발달을 촉진할 수 있다.
나아가, 특정 mRNA 서열과 상보적으로 결합해 mRNA의 기능을 억제해 다양한 질병 치료 및 조절 도구로 현재 연구되고 있는 혁신 RNA 치료제인 안티센스 올리고뉴클레오타이드(Antisense oligonucleotide, 이하 ASO)를 활용해 단백질 발현을 복구하는 암 치료 전략을 탐색했다.
연구팀은 신경계 세포에서 역방향 알루 반복 구조(IRAlus)로 인한 유전자 조절이 활발하다는 것을 확인했다. 또한, 해당 현상의 과도한 활성과 루게릭병으로 알려진 근위축성 측삭경화증을 비롯한 퇴행성 뇌질환 간의 연관성을 최초로 제시했다.
생명화학공학과 김유식 교수는 “이번 연구는 인간 유전체 내 반복서열인 역방향 알루 반복 구조(IRAlus)를 가지는 유전자를 목록화하는 것을 넘어서 해당 유전자 발현 조절이 인간 질환, 특히 종양 형성 및 퇴행성 뇌질환 발병과정에서 핵심적인 역할을 하는 것을 최초로 확인했다”면서 “이번 연구에서 제시한 역방향 알루 반복 구조(IRAlus)라는 새로운 타겟 물질을 활용하면 종양과 노화를 비롯해 다양한 퇴행성 질환의 발병 기전 분석에 근본적이고 효과적인 치료전략을 마련하는 데 유용할 것”이라고 말했다.
생명화학공학과 구자영 박사(현 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학 (Harvard Medical School) 박사후연구원)와 이건용 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 2월 2일 字에 온라인 게재됐다. (논문명 : Alternative Polyadenylation Determines the Functional Landscape of Inverted Alu Repeats).
우리 대학 생명과학과 임정훈 교수 연구팀과 의과학대학원 한진주 교수 연구팀이 참여한 이번 연구는 한국연구재단 기초연구실 지원사업과 KAIST 도약연구사업의 지원을 받아 수행됐다.
2024.02.06 조회수 6710
암, 루게릭병 등 난치성 질환 발병 기전 밝혀
단백질 정보를 가진 mRNA 유전자 조절 기전에서 알루 요소(Alu)의 중요성을 제시하고, 나아가 종양 형성, 퇴행성 뇌질환 등 mRNA가 변화하는 다양한 질환에서 역방향 알루 반복구조(IRAlus)라는 새로운 발병 원인을 최초로 제시함으로써 질병 치료에 획기적인 방안을 제시하였다.
우리 대학 생명화학공학과 김유식 교수와 바이오및뇌공학과 이영석 교수 공동 연구팀이 종양 형성과 퇴행성 뇌질환을 유발하는 새로운 유전자 조절 기전을 찾아냈다고 6일 밝혔다.
인간 유전체의 약 10%를 차지하는 반복서열인 알루 요소(Alu element, Alu)는 단백질 정보를 가지는 전령 RNA(messenger RNA, mRNA)의 단백질 생산 효율을 조절할 수 있다. 특히, mRNA가 2개의 알루 요소로 형성된 역방향 알루 반복 구조(Inverted Alu repeats, IRAlus)를 가지게 되면 mRNA의 세포 내 이동이 방해되어 단백질 생산이 감소한다.
연구팀은 질환 특이적으로 mRNA가 변화하는 과정에서 주요 mRNA가 역방향 알루 반복 구조(IRAlus)에 의해 조절받게 하고 이는 mRNA가 가지고 있는 유전자 발현 억제로 이어져 질환을 일으킨다는 새로운 발병 기전을 밝혔다.
알루(Alu)는 유전체의 단백질 정보를 가지고 있지만 유전체 상에서 본인의 서열만을 복제하는 성질이 있어 ‘이기적 서열’로 알려져 있었다. 최근 연구에 의하면 mRNA 내의 존재하는 역방향 알루 반복 구조(IRAlus)는 숙주 mRNA의 세포질로의 이동을 방해하여 해당 유전자의 단백질 번역을 억제한다. 그러나, 해당 유전자 발현 조절 기전의 생물학적 중요성에 대해서는 보고된 바가 없었다.
연구팀은 역방향 알루 반복 구조(IRAlus)를 인지할 수 있는 항체를 활용한 차세대 염기서열 분석법을 사용해 특정 세포 내 활성화된, 기능적인 역방향 알루 반복 구조(IRAlus)를 가지고 있어 역방향 알루 반복 구조(IRAlus)에 의해 단백질 합성이 억제될 수 있는 mRNA 유전자 목록을 완성했다.
종양 형성 과정에서 역방향 알루 반복 구조(IRAlus)의 유전자 조절 기전의 영향을 분석했다. 연구팀은 대표적인 종양억제유전자를 억제하는 종양 유전자 조절을 하고 이는 단백질 발현 증가로 이어지며 결과적으로 종양억제유전자 활성이 억제됨으로써 암 발달을 촉진할 수 있다.
나아가, 특정 mRNA 서열과 상보적으로 결합해 mRNA의 기능을 억제해 다양한 질병 치료 및 조절 도구로 현재 연구되고 있는 혁신 RNA 치료제인 안티센스 올리고뉴클레오타이드(Antisense oligonucleotide, 이하 ASO)를 활용해 단백질 발현을 복구하는 암 치료 전략을 탐색했다.
연구팀은 신경계 세포에서 역방향 알루 반복 구조(IRAlus)로 인한 유전자 조절이 활발하다는 것을 확인했다. 또한, 해당 현상의 과도한 활성과 루게릭병으로 알려진 근위축성 측삭경화증을 비롯한 퇴행성 뇌질환 간의 연관성을 최초로 제시했다.
생명화학공학과 김유식 교수는 “이번 연구는 인간 유전체 내 반복서열인 역방향 알루 반복 구조(IRAlus)를 가지는 유전자를 목록화하는 것을 넘어서 해당 유전자 발현 조절이 인간 질환, 특히 종양 형성 및 퇴행성 뇌질환 발병과정에서 핵심적인 역할을 하는 것을 최초로 확인했다”면서 “이번 연구에서 제시한 역방향 알루 반복 구조(IRAlus)라는 새로운 타겟 물질을 활용하면 종양과 노화를 비롯해 다양한 퇴행성 질환의 발병 기전 분석에 근본적이고 효과적인 치료전략을 마련하는 데 유용할 것”이라고 말했다.
생명화학공학과 구자영 박사(현 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학 (Harvard Medical School) 박사후연구원)와 이건용 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 2월 2일 字에 온라인 게재됐다. (논문명 : Alternative Polyadenylation Determines the Functional Landscape of Inverted Alu Repeats).
우리 대학 생명과학과 임정훈 교수 연구팀과 의과학대학원 한진주 교수 연구팀이 참여한 이번 연구는 한국연구재단 기초연구실 지원사업과 KAIST 도약연구사업의 지원을 받아 수행됐다.
2024.02.06 조회수 6710 인공지능으로 인간 추론 능력 극대화시키다
최근 인공지능 기술이 인식, 생성, 제어, 대화와 같은 실제 문제를 빠르게 해결해 나감에 따라 인간의 역할과 일자리 생태계가 변화하고 있다. 인공지능의 발전 속도를 본다면 가까운 미래에는 인공지능이 인간보다 똑똑해질 수도 있다. 이와 반대로 인공지능을 이용해 인간의 사고력 자체를 향상시킬 순 없을까?
우리 대학 뇌인지과학과 이상완 교수(신경과학-인공지능 융합연구센터장) 연구팀이 인간의 빠른 추론 능력을 유도해 인과관계의 학습 효율을 향상할 수 있는 뇌 기반 인공지능 기술 개발에 성공했다고 31일 밝혔다.
우리는 일상생활에서 다양한 사건을 경험하며 세상의 다양한 요소에 대한 인과관계를 학습해 나가고, 공부할 때는 지식 조각들을 조합하며 통합적인 지식을 습득한다. 이러한 과정은 점진적으로 추론하는 베이시안 모델 또는 특정한 상황에서 한 번의 경험으로부터 빠르게 결론을 도출하는 고속추론 또는 원샷 추론이 있다.
연구팀은 이전 연구에서 인간의 원샷 추론 과정을 모델링하고 전두엽과 해마가 이러한 과정에 관여하고 있음을 규명한 바 있다. 이번 연구에서 이 모델에 인간의 원샷 추론 과정을 특정한 상태로 유도하기 위해 알파고에 사용된 바 있는 심층 강화학습 기술을 접목했다. 이는 강화학습 알고리즘이 인간의 원샷 추론 과정을 수없이 시뮬레이션하면서 전두엽과 해마가 가장 효율적으로 학습할 수 있는 최적의 조건을 탐색하는 과정으로 볼 수 있다.
연구팀은 126명의 인간 피험자를 대상으로 한 인과관계 학습 및 추론 실험에서 제안 기술을 사용해 학습했을 때 단순 반복 학습 대비 최대 약 40%까지 학습 효율이 향상됨을 보였다. 더 나아가 오랜 시간에 걸쳐 신중하게 학습하거나 몇 가지 단서만을 조합해 빠르게 결론을 도출하는 것 같은 개인별 학습 성향을 고려한 맞춤형 설계가 가능함을 보였다.
인간의 사고체계에 대한 뇌과학적인 이해를 바탕으로 원샷 추론과 같은 인간의 잠재적 능력을 극대화하는 이 기술은 차세대 인공지능의 중요한 도전과제 중 하나이며, 뇌 기반 인공지능 기술은 인간과 유사한 사고체계를 바탕으로 가치판단을 할 수 있으므로 장기적으로 인간과 인공지능이 협업하는 분야에서 인공지능의 신뢰성 및 윤리성을 높이는 데도 기여할 수 있을 것으로 기대된다.
개발 기술은 스마트 교육, 게임 콘텐츠 개발, 추론 능력 측정, 인지훈련 등 인간의 추론 학습과 관련된 모든 분야에 적용될 수 있다. 기존 기술은 단편적인 기억회상, 특정 인지기능, 정답률 증가와 같은 행동적 측면에 집중해 왔다면, 이번 기술은 인공지능을 이용해 과거의 경험을 일반화시키는 인간의 사고체계 자체를 높이는 가능성을 확인한 최초의 사례로 평가된다.
KAIST에서 연구를 주도한 제1 저자 이지항 교수(현 상명대 서울캠퍼스 조교수)는 "이번 연구를 통해 인간의 인지기능을 인공지능에 이식하여 뇌 기반 인공지능을 실현하는 사례를 보였고, 이를 통해 인간의 고위 수준 인지를 적절한 방향으로 유도할 수 있는 새로운 인간-인공지능 상호작용 패러다임을 제시했다ˮ라고 강조하며, 추후 "인간중심 인공지능 연구 개발뿐만 아니라 바이오메디컬 분야, 특히 정신 건강과 관련된 디지털 치료 분야에 적용했을 때 큰 파급력을 보일 것ˮ이라고 말했다.
연구 책임자인 이상완 교수는 "이번 기술의 잠재력은 인공지능의 방대한 지식을 인간이 빠르게 흡수할 수 있는 형태로 변환할 수 있다는 데 있다ˮ며, "챗 GPT, GPT-4와 같은 언어 인공지능에서 추출되는 다양한 정보를 인간이 빠르게 추론 학습할 수 있게 변환하거나, 게임이나 가상현실의 콘텐츠를 인간의 추론 과정에 맞게 최적화해 몰입도를 높일 수 있고, 반대로 몰입도를 적절한 수준에서 제어할 경우 중독을 완화하는 효과를 기대할 수 있다ˮ라고 말했다.
관련 기술은 국내 및 해외에 특허 출원된 상태이며, KAIST 기술설명회(테크페어)에 소개된 바 있다. 이상완 교수 연구팀은 이러한 뇌 기반 인공지능 원천기술의 파급력을 높이기 위해 2019년 KAIST 신경과학-인공지능 융합연구센터를 설립하고, 구글 딥마인드, 마이크로소프트 연구소, IBM 연구소, 옥스퍼드 대학 등 다양한 해외 연구팀들과 함께 국제공동연구를 수행해 오고 있다.
이번 연구는 `시뮬레이션 기반 실험 디자인을 이용한 인간의 인과관계 추론과정 제어'라는 제목으로 국제 학술지 셀(Cell)의 오픈 액세스 저널인 `셀 리포트(Cell Reports)'에 1월 호 온라인판에 1월 30일 자 게재됐다. (논문명: Controlling human causal inference through in-silico task design)
한편 이번 연구는 삼성전자 미래기술육성센터, 과학기술정보통신부 정보통신기획평가원 SW스타랩 및 한국연구재단의 지원을 받아 수행됐다.
2024.01.31 조회수 7380
인공지능으로 인간 추론 능력 극대화시키다
최근 인공지능 기술이 인식, 생성, 제어, 대화와 같은 실제 문제를 빠르게 해결해 나감에 따라 인간의 역할과 일자리 생태계가 변화하고 있다. 인공지능의 발전 속도를 본다면 가까운 미래에는 인공지능이 인간보다 똑똑해질 수도 있다. 이와 반대로 인공지능을 이용해 인간의 사고력 자체를 향상시킬 순 없을까?
우리 대학 뇌인지과학과 이상완 교수(신경과학-인공지능 융합연구센터장) 연구팀이 인간의 빠른 추론 능력을 유도해 인과관계의 학습 효율을 향상할 수 있는 뇌 기반 인공지능 기술 개발에 성공했다고 31일 밝혔다.
우리는 일상생활에서 다양한 사건을 경험하며 세상의 다양한 요소에 대한 인과관계를 학습해 나가고, 공부할 때는 지식 조각들을 조합하며 통합적인 지식을 습득한다. 이러한 과정은 점진적으로 추론하는 베이시안 모델 또는 특정한 상황에서 한 번의 경험으로부터 빠르게 결론을 도출하는 고속추론 또는 원샷 추론이 있다.
연구팀은 이전 연구에서 인간의 원샷 추론 과정을 모델링하고 전두엽과 해마가 이러한 과정에 관여하고 있음을 규명한 바 있다. 이번 연구에서 이 모델에 인간의 원샷 추론 과정을 특정한 상태로 유도하기 위해 알파고에 사용된 바 있는 심층 강화학습 기술을 접목했다. 이는 강화학습 알고리즘이 인간의 원샷 추론 과정을 수없이 시뮬레이션하면서 전두엽과 해마가 가장 효율적으로 학습할 수 있는 최적의 조건을 탐색하는 과정으로 볼 수 있다.
연구팀은 126명의 인간 피험자를 대상으로 한 인과관계 학습 및 추론 실험에서 제안 기술을 사용해 학습했을 때 단순 반복 학습 대비 최대 약 40%까지 학습 효율이 향상됨을 보였다. 더 나아가 오랜 시간에 걸쳐 신중하게 학습하거나 몇 가지 단서만을 조합해 빠르게 결론을 도출하는 것 같은 개인별 학습 성향을 고려한 맞춤형 설계가 가능함을 보였다.
인간의 사고체계에 대한 뇌과학적인 이해를 바탕으로 원샷 추론과 같은 인간의 잠재적 능력을 극대화하는 이 기술은 차세대 인공지능의 중요한 도전과제 중 하나이며, 뇌 기반 인공지능 기술은 인간과 유사한 사고체계를 바탕으로 가치판단을 할 수 있으므로 장기적으로 인간과 인공지능이 협업하는 분야에서 인공지능의 신뢰성 및 윤리성을 높이는 데도 기여할 수 있을 것으로 기대된다.
개발 기술은 스마트 교육, 게임 콘텐츠 개발, 추론 능력 측정, 인지훈련 등 인간의 추론 학습과 관련된 모든 분야에 적용될 수 있다. 기존 기술은 단편적인 기억회상, 특정 인지기능, 정답률 증가와 같은 행동적 측면에 집중해 왔다면, 이번 기술은 인공지능을 이용해 과거의 경험을 일반화시키는 인간의 사고체계 자체를 높이는 가능성을 확인한 최초의 사례로 평가된다.
KAIST에서 연구를 주도한 제1 저자 이지항 교수(현 상명대 서울캠퍼스 조교수)는 "이번 연구를 통해 인간의 인지기능을 인공지능에 이식하여 뇌 기반 인공지능을 실현하는 사례를 보였고, 이를 통해 인간의 고위 수준 인지를 적절한 방향으로 유도할 수 있는 새로운 인간-인공지능 상호작용 패러다임을 제시했다ˮ라고 강조하며, 추후 "인간중심 인공지능 연구 개발뿐만 아니라 바이오메디컬 분야, 특히 정신 건강과 관련된 디지털 치료 분야에 적용했을 때 큰 파급력을 보일 것ˮ이라고 말했다.
연구 책임자인 이상완 교수는 "이번 기술의 잠재력은 인공지능의 방대한 지식을 인간이 빠르게 흡수할 수 있는 형태로 변환할 수 있다는 데 있다ˮ며, "챗 GPT, GPT-4와 같은 언어 인공지능에서 추출되는 다양한 정보를 인간이 빠르게 추론 학습할 수 있게 변환하거나, 게임이나 가상현실의 콘텐츠를 인간의 추론 과정에 맞게 최적화해 몰입도를 높일 수 있고, 반대로 몰입도를 적절한 수준에서 제어할 경우 중독을 완화하는 효과를 기대할 수 있다ˮ라고 말했다.
관련 기술은 국내 및 해외에 특허 출원된 상태이며, KAIST 기술설명회(테크페어)에 소개된 바 있다. 이상완 교수 연구팀은 이러한 뇌 기반 인공지능 원천기술의 파급력을 높이기 위해 2019년 KAIST 신경과학-인공지능 융합연구센터를 설립하고, 구글 딥마인드, 마이크로소프트 연구소, IBM 연구소, 옥스퍼드 대학 등 다양한 해외 연구팀들과 함께 국제공동연구를 수행해 오고 있다.
이번 연구는 `시뮬레이션 기반 실험 디자인을 이용한 인간의 인과관계 추론과정 제어'라는 제목으로 국제 학술지 셀(Cell)의 오픈 액세스 저널인 `셀 리포트(Cell Reports)'에 1월 호 온라인판에 1월 30일 자 게재됐다. (논문명: Controlling human causal inference through in-silico task design)
한편 이번 연구는 삼성전자 미래기술육성센터, 과학기술정보통신부 정보통신기획평가원 SW스타랩 및 한국연구재단의 지원을 받아 수행됐다.
2024.01.31 조회수 7380 화학공장 대체 방안 ‘아이브릿지’에서 찾다
기후 변화와 환경 문제가 심각하게 대두됨에 따라 현재의 화학 공장을 대체할 수 있는 지속가능한 미생물 세포공장이 크게 주목받고 있다. 미생물 세포공장으로 활용할 미생물을 개량하기 위해선 미생물이 가진 유전자들의 발현을 증폭 또는 억제해 유용한 화합물을 생산하도록 미생물 대사 메커니즘을 개량해야 하지만, 어떠한 유전자를 증폭하고 억제할 것인지 결정하는 것은 지금까지 어려운 문제로 남아있다.
우리 대학 이상엽 특훈교수 연구팀이 아이브릿지(iBridge)라는 시뮬레이션 프로그램을 개발하여 생산하고자 하는 화합물에 맞춤형 미생물 공장을 구축할 수 있도록 과발현 및 억제 유전자들을 예측함으로써 미생물 공장을 적은 비용으로 빠르고 효율적으로 구축하는 방법을 제시했다고 9일 밝혔다.
이상엽 특훈교수가 창시한 시스템 대사공학은 유전공학, 합성생물학, 시스템생물학, 발효공학 등을 접목해 개량한 미생물을 이용해 유용한 화합물들을 생산하는 분야다. 미생물을 목표로 하는 유용한 화합물을 생산하도록 개량하기 위해선 미생물의 유전자들을 삭제, 발현억제, 과발현 등이 필수적이지만, 이를 일일이 실험적으로 확인하지 않고서는 여전히 전문가들조차 판별하기 어려워 많은 시간과 자원이 소모된다.
연구팀은 신규 개발된 아이브릿지(iBridge) 시뮬레이션을 활용해 세 가지의 유용한 화합물을 세계 최고 수준으로 생산하는 대장균 미생물 세포공장을 구축하는 데 성공했다. 연구팀은 많은 화장품에서 보습제 역할을 하는 판테놀, 나일론의 원료인 퓨트레신, 항균성 식품첨가제인 4-하이드록시페닐젖산 등을 생산하는 대장균 균주를 개발하고, 신규 개발된 시뮬레이션 아이브릿지(iBridge)를 활용해 세계 최고 농도로 이들 화합물을 생산하는 공정을 개발했다. 그뿐만 아니라 연구팀은 이들 세 가지 외에도 산업적으로 유용한 화합물 298 여종의 미생물 공장을 구축하기 위한 과발현 및 억제 유전자들을 예측해 제시했다.
이번 논문의 공동 제1 저자인 우리 대학 이영준 박사는 “이번에 개발된 시뮬레이션을 이용하니 여러 가지 미생물 공장들이 기존방법보다 월등히 빠른 속도로 구축됐다”며 “더 다양한 유용한 화합물들을 생산하는 미생물 세포공장들이 이 기술을 활용해 빠르게 구축될 수 있을 것”이라고 말했다.
또한 이상엽 특훈교수는 “시스템 대사공학은 현재 우리가 해결해야 할 기후변화문제에 접근하는 매우 중요한 기술”이라며 “이 시뮬레이션은 기존의 화학 공장을 친환경 미생물 공장으로 대체하는 시기를 앞당기는 데 크게 기여할 수 있을 것”이라고 밝혔다.
생물공정연구센터 김원준 박사, 이영준 박사, 생명화학공학과 김현욱 교수와 이상엽 특훈교수가 참여한 이번 논문은 셀 (Cell) 誌가 발행하는 `셀 시스템즈 (Cell Systems)'에 동료심사를 거쳐 11월 6일 온라인판에 게재됐다.
※ 논문명 : 세포 내 화학반응 속도의 공분산의 합을 활용한 게놈 수준 과발현 및 억제 유전자 예측 (Genome-Wide Identification of Overexpression and Downregulation Gene Targets Based on the Sum of Covariances of the Outgoing Reaction Fluxes)
※ 저자 정보 : 김원준 (한국과학기술원, 공동 제1 저자), 이영준 (한국과학기술원, 공동 제1 저자), 김현욱 (한국과학기술원, 공동 제1 저자) 및 이상엽(한국과학기술원, 교신저자) 포함 총 6 명
한편, 이번 연구는 과기정통부가 지원하는 ‘석유대체 친환경 화학기술개발사업의 ‘바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발’ 과제(과제책임자 KAIST 이상엽 특훈교수) 및 바이오매스기반 탄소중립형 바이오플라스틱 제품기술개발사업’ 과제(과제책임자 KAIST 최소영 연구교수)의 지원을 받아 수행됐다.
아이브릿지 사이트: https://github.com/kaistsystemsbiology/iBridge.git
2023.11.09 조회수 7824
화학공장 대체 방안 ‘아이브릿지’에서 찾다
기후 변화와 환경 문제가 심각하게 대두됨에 따라 현재의 화학 공장을 대체할 수 있는 지속가능한 미생물 세포공장이 크게 주목받고 있다. 미생물 세포공장으로 활용할 미생물을 개량하기 위해선 미생물이 가진 유전자들의 발현을 증폭 또는 억제해 유용한 화합물을 생산하도록 미생물 대사 메커니즘을 개량해야 하지만, 어떠한 유전자를 증폭하고 억제할 것인지 결정하는 것은 지금까지 어려운 문제로 남아있다.
우리 대학 이상엽 특훈교수 연구팀이 아이브릿지(iBridge)라는 시뮬레이션 프로그램을 개발하여 생산하고자 하는 화합물에 맞춤형 미생물 공장을 구축할 수 있도록 과발현 및 억제 유전자들을 예측함으로써 미생물 공장을 적은 비용으로 빠르고 효율적으로 구축하는 방법을 제시했다고 9일 밝혔다.
이상엽 특훈교수가 창시한 시스템 대사공학은 유전공학, 합성생물학, 시스템생물학, 발효공학 등을 접목해 개량한 미생물을 이용해 유용한 화합물들을 생산하는 분야다. 미생물을 목표로 하는 유용한 화합물을 생산하도록 개량하기 위해선 미생물의 유전자들을 삭제, 발현억제, 과발현 등이 필수적이지만, 이를 일일이 실험적으로 확인하지 않고서는 여전히 전문가들조차 판별하기 어려워 많은 시간과 자원이 소모된다.
연구팀은 신규 개발된 아이브릿지(iBridge) 시뮬레이션을 활용해 세 가지의 유용한 화합물을 세계 최고 수준으로 생산하는 대장균 미생물 세포공장을 구축하는 데 성공했다. 연구팀은 많은 화장품에서 보습제 역할을 하는 판테놀, 나일론의 원료인 퓨트레신, 항균성 식품첨가제인 4-하이드록시페닐젖산 등을 생산하는 대장균 균주를 개발하고, 신규 개발된 시뮬레이션 아이브릿지(iBridge)를 활용해 세계 최고 농도로 이들 화합물을 생산하는 공정을 개발했다. 그뿐만 아니라 연구팀은 이들 세 가지 외에도 산업적으로 유용한 화합물 298 여종의 미생물 공장을 구축하기 위한 과발현 및 억제 유전자들을 예측해 제시했다.
이번 논문의 공동 제1 저자인 우리 대학 이영준 박사는 “이번에 개발된 시뮬레이션을 이용하니 여러 가지 미생물 공장들이 기존방법보다 월등히 빠른 속도로 구축됐다”며 “더 다양한 유용한 화합물들을 생산하는 미생물 세포공장들이 이 기술을 활용해 빠르게 구축될 수 있을 것”이라고 말했다.
또한 이상엽 특훈교수는 “시스템 대사공학은 현재 우리가 해결해야 할 기후변화문제에 접근하는 매우 중요한 기술”이라며 “이 시뮬레이션은 기존의 화학 공장을 친환경 미생물 공장으로 대체하는 시기를 앞당기는 데 크게 기여할 수 있을 것”이라고 밝혔다.
생물공정연구센터 김원준 박사, 이영준 박사, 생명화학공학과 김현욱 교수와 이상엽 특훈교수가 참여한 이번 논문은 셀 (Cell) 誌가 발행하는 `셀 시스템즈 (Cell Systems)'에 동료심사를 거쳐 11월 6일 온라인판에 게재됐다.
※ 논문명 : 세포 내 화학반응 속도의 공분산의 합을 활용한 게놈 수준 과발현 및 억제 유전자 예측 (Genome-Wide Identification of Overexpression and Downregulation Gene Targets Based on the Sum of Covariances of the Outgoing Reaction Fluxes)
※ 저자 정보 : 김원준 (한국과학기술원, 공동 제1 저자), 이영준 (한국과학기술원, 공동 제1 저자), 김현욱 (한국과학기술원, 공동 제1 저자) 및 이상엽(한국과학기술원, 교신저자) 포함 총 6 명
한편, 이번 연구는 과기정통부가 지원하는 ‘석유대체 친환경 화학기술개발사업의 ‘바이오화학산업 선도를 위한 차세대 바이오리파이너리 원천기술 개발’ 과제(과제책임자 KAIST 이상엽 특훈교수) 및 바이오매스기반 탄소중립형 바이오플라스틱 제품기술개발사업’ 과제(과제책임자 KAIST 최소영 연구교수)의 지원을 받아 수행됐다.
아이브릿지 사이트: https://github.com/kaistsystemsbiology/iBridge.git
2023.11.09 조회수 7824 뇌종양 면역치료를 고 포도당 음료로?
뇌에서 발생하는 가장 흔한 악성 뇌종양인 교모세포종은 현재 수술, 항암화학요법, 그리고 방사선치료로 대표되는 암치료요법을 모두 동원해도 평균 생존 기간이 평균 15개월 정도밖에 되지 않는 치료가 매우 힘든 암종이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 실험 쥐 모델에서 고 포도당 음료 보충을 통해 뇌종양의 성장이 억제되는 현상을 관측했고 이에 더해 이러한 억제 효과가 장내 미생물의 특정 균주 변화를 통해 암세포 증식을 억제하는 항종양 면역반응을 증진한 작용원리를 규명했다고 16일 밝혔다.
장내 미생물은 우리 몸과 긴밀한 관련이 있으며, 악성종양에 대한 항종양 면역반응을 조절하는 데 중요한 역할을 하는 것으로 최근 연구에서 알려졌다. 하지만 대다수의 연구가 항종양 면역반응이 활성화된 흑색종과 같은 암종에서 연구가 이뤄졌으며, 뇌종양에 미치는 영향에 대해서는 거의 알려진 바가 없었다.
이번 연구에서 연구팀은 고 포도당 음료와 특정 균주의 복합처리가 뇌종양 내 면역세포 중 T 세포, 특히 CD4+ T 세포의 아형에서 세포독성 기능이 증대되는 것을 단일 세포 전사체 분석을 통해 확인했고, 더 나아가 암미세환경에서 탈진한 T 세포를 재활성화하는 면역관문억제제인 항 PD-1 항체와 복합처리시 탈진된 T세포 표면에 있는 단백질(PD-1)과 결합하여 T 세포 재활성을 유도하여 항암면역 치료의 효과를 더 증진함을 확인했다.
이러한 연구 결과는 기존 면역관문억제제의 효과가 미미했던 교모세포종에서 장내 미생물, 장내 미생물 유래 대사체, 또는 균주 유래 물질의 복합처리를 통해 항종양 면역기능을 향상하는 방식의 뇌종양 치료가 가능하다는 것을 보여주는 결과로, 추후 교모세포종에 항 PD-1 항체와 같은 면역관문억제제 치료를 적용하는데 응용될 수 있을 것으로 기대된다.
이번 연구를 주도한 KAIST 의과학대학원 김재호 박사는 "그동안 잘 알려지지 않은 장내 미생물 분석을 통해 뇌종양 성장을 억제할 수 있는 균주를 확보했으며 이러한 균주에 의한 항 뇌종양 면역조절 기전을 규명한 중요한 연구”라고 설명했다. 이흥규 교수는 “면역관문 치료제에 의한 뇌종양 치료 임상 시험 실패를 극복할 수 있는 대안으로 면역관문 치료제와 뇌종양 억제 유용 균주의 복합 치료를 통해 뇌종양 치료의 가능성을 보여준 동물실험 결과로 향후 장내 미생물을 이용한 항암 치료제 개발의 실마리를 제공할 것으로 기대한다ˮ 라고 연구 결과를 소개했다.
의과학대학원 김재호 박사(現, 미국 LA 소재 시티오브호프 암센터 방사선종양학과 박사후연구원)가 제1 저자로 참여한 이번 연구는 생명과학 분야 국제 학술지 `셀 리포트 (Cell Reports)'에 10월 6일 字 온라인판에 게재됐다. (논문명: Supplementation with a high-glucose drink stimulates anti-tumor immune responses to glioblastoma via gut microbiota modulation)
한편 이번 연구는 한국연구재단 바이오의료기술개발사업의 지원을 받아 수행됐다.
2023.10.16 조회수 7458
뇌종양 면역치료를 고 포도당 음료로?
뇌에서 발생하는 가장 흔한 악성 뇌종양인 교모세포종은 현재 수술, 항암화학요법, 그리고 방사선치료로 대표되는 암치료요법을 모두 동원해도 평균 생존 기간이 평균 15개월 정도밖에 되지 않는 치료가 매우 힘든 암종이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 실험 쥐 모델에서 고 포도당 음료 보충을 통해 뇌종양의 성장이 억제되는 현상을 관측했고 이에 더해 이러한 억제 효과가 장내 미생물의 특정 균주 변화를 통해 암세포 증식을 억제하는 항종양 면역반응을 증진한 작용원리를 규명했다고 16일 밝혔다.
장내 미생물은 우리 몸과 긴밀한 관련이 있으며, 악성종양에 대한 항종양 면역반응을 조절하는 데 중요한 역할을 하는 것으로 최근 연구에서 알려졌다. 하지만 대다수의 연구가 항종양 면역반응이 활성화된 흑색종과 같은 암종에서 연구가 이뤄졌으며, 뇌종양에 미치는 영향에 대해서는 거의 알려진 바가 없었다.
이번 연구에서 연구팀은 고 포도당 음료와 특정 균주의 복합처리가 뇌종양 내 면역세포 중 T 세포, 특히 CD4+ T 세포의 아형에서 세포독성 기능이 증대되는 것을 단일 세포 전사체 분석을 통해 확인했고, 더 나아가 암미세환경에서 탈진한 T 세포를 재활성화하는 면역관문억제제인 항 PD-1 항체와 복합처리시 탈진된 T세포 표면에 있는 단백질(PD-1)과 결합하여 T 세포 재활성을 유도하여 항암면역 치료의 효과를 더 증진함을 확인했다.
이러한 연구 결과는 기존 면역관문억제제의 효과가 미미했던 교모세포종에서 장내 미생물, 장내 미생물 유래 대사체, 또는 균주 유래 물질의 복합처리를 통해 항종양 면역기능을 향상하는 방식의 뇌종양 치료가 가능하다는 것을 보여주는 결과로, 추후 교모세포종에 항 PD-1 항체와 같은 면역관문억제제 치료를 적용하는데 응용될 수 있을 것으로 기대된다.
이번 연구를 주도한 KAIST 의과학대학원 김재호 박사는 "그동안 잘 알려지지 않은 장내 미생물 분석을 통해 뇌종양 성장을 억제할 수 있는 균주를 확보했으며 이러한 균주에 의한 항 뇌종양 면역조절 기전을 규명한 중요한 연구”라고 설명했다. 이흥규 교수는 “면역관문 치료제에 의한 뇌종양 치료 임상 시험 실패를 극복할 수 있는 대안으로 면역관문 치료제와 뇌종양 억제 유용 균주의 복합 치료를 통해 뇌종양 치료의 가능성을 보여준 동물실험 결과로 향후 장내 미생물을 이용한 항암 치료제 개발의 실마리를 제공할 것으로 기대한다ˮ 라고 연구 결과를 소개했다.
의과학대학원 김재호 박사(現, 미국 LA 소재 시티오브호프 암센터 방사선종양학과 박사후연구원)가 제1 저자로 참여한 이번 연구는 생명과학 분야 국제 학술지 `셀 리포트 (Cell Reports)'에 10월 6일 字 온라인판에 게재됐다. (논문명: Supplementation with a high-glucose drink stimulates anti-tumor immune responses to glioblastoma via gut microbiota modulation)
한편 이번 연구는 한국연구재단 바이오의료기술개발사업의 지원을 받아 수행됐다.
2023.10.16 조회수 7458 뇌의 선천적 수량 비교 원리 규명
뇌의 선천적 인지 기능들은 학습이나 훈련 없이 신경망의 구조적 특성으로부터 자발적으로 발생할 수 있는 것인가?
우리 대학 뇌인지과학과 백세범 교수 연구팀이 두뇌에서 발견되는 선천적 수량 비교 능력이 자발적으로 형성되는 원리를 설명했다고 7일 밝혔다.
주어진 사물들의 수량을 비교하는 기능은 동물이나 인간의 생존에 필수적인 능력이다. 동물 그룹 간 다툼, 사냥, 먹이 수집 등 많은 상황에서 주어진 변수들의 수량 비율이나 차이에 따라 동물들의 의사결정 및 행동이 달라져야 하기 때문이다. 학습을 거치지 않은 어린 개체들의 행동 관찰로부터 수량 비교 능력은 두뇌의 선천적 기능이라는 가능성이 제기됐지만 이러한 능력이 학습 없이 발생하는 원리에 대한 설명은 아직 제시되지 않았다.
백세범 교수 연구팀은 두뇌 모사 인공신경망 모델을 활용해, 학습이 전혀 이뤄지지 않은 심층신경망 구조에서 시각적 수량 비율 및 차이 정보의 인지 기능이 자발적으로 발생할 수 있음을 증명했다. 또한 두 수량의 비율과 차이라는 서로 다른 종류의 정보를 비교하는 기능이 하나의 공통적인 발생 원리로부터 파생될 수 있다고 설명했다.
우리 대학 바이오및뇌공학과 이현수 박사과정, NYU 신경과학과 최우철 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘셀(Cell)’의 온라인 자매지 ‘셀 리포츠(Cell Reports)’ 7월 29일 자에 게재됐다. (논문명: Comparison of visual quantities in untrained neural networks)
연구팀은 먼저 전혀 학습을 거치지 않은 신경망에서 두 수량의 비율과 차이에 선택적으로 반응하는 개별 신경세포가 자발적으로 발생하는 것을 발견했다. 초기화된 심층신경망에서 다양한 비율 혹은 차이를 가지는 시각적 수량 정보가 주어졌을 때, 이에 선택적으로 반응하는 신경세포들이 다수 발견되며, 이들로부터 측정된 신경 활동은 실제 동물 실험에서 관측된 신경 활동 특성과 매우 유사함을 확인하였다. 또한 연구팀은 이를 이용하여 지금까지 보고되어 온 동물들의 수량 비교 행동 특성을 상당 부분 재현할 수 있음을 확인했다.
이에 더해, 연구팀은 수량 비교 기능 신경세포 회로 구조의 발생 원리를 계산신경과학적 모델을 통해 설명하고 검증했다. 신경망에서 발견된 비율/차이 선택적 신경세포의 특징적 연결구조를 분석해, 특정 값에 대한 선택성이 신경망 하위 계층에서 자발적으로 발생된 단순 증가, 단순 감소 신경 활동의 결합을 통해 형성될 수 있음을 보였다. 또한 이러한 신경 활동이 증가, 감소할 때 관찰되는 비선형성의 타입에 따라 각각 수량 비율 또는 수량 차이를 인지하는 신경세포로 분화될 수 있음을 연구팀은 확인했다.
이러한 결과들을 통해 연구팀은 학습이 전혀 이뤄지지 않은 두뇌에서 비율/차이 인지와 같은 선천적 수량 비교 기능이 발생하는 원리에 대한 근본적인 이해를 제시했다.
백세범 교수는 “이번 연구는 상당한 정도의 학습 과정이 필요할 것이라 여겨지던 두뇌의 수량 인지 및 비교, 연산 기능이 그 어떤 학습도 이뤄지지 않은 초기 두뇌의 구조에서 자발적으로 발생할 수 있음을 보이는 연구”라며, “발생 초기 신경망의 구조적/물리적 특성으로부터 다양한 선천적 고등 인지 기능이 발생할 수 있음을 시사함으로써 뇌신경과학 연구뿐 아니라 새로운 개념의 인공지능 연구에도 의미있는 방향을 제시할 수 있을 것이라 기대한다”고 언급했다.
한편 이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업, KAIST 특이점교수 사업의 지원을 받아 수행됐다.
2023.08.07 조회수 7266
뇌의 선천적 수량 비교 원리 규명
뇌의 선천적 인지 기능들은 학습이나 훈련 없이 신경망의 구조적 특성으로부터 자발적으로 발생할 수 있는 것인가?
우리 대학 뇌인지과학과 백세범 교수 연구팀이 두뇌에서 발견되는 선천적 수량 비교 능력이 자발적으로 형성되는 원리를 설명했다고 7일 밝혔다.
주어진 사물들의 수량을 비교하는 기능은 동물이나 인간의 생존에 필수적인 능력이다. 동물 그룹 간 다툼, 사냥, 먹이 수집 등 많은 상황에서 주어진 변수들의 수량 비율이나 차이에 따라 동물들의 의사결정 및 행동이 달라져야 하기 때문이다. 학습을 거치지 않은 어린 개체들의 행동 관찰로부터 수량 비교 능력은 두뇌의 선천적 기능이라는 가능성이 제기됐지만 이러한 능력이 학습 없이 발생하는 원리에 대한 설명은 아직 제시되지 않았다.
백세범 교수 연구팀은 두뇌 모사 인공신경망 모델을 활용해, 학습이 전혀 이뤄지지 않은 심층신경망 구조에서 시각적 수량 비율 및 차이 정보의 인지 기능이 자발적으로 발생할 수 있음을 증명했다. 또한 두 수량의 비율과 차이라는 서로 다른 종류의 정보를 비교하는 기능이 하나의 공통적인 발생 원리로부터 파생될 수 있다고 설명했다.
우리 대학 바이오및뇌공학과 이현수 박사과정, NYU 신경과학과 최우철 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘셀(Cell)’의 온라인 자매지 ‘셀 리포츠(Cell Reports)’ 7월 29일 자에 게재됐다. (논문명: Comparison of visual quantities in untrained neural networks)
연구팀은 먼저 전혀 학습을 거치지 않은 신경망에서 두 수량의 비율과 차이에 선택적으로 반응하는 개별 신경세포가 자발적으로 발생하는 것을 발견했다. 초기화된 심층신경망에서 다양한 비율 혹은 차이를 가지는 시각적 수량 정보가 주어졌을 때, 이에 선택적으로 반응하는 신경세포들이 다수 발견되며, 이들로부터 측정된 신경 활동은 실제 동물 실험에서 관측된 신경 활동 특성과 매우 유사함을 확인하였다. 또한 연구팀은 이를 이용하여 지금까지 보고되어 온 동물들의 수량 비교 행동 특성을 상당 부분 재현할 수 있음을 확인했다.
이에 더해, 연구팀은 수량 비교 기능 신경세포 회로 구조의 발생 원리를 계산신경과학적 모델을 통해 설명하고 검증했다. 신경망에서 발견된 비율/차이 선택적 신경세포의 특징적 연결구조를 분석해, 특정 값에 대한 선택성이 신경망 하위 계층에서 자발적으로 발생된 단순 증가, 단순 감소 신경 활동의 결합을 통해 형성될 수 있음을 보였다. 또한 이러한 신경 활동이 증가, 감소할 때 관찰되는 비선형성의 타입에 따라 각각 수량 비율 또는 수량 차이를 인지하는 신경세포로 분화될 수 있음을 연구팀은 확인했다.
이러한 결과들을 통해 연구팀은 학습이 전혀 이뤄지지 않은 두뇌에서 비율/차이 인지와 같은 선천적 수량 비교 기능이 발생하는 원리에 대한 근본적인 이해를 제시했다.
백세범 교수는 “이번 연구는 상당한 정도의 학습 과정이 필요할 것이라 여겨지던 두뇌의 수량 인지 및 비교, 연산 기능이 그 어떤 학습도 이뤄지지 않은 초기 두뇌의 구조에서 자발적으로 발생할 수 있음을 보이는 연구”라며, “발생 초기 신경망의 구조적/물리적 특성으로부터 다양한 선천적 고등 인지 기능이 발생할 수 있음을 시사함으로써 뇌신경과학 연구뿐 아니라 새로운 개념의 인공지능 연구에도 의미있는 방향을 제시할 수 있을 것이라 기대한다”고 언급했다.
한편 이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업, KAIST 특이점교수 사업의 지원을 받아 수행됐다.
2023.08.07 조회수 7266