-
 간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
2024.08.08
조회수 5412
-
 장 조직의 항상성과 염증성 장염 회복의 핵심 효소 발견
우리 대학 생명과학과 김세윤, 양한슬 교수 공동연구팀이 `장 상피조직의 발생과 염증성 장염 회복과정의 핵심 효소발굴'에 성공했다고 6일 밝혔다.
생명과학과 박승은 박사, 이동은 박사과정 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지인 `세포 및 분자 소화기학 및 간장학 (Cellular and Molecular Gastroenterology & Hepatology)'에 지난 8월 19일 字 온라인 게재됐다.
※ 논문명 : Gut Epithelial Inositol Polyphosphate Multikinase Alleviates Experimental Colitis via Governing Tuft Cell Homeostasis
※ 저자 정보 : 박승은 (한국과학기술원, 공동 제1 저자), 이동은 (한국과학기술원, 공동 제1 저자), 정재웅 (연세대학교 의과대학, 제2 저자), 이수형 (반더빌트 의과대학, 공동 저자), 박승주 (한국과학기술원, 공동 저자), 류재승 (한국과학기술원, 공동 저자), 오세규 (카이노젠, 공동 저자), 양한슬 (한국과학기술원, 공동 교신저자), 황성순 (연세대학교 의과대학, 공동 교신저자), 김세윤 (한국과학기술원, 공동 교신저자), 포함 총 10명
염증성 장 질환은 1980년대 중반까지만 해도 국내 발병률은 매우 낮은 질환이었으나 건강보험심사평가원 자료에 따르면 2011년 말 만성 염증성 장 질환인 크론병 환자가 1만3천여 명, 궤양성 대장염 환자가 2만9천여 명으로 집계됐으며 이후로도 환자 수가 빠르게 증가하고 있다.
궤양성 대장염과 크론병과 같은 염증성 장 질환(Inflammatory bowel disease)은 복통, 설사뿐 아니라 전신 무력감, 체중 감소, 장 천공 등의 합병증을 유발해 환자의 삶의 질을 크게 낮추는 심각한 질환이다.
이러한 염증성 장 질환은 아직 발병 메커니즘이 명확하게 규명되지 않았으며 서구화된 식습관과 함께 유전적 이상이나 면역학적 장애 또는 스트레스와 같은 환경적인 요인이 복합적으로 관여하는 것으로 여겨진다.
최근 염증성 장 질환의 환자군 일부에서 이노시톨 대사(체내 합성 또는 음식을 통하여 공급되는 이노시톨 영양소를 이노시톨 인산 물질들로 전환하는 세포 내 생화학적 반응)의 핵심 효소인 이노시톨 폴리인산 카이네이즈(Inositol polyphosphate multikinase, 이하 IPMK) 유전자에서 단일염기변이(single nucleotide polymorphism, SNP) 등이 보고됐다. IPMK 효소는 포유류의 이노시톨 대사에서 매우 중추적인 역할을 하는 단백질로서 세포의 성장과 대사뿐 아니라 면역 반응 및 중추 신경계 기억 조절 등의 다각적인 생물학적 기능을 수행하는 것으로 알려졌으나 소화기계에서의 생물학적 기능은 밝혀진 바가 전혀 없다.
이에 우리 대학 생명과학과 및 줄기세포 연구센터 김세윤 교수, 양한슬 교수 연구팀은 연세대학교 의과대학 황성순 교수 연구팀과의 공동연구를 통해 장 상피세포에서의 IPMK 효소의 역할규명연구를 다각적으로 수행했다.
연구팀은 먼저 장 상피세포에서 IPMK 유전자가 결손된 생쥐 연구모델을 제작했고 이를 분석한 결과에 따르면 정상적인 환경에서는 뚜렷한 장 조직의 구조와 기능에 있어 문제가 발생하지 않았다. 그러나 덱스트란 황산나트륨(DSS)을 투여해 대장염을 유발할 경우, IPMK 유전자가 결손된 생쥐로부터 대장염 회복반응이 현저하게 둔화됨을 관찰했고 이로부터 IPMK 효소가 손상된 대장 조직이 회복되는데 필수적인 인자임을 규명했다.
특히 연구팀은 IPMK 효소가 제거된 장 조직에서는 솔세포(tuft cell)의 발생과 기능에 심각한 장애가 발생함을 관찰했다. 솔세포란 소장과 대장뿐 아니라 흉선, 췌장 등에 존재하는 세포로서 표면에 미세 융모구조를 보이는 독특한 세포다. 장 조직의 전체 세포 중 불과 2~3% 이하로 존재하는 솔세포는 외부로부터의 기생충 감염에 대응하는 면역기능을 수행한다. 또한 솔세포로부터 합성돼 분비되는 아세틸콜린 신경전달물질은 장내 줄기세포 및 신경세포를 자극해 장 조직의 항상성 유지와 손상 복구에 중요한 기능을 담당하는 것으로 알려져 있다. 이러한 중요성에도 불구하고 솔세포의 발생과 기능을 조절하는 분자 타깃에 대한 이해는 극히 부족한 것으로 알려져 있다.
공동연구팀은 첨단 단일세포 RNA 유전자 배열 순서 분석기술(single cell RNA sequencing)을 통해 IPMK 효소가 제거된 장 상피조직에서 아세틸콜린 분비를 담당하는 솔세포군의 발생이 특이적으로 감소함을 규명했다. 또한 이러한 분석과정에서 생쥐의 대장에 존재하는 솔세포는 크게 면역기능을 담당하는 세포군, 아세틸콜린 분비 솔세포군 외에 유전자 발현 능력이 감소한 새로운 솔세포군이 있다는 사실을 발견해 학계에 최초 보고했다.
연구팀 관계자는 "발굴한 IPMK 효소에 기반한 아세틸콜린 분비성 솔세포의 발생 및 기능조절은 향후 장 상피조직의 항상성 유지의 학문적 이해와 더불어 염증성 장 질환의 진단 및 치료기술 개발 등에 적극적으로 활용될 것ˮ이라며 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 서경배과학재단, KAIST 줄기세포 연구센터 지원사업, KAIST 그랜드챌린지 30 (KC30) 사업 및 포스코청암펠로십의 지원을 받아 수행됐다.
장 조직의 항상성과 염증성 장염 회복의 핵심 효소 발견
우리 대학 생명과학과 김세윤, 양한슬 교수 공동연구팀이 `장 상피조직의 발생과 염증성 장염 회복과정의 핵심 효소발굴'에 성공했다고 6일 밝혔다.
생명과학과 박승은 박사, 이동은 박사과정 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지인 `세포 및 분자 소화기학 및 간장학 (Cellular and Molecular Gastroenterology & Hepatology)'에 지난 8월 19일 字 온라인 게재됐다.
※ 논문명 : Gut Epithelial Inositol Polyphosphate Multikinase Alleviates Experimental Colitis via Governing Tuft Cell Homeostasis
※ 저자 정보 : 박승은 (한국과학기술원, 공동 제1 저자), 이동은 (한국과학기술원, 공동 제1 저자), 정재웅 (연세대학교 의과대학, 제2 저자), 이수형 (반더빌트 의과대학, 공동 저자), 박승주 (한국과학기술원, 공동 저자), 류재승 (한국과학기술원, 공동 저자), 오세규 (카이노젠, 공동 저자), 양한슬 (한국과학기술원, 공동 교신저자), 황성순 (연세대학교 의과대학, 공동 교신저자), 김세윤 (한국과학기술원, 공동 교신저자), 포함 총 10명
염증성 장 질환은 1980년대 중반까지만 해도 국내 발병률은 매우 낮은 질환이었으나 건강보험심사평가원 자료에 따르면 2011년 말 만성 염증성 장 질환인 크론병 환자가 1만3천여 명, 궤양성 대장염 환자가 2만9천여 명으로 집계됐으며 이후로도 환자 수가 빠르게 증가하고 있다.
궤양성 대장염과 크론병과 같은 염증성 장 질환(Inflammatory bowel disease)은 복통, 설사뿐 아니라 전신 무력감, 체중 감소, 장 천공 등의 합병증을 유발해 환자의 삶의 질을 크게 낮추는 심각한 질환이다.
이러한 염증성 장 질환은 아직 발병 메커니즘이 명확하게 규명되지 않았으며 서구화된 식습관과 함께 유전적 이상이나 면역학적 장애 또는 스트레스와 같은 환경적인 요인이 복합적으로 관여하는 것으로 여겨진다.
최근 염증성 장 질환의 환자군 일부에서 이노시톨 대사(체내 합성 또는 음식을 통하여 공급되는 이노시톨 영양소를 이노시톨 인산 물질들로 전환하는 세포 내 생화학적 반응)의 핵심 효소인 이노시톨 폴리인산 카이네이즈(Inositol polyphosphate multikinase, 이하 IPMK) 유전자에서 단일염기변이(single nucleotide polymorphism, SNP) 등이 보고됐다. IPMK 효소는 포유류의 이노시톨 대사에서 매우 중추적인 역할을 하는 단백질로서 세포의 성장과 대사뿐 아니라 면역 반응 및 중추 신경계 기억 조절 등의 다각적인 생물학적 기능을 수행하는 것으로 알려졌으나 소화기계에서의 생물학적 기능은 밝혀진 바가 전혀 없다.
이에 우리 대학 생명과학과 및 줄기세포 연구센터 김세윤 교수, 양한슬 교수 연구팀은 연세대학교 의과대학 황성순 교수 연구팀과의 공동연구를 통해 장 상피세포에서의 IPMK 효소의 역할규명연구를 다각적으로 수행했다.
연구팀은 먼저 장 상피세포에서 IPMK 유전자가 결손된 생쥐 연구모델을 제작했고 이를 분석한 결과에 따르면 정상적인 환경에서는 뚜렷한 장 조직의 구조와 기능에 있어 문제가 발생하지 않았다. 그러나 덱스트란 황산나트륨(DSS)을 투여해 대장염을 유발할 경우, IPMK 유전자가 결손된 생쥐로부터 대장염 회복반응이 현저하게 둔화됨을 관찰했고 이로부터 IPMK 효소가 손상된 대장 조직이 회복되는데 필수적인 인자임을 규명했다.
특히 연구팀은 IPMK 효소가 제거된 장 조직에서는 솔세포(tuft cell)의 발생과 기능에 심각한 장애가 발생함을 관찰했다. 솔세포란 소장과 대장뿐 아니라 흉선, 췌장 등에 존재하는 세포로서 표면에 미세 융모구조를 보이는 독특한 세포다. 장 조직의 전체 세포 중 불과 2~3% 이하로 존재하는 솔세포는 외부로부터의 기생충 감염에 대응하는 면역기능을 수행한다. 또한 솔세포로부터 합성돼 분비되는 아세틸콜린 신경전달물질은 장내 줄기세포 및 신경세포를 자극해 장 조직의 항상성 유지와 손상 복구에 중요한 기능을 담당하는 것으로 알려져 있다. 이러한 중요성에도 불구하고 솔세포의 발생과 기능을 조절하는 분자 타깃에 대한 이해는 극히 부족한 것으로 알려져 있다.
공동연구팀은 첨단 단일세포 RNA 유전자 배열 순서 분석기술(single cell RNA sequencing)을 통해 IPMK 효소가 제거된 장 상피조직에서 아세틸콜린 분비를 담당하는 솔세포군의 발생이 특이적으로 감소함을 규명했다. 또한 이러한 분석과정에서 생쥐의 대장에 존재하는 솔세포는 크게 면역기능을 담당하는 세포군, 아세틸콜린 분비 솔세포군 외에 유전자 발현 능력이 감소한 새로운 솔세포군이 있다는 사실을 발견해 학계에 최초 보고했다.
연구팀 관계자는 "발굴한 IPMK 효소에 기반한 아세틸콜린 분비성 솔세포의 발생 및 기능조절은 향후 장 상피조직의 항상성 유지의 학문적 이해와 더불어 염증성 장 질환의 진단 및 치료기술 개발 등에 적극적으로 활용될 것ˮ이라며 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 서경배과학재단, KAIST 줄기세포 연구센터 지원사업, KAIST 그랜드챌린지 30 (KC30) 사업 및 포스코청암펠로십의 지원을 받아 수행됐다.
2022.10.06
조회수 10549
-
 기존 개념을 깬 새로운 면역 T 세포 발견
우리 대학 의과학대학원 신의철 교수 연구팀이 우리 대학 의과학대학원 박수형 교수, 연세대학교 의과대학 주동진, 박준용 교수팀과 공동 연구를 통해 선천면역과 적응면역의 특성을 모두 지니는 새로운 유형의 `NK 유사 T 세포'를 간에서 발견하고 그 작용 특성을 규명했다고 8일 밝혔다.
이번 연구는, 그동안 면역학의 영역에서 이분법적으로 나눠져 있던 선천면역과 적응면역의 경계에서 작동하는 새로운 면역세포를 발견하고 그 특성을 밝힘으로써 인체의 면역 반응을 새로운 시각에서 바라볼 수 있게 했다는 점에서 큰 의의가 있다.
의과학대학원 고준영 박사, 나민석 박사, 최승진 박사가 공동 제1 저자로 참여한 이번 연구 결과는 간장(肝腸)학 분야의 최고 국제 학술지 `간장학 저널(Journal of Hepatology)' 5월 26일 字 온라인판에 게재됐다 (논문명: Identification of a distinct NK-like hepatic T-cell population activated by NKG2C in a TCR-independent manner).
인체에 세균이나 바이러스 같은 병원성 미생물이 침입하면 먼저 선천면역이 작동한다. 선천면역은 신속하게 작동하는 장점이 있지만, 병원성 미생물의 종류를 구분하지 못하고 기억면역을 형성하지 못하는 단점이 있다. 한편 감염 후 4~5일 후부터는 적응면역이 서서히 작동한다. 적응면역은 느리게 활성화되는 대신 각각의 병원성 미생물을 구분하는 능력이 있고 회복 후에는 기억 면역 세포를 만들어 같은 미생물이 재침입하였을 때 재빠른 반응을 할 수 있다.
특히 바이러스 감염 시에는 바이러스에 감염된 세포를 제거하는 기능에 특화된 면역세포들이 중요한 역할을 하는데, 이들 중 NK 세포(자연살해 세포)는 선천면역, T 세포는 적응면역의 특성이 있는 대표적인 면역 세포다. 이 2가지 면역 세포는 바이러스에 감염된 세포를 인식하는 방식도 달라, T 세포는 바이러스 단백질 조각을 항원으로 감지하는 반면, NK 세포는 스트레스 분자 발현이 증가한 것을 통해 바이러스 감염 세포를 감지한다.
지금까지 면역학계에서는 이렇게 NK 세포와 T 세포를 명확히 구분되는 면역 세포로서 나누어 연구를 진행해 왔는데, 연구팀은 이번 연구를 통해 NK 세포와 T 세포의 특성을 모두 지니는 `NK 유사 T 세포'를 새롭게 발견한 것이다. 그리고 이러한 NK 유사 T 세포는 T 세포 수용체를 통해 바이러스 단백질 항원을 인식하는 대신에 NK 세포 수용체인 `NKG2C'를 통해 비정상 세포들을 감지하고 제거할 수 있다는 사실을 발견했다.
연구팀은 이번 연구에서 간에 존재하는 면역세포를 주로 분석했는데, 간은 면역학적으로 특이한 장기로 여겨지고 있다. 소장이나 대장으로부터 들어오는 혈액은 전신 순환계에 합류하기 전에 간을 먼저 지나게 된다. 이 과정에서 장으로부터 들어온 많은 외부 물질이나 병원성 미생물들은 간에서 걸러지게 되어, 간은 면역학적 1차 관문의 역할을 하게 된다. 한편 간은 면역학적 관용을 나타내는 장기로도 잘 알려져, 병원성 미생물에 대한 과도한 면역 반응을 조절하기도 한다. 연구팀은 이처럼 복잡하고 정교하게 조절되는 간의 면역학적 특성을 상세히 분석하기 위해 단일세포 전사체 분석이라는 최신 연구기법을 적용해 분석한 결과, 간 내에서 선천면역과 적응면역의 특성을 모두 지니는 NK 유사 T 세포를 발견했다. 그리고 B형간염 바이러스에 의한 만성 간 질환을 앓는 환자의 간에서는 이러한 NK 유사 T 세포의 수가 증가해 있는 것도 발견했다.
연구팀이 이번에 새롭게 발견한 NK 유사 T 세포가 바이러스 감염 등의 각종 질환에서 어떤 역할을 하는지는 아직 분명하지 않다. 현재 연구팀은 NK 유사 T 세포가 체내에서 감염뿐만 아니라 각종 원인에 의해 비정상적으로 변한 세포들을 선택적으로 제거해 체내 항상성을 유지하는 데 중요한 역할을 한다는 가설을 가지고 후속 연구를 활발히 진행하고 있다. 한편, 미국 스탠퍼드 의대의 마크 데이비스 교수 연구팀이 최근 NK 수용체를 발현하는 T 세포는 다른 면역세포의 기능을 억제한다는 논문을 사이언스지에 발표함에 따라, 연구팀은 이번에 발견한 NK 유사 T 세포가 체내 상황에 따라 면역억제 기능을 수행하는지에 대한 분석도 진행하고 있다.
이번 연구 결과는 연세의대 세브란스병원 외과 및 내과 연구팀과 KAIST 의과학대학원이 간의 면역학적 특성을 규명하기 위해 수행한 협동 연구의 성과로서, 중개 연구(translational research)를 통해 인간 면역학을 새롭게 이해하는 계기를 마련했다는 평가를 받는다.
의과학대학원 신의철 교수는 "최신 연구 방법인 단일세포 전사체 분석 기술을 이용해 복잡한 간장 내 면역세포들을 상세히 분석할 수 있었고, 그 결과로 새로운 유형의 면역 세포인 NK 유사 T 세포를 발견하게 된 중요한 연구ˮ라며 "앞으로 NK 유사 T 세포의 생리 및 병리적 기능을 밝히는 연구를 지속하겠다ˮ라고 말했다.
기존 개념을 깬 새로운 면역 T 세포 발견
우리 대학 의과학대학원 신의철 교수 연구팀이 우리 대학 의과학대학원 박수형 교수, 연세대학교 의과대학 주동진, 박준용 교수팀과 공동 연구를 통해 선천면역과 적응면역의 특성을 모두 지니는 새로운 유형의 `NK 유사 T 세포'를 간에서 발견하고 그 작용 특성을 규명했다고 8일 밝혔다.
이번 연구는, 그동안 면역학의 영역에서 이분법적으로 나눠져 있던 선천면역과 적응면역의 경계에서 작동하는 새로운 면역세포를 발견하고 그 특성을 밝힘으로써 인체의 면역 반응을 새로운 시각에서 바라볼 수 있게 했다는 점에서 큰 의의가 있다.
의과학대학원 고준영 박사, 나민석 박사, 최승진 박사가 공동 제1 저자로 참여한 이번 연구 결과는 간장(肝腸)학 분야의 최고 국제 학술지 `간장학 저널(Journal of Hepatology)' 5월 26일 字 온라인판에 게재됐다 (논문명: Identification of a distinct NK-like hepatic T-cell population activated by NKG2C in a TCR-independent manner).
인체에 세균이나 바이러스 같은 병원성 미생물이 침입하면 먼저 선천면역이 작동한다. 선천면역은 신속하게 작동하는 장점이 있지만, 병원성 미생물의 종류를 구분하지 못하고 기억면역을 형성하지 못하는 단점이 있다. 한편 감염 후 4~5일 후부터는 적응면역이 서서히 작동한다. 적응면역은 느리게 활성화되는 대신 각각의 병원성 미생물을 구분하는 능력이 있고 회복 후에는 기억 면역 세포를 만들어 같은 미생물이 재침입하였을 때 재빠른 반응을 할 수 있다.
특히 바이러스 감염 시에는 바이러스에 감염된 세포를 제거하는 기능에 특화된 면역세포들이 중요한 역할을 하는데, 이들 중 NK 세포(자연살해 세포)는 선천면역, T 세포는 적응면역의 특성이 있는 대표적인 면역 세포다. 이 2가지 면역 세포는 바이러스에 감염된 세포를 인식하는 방식도 달라, T 세포는 바이러스 단백질 조각을 항원으로 감지하는 반면, NK 세포는 스트레스 분자 발현이 증가한 것을 통해 바이러스 감염 세포를 감지한다.
지금까지 면역학계에서는 이렇게 NK 세포와 T 세포를 명확히 구분되는 면역 세포로서 나누어 연구를 진행해 왔는데, 연구팀은 이번 연구를 통해 NK 세포와 T 세포의 특성을 모두 지니는 `NK 유사 T 세포'를 새롭게 발견한 것이다. 그리고 이러한 NK 유사 T 세포는 T 세포 수용체를 통해 바이러스 단백질 항원을 인식하는 대신에 NK 세포 수용체인 `NKG2C'를 통해 비정상 세포들을 감지하고 제거할 수 있다는 사실을 발견했다.
연구팀은 이번 연구에서 간에 존재하는 면역세포를 주로 분석했는데, 간은 면역학적으로 특이한 장기로 여겨지고 있다. 소장이나 대장으로부터 들어오는 혈액은 전신 순환계에 합류하기 전에 간을 먼저 지나게 된다. 이 과정에서 장으로부터 들어온 많은 외부 물질이나 병원성 미생물들은 간에서 걸러지게 되어, 간은 면역학적 1차 관문의 역할을 하게 된다. 한편 간은 면역학적 관용을 나타내는 장기로도 잘 알려져, 병원성 미생물에 대한 과도한 면역 반응을 조절하기도 한다. 연구팀은 이처럼 복잡하고 정교하게 조절되는 간의 면역학적 특성을 상세히 분석하기 위해 단일세포 전사체 분석이라는 최신 연구기법을 적용해 분석한 결과, 간 내에서 선천면역과 적응면역의 특성을 모두 지니는 NK 유사 T 세포를 발견했다. 그리고 B형간염 바이러스에 의한 만성 간 질환을 앓는 환자의 간에서는 이러한 NK 유사 T 세포의 수가 증가해 있는 것도 발견했다.
연구팀이 이번에 새롭게 발견한 NK 유사 T 세포가 바이러스 감염 등의 각종 질환에서 어떤 역할을 하는지는 아직 분명하지 않다. 현재 연구팀은 NK 유사 T 세포가 체내에서 감염뿐만 아니라 각종 원인에 의해 비정상적으로 변한 세포들을 선택적으로 제거해 체내 항상성을 유지하는 데 중요한 역할을 한다는 가설을 가지고 후속 연구를 활발히 진행하고 있다. 한편, 미국 스탠퍼드 의대의 마크 데이비스 교수 연구팀이 최근 NK 수용체를 발현하는 T 세포는 다른 면역세포의 기능을 억제한다는 논문을 사이언스지에 발표함에 따라, 연구팀은 이번에 발견한 NK 유사 T 세포가 체내 상황에 따라 면역억제 기능을 수행하는지에 대한 분석도 진행하고 있다.
이번 연구 결과는 연세의대 세브란스병원 외과 및 내과 연구팀과 KAIST 의과학대학원이 간의 면역학적 특성을 규명하기 위해 수행한 협동 연구의 성과로서, 중개 연구(translational research)를 통해 인간 면역학을 새롭게 이해하는 계기를 마련했다는 평가를 받는다.
의과학대학원 신의철 교수는 "최신 연구 방법인 단일세포 전사체 분석 기술을 이용해 복잡한 간장 내 면역세포들을 상세히 분석할 수 있었고, 그 결과로 새로운 유형의 면역 세포인 NK 유사 T 세포를 발견하게 된 중요한 연구ˮ라며 "앞으로 NK 유사 T 세포의 생리 및 병리적 기능을 밝히는 연구를 지속하겠다ˮ라고 말했다.
2022.06.08
조회수 10505
-
 진원생명과학(주)과의 공동 연구로 C형간염 DNA백신 면역증강 효과 확인
의과학대학원 신의철 교수 연구팀이 기존 치료법이 모두 실패한 만성 C형간염 환자를 대상으로 DNA백신(GLS-6150)을 접종해 심각한 부작용 없이 매우 안전하면서도 C형간염 바이러스에 대한 T세포 면역반응을 높인다는 사실을 임상연구를 통해 밝혔다.
세브란스병원 소화기내과 안상훈 교수, 부산대학교병원 소화기내과 허정 교수, 진원생명과학과 공동으로 진행한 이번 연구에서는 특히 IFNL3라는 사이토카인 면역증강물질 유전자를 백신에 포함했다. 이를 통해 면역반응을 억제하는 조절 T세포(Treg)를 감소시키면서 C형간염 바이러스 면역반응의 핵심 역할을 하는 세포독성 T세포의 기능을 강화할 수 있음을 밝혀냈다.
신의철 교수, 세브란스병원 안상훈 교수, 부산대학교병원 허정 교수가 공동 교신저자로 참여한 이번 연구결과는 간 연구 분야의 국제적 전문 학술지인 ‘저널 오브 헤파톨로지(Journal of Hepatology)’ 2월 20일 자 온라인판에 게재됐다.(논문명: IFNL3-adjuvanted HCV DNA vaccine reduces regulatory T-cell frequency and increases virus-specific T-cell response)
이번 연구를 통해 만성 C형간염 환자, 특히 항바이러스제를 이용하여 치료받은 완치자의 HCV 재감염을 예방하고 만성 C형간염 고위험군의 HCV 감염을 예방하는 백신의 개발 가능성을 확인했다.
이번 임상연구는 지난 2013년 10월 식약처의 임상승인을 받아 세브란스병원과 부산대학교병원에서 기존치료법에 모두 실패한 만성 C형간염 환자 18명을 대상으로 DNA 백신(GLS-6150)의 안전성, 내약성 및 면역원성을 평가하기 위한 다기관·공개·용량 증량·1상 임상시험으로 수행됐다. 이 중 14명을 대상으로 2014년 9월 식약처로부터 추가 임상승인을 받아 2016년에 1상 임상연구를 모두 완료했다. (Clinicaltrials.gov 번호: NCT02027116)
해당 연구팀은 항바이러스제로 치료된 만성 C형간염 완치자를 대상으로 DNA 백신(GLS-6150)의 안전성과 내약성 및 면역원성을 평가하는 임상연구의 승인을 2018년 2월 식약처로부터 받아 현재 세브란스병원과 부산대학교병원에서 세 번째 1상 임상연구를 수행하고 있다. (Clinicaltrials.gov 번호: NCT03674125)
신의철 교수는“이번 연구를 통해 지난 30여 년 동안 실패했던 C형간염 예방백신 개발의 새로운 가능성을 발견했다”라며 “예방백신을 성공적으로 개발하면 가까운 미래에 C형간염 바이러스를 지구상에서 사라지게 할 수도 있을 것이다”라고 말했다.
이번 연구는 진원생명과학(주)의 지원을 받아 C형간염 DNA백신(GLS-6150)을 사용했다.
진원생명과학(주)과의 공동 연구로 C형간염 DNA백신 면역증강 효과 확인
의과학대학원 신의철 교수 연구팀이 기존 치료법이 모두 실패한 만성 C형간염 환자를 대상으로 DNA백신(GLS-6150)을 접종해 심각한 부작용 없이 매우 안전하면서도 C형간염 바이러스에 대한 T세포 면역반응을 높인다는 사실을 임상연구를 통해 밝혔다.
세브란스병원 소화기내과 안상훈 교수, 부산대학교병원 소화기내과 허정 교수, 진원생명과학과 공동으로 진행한 이번 연구에서는 특히 IFNL3라는 사이토카인 면역증강물질 유전자를 백신에 포함했다. 이를 통해 면역반응을 억제하는 조절 T세포(Treg)를 감소시키면서 C형간염 바이러스 면역반응의 핵심 역할을 하는 세포독성 T세포의 기능을 강화할 수 있음을 밝혀냈다.
신의철 교수, 세브란스병원 안상훈 교수, 부산대학교병원 허정 교수가 공동 교신저자로 참여한 이번 연구결과는 간 연구 분야의 국제적 전문 학술지인 ‘저널 오브 헤파톨로지(Journal of Hepatology)’ 2월 20일 자 온라인판에 게재됐다.(논문명: IFNL3-adjuvanted HCV DNA vaccine reduces regulatory T-cell frequency and increases virus-specific T-cell response)
이번 연구를 통해 만성 C형간염 환자, 특히 항바이러스제를 이용하여 치료받은 완치자의 HCV 재감염을 예방하고 만성 C형간염 고위험군의 HCV 감염을 예방하는 백신의 개발 가능성을 확인했다.
이번 임상연구는 지난 2013년 10월 식약처의 임상승인을 받아 세브란스병원과 부산대학교병원에서 기존치료법에 모두 실패한 만성 C형간염 환자 18명을 대상으로 DNA 백신(GLS-6150)의 안전성, 내약성 및 면역원성을 평가하기 위한 다기관·공개·용량 증량·1상 임상시험으로 수행됐다. 이 중 14명을 대상으로 2014년 9월 식약처로부터 추가 임상승인을 받아 2016년에 1상 임상연구를 모두 완료했다. (Clinicaltrials.gov 번호: NCT02027116)
해당 연구팀은 항바이러스제로 치료된 만성 C형간염 완치자를 대상으로 DNA 백신(GLS-6150)의 안전성과 내약성 및 면역원성을 평가하는 임상연구의 승인을 2018년 2월 식약처로부터 받아 현재 세브란스병원과 부산대학교병원에서 세 번째 1상 임상연구를 수행하고 있다. (Clinicaltrials.gov 번호: NCT03674125)
신의철 교수는“이번 연구를 통해 지난 30여 년 동안 실패했던 C형간염 예방백신 개발의 새로운 가능성을 발견했다”라며 “예방백신을 성공적으로 개발하면 가까운 미래에 C형간염 바이러스를 지구상에서 사라지게 할 수도 있을 것이다”라고 말했다.
이번 연구는 진원생명과학(주)의 지원을 받아 C형간염 DNA백신(GLS-6150)을 사용했다.
2020.03.25
조회수 17447
-
 조광현 교수, 간암 표적 치료제 내성 극복 위한 최적 약물조합 발견
〈 조 광 현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 간암 약물 치료의 효과를 높이는 새로운 방법을 찾아냈다. 특히 이번 연구는 바이오분야의 4차 산업혁명을 견인하고 있는 IT와 BT의 융합연구인 시스템생물학(Systems Biology) 연구로 이뤄졌다.
서울대병원 내과 윤정환 교수팀과 공동연구를 통해 이루어낸 이번 연구 결과는 국제 간 전문지인 헤파톨로지(Hepatology)에 게재됐다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업과 중견연구자지원사업의 지원을 받아 수행됐다.
간암은 전 세계적으로 남성에게는 다섯 번째, 여성에게는 일곱 번째로 발생률이 높은 암이며 암 사망원인의 두 번째를 차지한다. 특히 우리나라의 간암 사망률은 인구 10만 명 당 28.4명으로 경제협력개발기구(OECD) 국가 중 압도적인 1위이며 2위인 일본의 2배에 이르고 있다.
우리나라에서만 간암 환자가 매년 평균 1만 6000명이 새로 발생하고 있지만 5년 생존율이 12%에 미치지 못한다. 국가암정보센터에 따르면 지난해 암으로 사망한 사람 가운데 폐암이 1만 7399명으로 가장 많았고 간암은 1만 1311명으로 그 뒤를 이었다.
간암은 우리나라의 암 가운데 사회적 비용이 1위인 암이다. 그 이유는 다른 암에 비해 사망자가 많고 더 젊은 나이(40, 50대)에 사망하기 때문이다. 이에 부작용이 적고 생존율을 높여줄 수 있는 새로운 치료법 개발이 시급한 실정이다.
간암의 치료로는 수술 및 색전술, 약물 치료가 있지만 수술이 어려운 진행성 간암에서는 치료 방법이 극히 제한적이다.
진행성 간암의 표적 항암제로 소라페닙(Sorafenib)이 유일하게 승인돼 임상에서 쓰이고 있는데 국내에서만 매년 200억 원 이상 처방되고 있지만 일부 환자에서만 효능을 나타내며 또한 대부분의 경우 약제 내성이 발생한다.
소라페닙은 말기 간암 환자의 생존 기간을 약 3개월 정도 밖에 늘리지 못하지만 다국적 제약회사에 의해 개발된 많은 후발주자 약물들이 그 효과를 뛰어 넘는데 실패했다.
소라페닙은 다중타겟을 치료표적으로 하여 그 작용 기전이 모호하고 따라서 약제의 내성기전 또한 아직 잘 알려져 있지 않다.
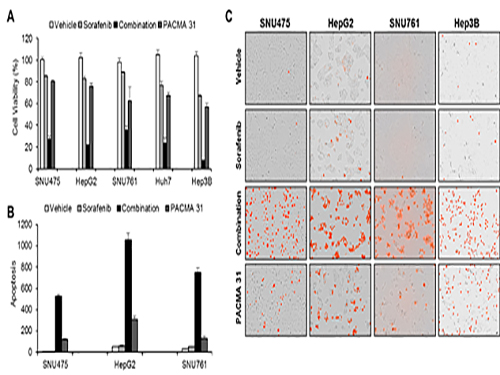
조광현 교수가 이끈 융합 연구팀은 소라페닙 작용 및 내성 기전을 규명하기 위해 소라페닙을 간암 세포에 처리하였을 때 세포내 분자 발현이 변화하는 것을 분석했다.
이를 통해 암세포가 소라페닙에 대항하는 기전을 알아냈고 시스템생물학적 분석을 실시하여 암세포내 단백질 이황화 이성질화 효소(protein disulfide isomerase, PDI)가 암세포가 소라페닙에 대항하는데 핵심적 역할을 하는 것을 발견했으며 이 효소를 차단했을 때 소라페닙의 효능이 훨씬 증가함을 관찰했다.
공동연구를 수행한 서울대병원 내과 윤정환 교수 연구팀은 쥐를 이용한 동물실험에서 소라페닙과 단백질 이황화 이성질화 효소 차단제를 같이 처리하면 간암 증식 억제에 시너지가 있음을 관찰하였고 소라페닙에 저항성을 가진 간암 환자의 조직에서 이 효소가 증가되어 있음을 관찰하여, 향후 임상 적용을 위한 가능성을 확인하였다.
조광현 교수는 “세포내 중요한 역할을 담당하는 분자들은 대부분 복잡한 조절관계 속에 놓여있기 때문에 기존의 직관적인 생물학 연구로 그 원리를 밝히는 것은 근본적인 한계가 있다. 이번 연구는 IT와 BT의 융합연구인 시스템생물학으로 그 한계를 극복할 수 있음을 보여주는 대표적인 사례로, 특히 암에 대한 표적 치료제 작용을 네트워크 차원에서 분석하여 내성을 극복할 수 있는 새로운 치료법을 개발할 수 있는 가능성을 제시하였다”고 말했다.
□ 사진 설명
사진1. 간암세포를 이용한 세포실험을 이용해 시뮬레이션 결과를 확인
사진2. 구축된 ER stress 네트워크를 이용한 네트워크 분석 및 컴퓨터 시뮬레이션 결과
사진3. 간암 세포가 소라페닙에 반응할 때 전사체 변화를 분석하여 ER stress 반응이 주요하게 나타남을 발견하게 된 ER stress 네트워크 모델
조광현 교수, 간암 표적 치료제 내성 극복 위한 최적 약물조합 발견
〈 조 광 현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 간암 약물 치료의 효과를 높이는 새로운 방법을 찾아냈다. 특히 이번 연구는 바이오분야의 4차 산업혁명을 견인하고 있는 IT와 BT의 융합연구인 시스템생물학(Systems Biology) 연구로 이뤄졌다.
서울대병원 내과 윤정환 교수팀과 공동연구를 통해 이루어낸 이번 연구 결과는 국제 간 전문지인 헤파톨로지(Hepatology)에 게재됐다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업과 중견연구자지원사업의 지원을 받아 수행됐다.
간암은 전 세계적으로 남성에게는 다섯 번째, 여성에게는 일곱 번째로 발생률이 높은 암이며 암 사망원인의 두 번째를 차지한다. 특히 우리나라의 간암 사망률은 인구 10만 명 당 28.4명으로 경제협력개발기구(OECD) 국가 중 압도적인 1위이며 2위인 일본의 2배에 이르고 있다.
우리나라에서만 간암 환자가 매년 평균 1만 6000명이 새로 발생하고 있지만 5년 생존율이 12%에 미치지 못한다. 국가암정보센터에 따르면 지난해 암으로 사망한 사람 가운데 폐암이 1만 7399명으로 가장 많았고 간암은 1만 1311명으로 그 뒤를 이었다.
간암은 우리나라의 암 가운데 사회적 비용이 1위인 암이다. 그 이유는 다른 암에 비해 사망자가 많고 더 젊은 나이(40, 50대)에 사망하기 때문이다. 이에 부작용이 적고 생존율을 높여줄 수 있는 새로운 치료법 개발이 시급한 실정이다.
간암의 치료로는 수술 및 색전술, 약물 치료가 있지만 수술이 어려운 진행성 간암에서는 치료 방법이 극히 제한적이다.
진행성 간암의 표적 항암제로 소라페닙(Sorafenib)이 유일하게 승인돼 임상에서 쓰이고 있는데 국내에서만 매년 200억 원 이상 처방되고 있지만 일부 환자에서만 효능을 나타내며 또한 대부분의 경우 약제 내성이 발생한다.
소라페닙은 말기 간암 환자의 생존 기간을 약 3개월 정도 밖에 늘리지 못하지만 다국적 제약회사에 의해 개발된 많은 후발주자 약물들이 그 효과를 뛰어 넘는데 실패했다.
소라페닙은 다중타겟을 치료표적으로 하여 그 작용 기전이 모호하고 따라서 약제의 내성기전 또한 아직 잘 알려져 있지 않다.
조광현 교수가 이끈 융합 연구팀은 소라페닙 작용 및 내성 기전을 규명하기 위해 소라페닙을 간암 세포에 처리하였을 때 세포내 분자 발현이 변화하는 것을 분석했다.
이를 통해 암세포가 소라페닙에 대항하는 기전을 알아냈고 시스템생물학적 분석을 실시하여 암세포내 단백질 이황화 이성질화 효소(protein disulfide isomerase, PDI)가 암세포가 소라페닙에 대항하는데 핵심적 역할을 하는 것을 발견했으며 이 효소를 차단했을 때 소라페닙의 효능이 훨씬 증가함을 관찰했다.
공동연구를 수행한 서울대병원 내과 윤정환 교수 연구팀은 쥐를 이용한 동물실험에서 소라페닙과 단백질 이황화 이성질화 효소 차단제를 같이 처리하면 간암 증식 억제에 시너지가 있음을 관찰하였고 소라페닙에 저항성을 가진 간암 환자의 조직에서 이 효소가 증가되어 있음을 관찰하여, 향후 임상 적용을 위한 가능성을 확인하였다.
조광현 교수는 “세포내 중요한 역할을 담당하는 분자들은 대부분 복잡한 조절관계 속에 놓여있기 때문에 기존의 직관적인 생물학 연구로 그 원리를 밝히는 것은 근본적인 한계가 있다. 이번 연구는 IT와 BT의 융합연구인 시스템생물학으로 그 한계를 극복할 수 있음을 보여주는 대표적인 사례로, 특히 암에 대한 표적 치료제 작용을 네트워크 차원에서 분석하여 내성을 극복할 수 있는 새로운 치료법을 개발할 수 있는 가능성을 제시하였다”고 말했다.
□ 사진 설명
사진1. 간암세포를 이용한 세포실험을 이용해 시뮬레이션 결과를 확인
사진2. 구축된 ER stress 네트워크를 이용한 네트워크 분석 및 컴퓨터 시뮬레이션 결과
사진3. 간암 세포가 소라페닙에 반응할 때 전사체 변화를 분석하여 ER stress 반응이 주요하게 나타남을 발견하게 된 ER stress 네트워크 모델
2017.08.24
조회수 22172
-
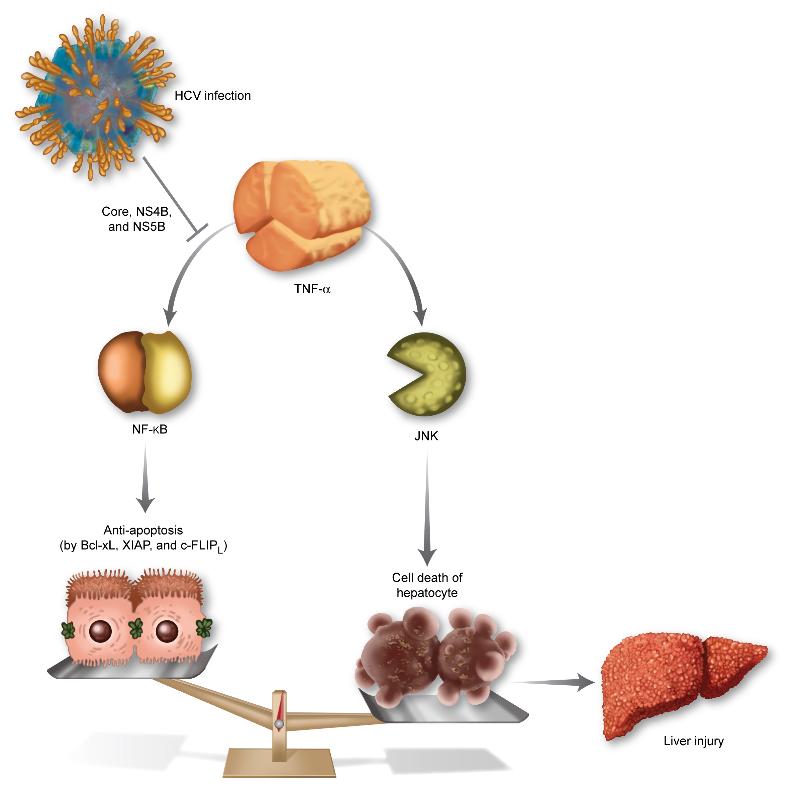 C형 간염 바이러스의 간 손상 메카니즘 규명
- 부작용 없이 간세포 손상 억제하는 치료제 개발 길 열어 -- 의학분야 세계 최고수준 학술지 ‘헤파톨로지’ 9월호 표지논문 장식 -
의사출신으로 구성된 KAIST 연구진이 C형 간염 바이러스 기전을 밝혀내 치료제 개발에 탄력을 받게 됐다.
우리 학교 바이오및뇌공학과 최철희 교수와 의과학대학원 신의철 교수팀이 공동으로 C형 간염 바이러스에 감염된 환자의 간 손상에 대한 메카니즘을 세계 최초로 규명했다.
이번 연구결과로 앞으로 부작용이 없으면서도 간세포 손상이 적은 C형 간염 바이러스 치료제가 개발될 수 있을 것으로 기대된다.
C형 간염은 C형 간염 바이러스(HCV, Hepatitis C virus)에 감염되었을 때 이에 대응하기 위한 신체의 면역반응으로 인해 간에 염증이 생기는 질환이다.
C형 간염 바이러스는 전 세계적으로 약 1억 7천만 명, 그리고 우리나라에서도 1%정도가 감염되어 있는 것으로 추정된다. 감염되면 대부분 만성으로 변하며, 간경변증이나 간암을 유발해 사망할 수 있는 무서운 질병이다.
하지만 2005년 시험관 내 세포에서 C형 간염 바이러스의 감염이 성공하기 전까지는 세포실험이 불가능했고, 침팬지 이외에는 감염시키는 동물이 없어 동물실험이 어려워 연구에 한계가 있었다.
연구팀은 C형 간염 바이러스에 감염시킨 세포주를 이용해 바이러스가 면역을 담당하는 세포에 의해 분비되는 단백질인 종양괴사인자(TNF-α)에 의한 세포의 사멸이 크게 증가하는 메카니즘을 세계 최초로 밝혀냈다.
이와 함께 이러한 작용을 일으키는 바이러스 구성 단백질도 규명에도 성공했다.
기존에는 C형 간염 바이러스가 간 손상을 일으키는 기전을 밝혀내지 못해 주로 바이러스의 증식을 억제하는 데 초점을 맞춰 신약이 개발돼 부작용이 많았다.
이번 연구결과를 통해 바이러스에 의한 간세포 손상을 억제하는 부작용 없는 신약개발이 가능하게 될 것으로 전망된다.
최철희 교수는 “이번 연구를 통해 C형 간염 바이러스가 숙주의 간세포와 어떤 상호 작용을 하는지 밝혀내 감염 환자의 치료법을 획기적으로 개선할 수 있을 것”이라고 말했다.
신의철 교수는 “이번 연구는 기초의학과 응용의학의 융합연구가 성공한 대표적 사례”라며 “앞으로도 다학제간 융합연구를 실시하면 그동안 풀지 못했던 난제들을 효율적으로 해결할 수 있을 것”이라고 강조했다.
한편, 교육과학기술부 미래기반기술개발사업(신약타겟검증연구사업)의 지원을 받아 수행된 이번 연구 결과는 의학 분야의 세계적 학술지인 헤파톨로지(Hepatolog, Impact Factor=11.665) 9월호 표지 논문으로 선정됐다.
□ 연구 세부사항 설명
TNF-α(종양괴사인자)는 면역을 담당하는 세포에 의해 분비되는 단백질이다. HCV에 감염되면 바이러스의 증식을 억제하기 위해 체내의 면역작용이 활발해지고 TNF-α의 분비도 늘어난다.
TNF-α는 세포의 생존을 담당하는 NF-κB 신호전달과 세포의 죽음을 담당하는 JNK 신호 전달을 동시에 활성화시킨다. HCV에 감염되면, 세포의 생존을 담당하는 NF-κB 쪽 신호전달 경로만 선택적으로 활성을 억제하게 되고, TNF-α의 역할은 세포의 죽음 쪽으로 균형이 기울게 된다.
바이러스의 증식을 억제하기 위해 분비된 TNF-α가 오히려 간세포를 죽이게 되는 것이다. 이는 곧 간 손상을 뜻하며, HCV를 구성하는 10가지의 단백질 중 core, NF4B, NS5B 라는 단백질이 이러한 작용을 한다고 규명해냈다.
C형 간염 바이러스의 간 손상 메카니즘 규명
- 부작용 없이 간세포 손상 억제하는 치료제 개발 길 열어 -- 의학분야 세계 최고수준 학술지 ‘헤파톨로지’ 9월호 표지논문 장식 -
의사출신으로 구성된 KAIST 연구진이 C형 간염 바이러스 기전을 밝혀내 치료제 개발에 탄력을 받게 됐다.
우리 학교 바이오및뇌공학과 최철희 교수와 의과학대학원 신의철 교수팀이 공동으로 C형 간염 바이러스에 감염된 환자의 간 손상에 대한 메카니즘을 세계 최초로 규명했다.
이번 연구결과로 앞으로 부작용이 없으면서도 간세포 손상이 적은 C형 간염 바이러스 치료제가 개발될 수 있을 것으로 기대된다.
C형 간염은 C형 간염 바이러스(HCV, Hepatitis C virus)에 감염되었을 때 이에 대응하기 위한 신체의 면역반응으로 인해 간에 염증이 생기는 질환이다.
C형 간염 바이러스는 전 세계적으로 약 1억 7천만 명, 그리고 우리나라에서도 1%정도가 감염되어 있는 것으로 추정된다. 감염되면 대부분 만성으로 변하며, 간경변증이나 간암을 유발해 사망할 수 있는 무서운 질병이다.
하지만 2005년 시험관 내 세포에서 C형 간염 바이러스의 감염이 성공하기 전까지는 세포실험이 불가능했고, 침팬지 이외에는 감염시키는 동물이 없어 동물실험이 어려워 연구에 한계가 있었다.
연구팀은 C형 간염 바이러스에 감염시킨 세포주를 이용해 바이러스가 면역을 담당하는 세포에 의해 분비되는 단백질인 종양괴사인자(TNF-α)에 의한 세포의 사멸이 크게 증가하는 메카니즘을 세계 최초로 밝혀냈다.
이와 함께 이러한 작용을 일으키는 바이러스 구성 단백질도 규명에도 성공했다.
기존에는 C형 간염 바이러스가 간 손상을 일으키는 기전을 밝혀내지 못해 주로 바이러스의 증식을 억제하는 데 초점을 맞춰 신약이 개발돼 부작용이 많았다.
이번 연구결과를 통해 바이러스에 의한 간세포 손상을 억제하는 부작용 없는 신약개발이 가능하게 될 것으로 전망된다.
최철희 교수는 “이번 연구를 통해 C형 간염 바이러스가 숙주의 간세포와 어떤 상호 작용을 하는지 밝혀내 감염 환자의 치료법을 획기적으로 개선할 수 있을 것”이라고 말했다.
신의철 교수는 “이번 연구는 기초의학과 응용의학의 융합연구가 성공한 대표적 사례”라며 “앞으로도 다학제간 융합연구를 실시하면 그동안 풀지 못했던 난제들을 효율적으로 해결할 수 있을 것”이라고 강조했다.
한편, 교육과학기술부 미래기반기술개발사업(신약타겟검증연구사업)의 지원을 받아 수행된 이번 연구 결과는 의학 분야의 세계적 학술지인 헤파톨로지(Hepatolog, Impact Factor=11.665) 9월호 표지 논문으로 선정됐다.
□ 연구 세부사항 설명
TNF-α(종양괴사인자)는 면역을 담당하는 세포에 의해 분비되는 단백질이다. HCV에 감염되면 바이러스의 증식을 억제하기 위해 체내의 면역작용이 활발해지고 TNF-α의 분비도 늘어난다.
TNF-α는 세포의 생존을 담당하는 NF-κB 신호전달과 세포의 죽음을 담당하는 JNK 신호 전달을 동시에 활성화시킨다. HCV에 감염되면, 세포의 생존을 담당하는 NF-κB 쪽 신호전달 경로만 선택적으로 활성을 억제하게 되고, TNF-α의 역할은 세포의 죽음 쪽으로 균형이 기울게 된다.
바이러스의 증식을 억제하기 위해 분비된 TNF-α가 오히려 간세포를 죽이게 되는 것이다. 이는 곧 간 손상을 뜻하며, HCV를 구성하는 10가지의 단백질 중 core, NF4B, NS5B 라는 단백질이 이러한 작용을 한다고 규명해냈다.
2012.09.04
조회수 18645
 간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
2024.08.08 조회수 5412
간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
2024.08.08 조회수 5412 장 조직의 항상성과 염증성 장염 회복의 핵심 효소 발견
우리 대학 생명과학과 김세윤, 양한슬 교수 공동연구팀이 `장 상피조직의 발생과 염증성 장염 회복과정의 핵심 효소발굴'에 성공했다고 6일 밝혔다.
생명과학과 박승은 박사, 이동은 박사과정 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지인 `세포 및 분자 소화기학 및 간장학 (Cellular and Molecular Gastroenterology & Hepatology)'에 지난 8월 19일 字 온라인 게재됐다.
※ 논문명 : Gut Epithelial Inositol Polyphosphate Multikinase Alleviates Experimental Colitis via Governing Tuft Cell Homeostasis
※ 저자 정보 : 박승은 (한국과학기술원, 공동 제1 저자), 이동은 (한국과학기술원, 공동 제1 저자), 정재웅 (연세대학교 의과대학, 제2 저자), 이수형 (반더빌트 의과대학, 공동 저자), 박승주 (한국과학기술원, 공동 저자), 류재승 (한국과학기술원, 공동 저자), 오세규 (카이노젠, 공동 저자), 양한슬 (한국과학기술원, 공동 교신저자), 황성순 (연세대학교 의과대학, 공동 교신저자), 김세윤 (한국과학기술원, 공동 교신저자), 포함 총 10명
염증성 장 질환은 1980년대 중반까지만 해도 국내 발병률은 매우 낮은 질환이었으나 건강보험심사평가원 자료에 따르면 2011년 말 만성 염증성 장 질환인 크론병 환자가 1만3천여 명, 궤양성 대장염 환자가 2만9천여 명으로 집계됐으며 이후로도 환자 수가 빠르게 증가하고 있다.
궤양성 대장염과 크론병과 같은 염증성 장 질환(Inflammatory bowel disease)은 복통, 설사뿐 아니라 전신 무력감, 체중 감소, 장 천공 등의 합병증을 유발해 환자의 삶의 질을 크게 낮추는 심각한 질환이다.
이러한 염증성 장 질환은 아직 발병 메커니즘이 명확하게 규명되지 않았으며 서구화된 식습관과 함께 유전적 이상이나 면역학적 장애 또는 스트레스와 같은 환경적인 요인이 복합적으로 관여하는 것으로 여겨진다.
최근 염증성 장 질환의 환자군 일부에서 이노시톨 대사(체내 합성 또는 음식을 통하여 공급되는 이노시톨 영양소를 이노시톨 인산 물질들로 전환하는 세포 내 생화학적 반응)의 핵심 효소인 이노시톨 폴리인산 카이네이즈(Inositol polyphosphate multikinase, 이하 IPMK) 유전자에서 단일염기변이(single nucleotide polymorphism, SNP) 등이 보고됐다. IPMK 효소는 포유류의 이노시톨 대사에서 매우 중추적인 역할을 하는 단백질로서 세포의 성장과 대사뿐 아니라 면역 반응 및 중추 신경계 기억 조절 등의 다각적인 생물학적 기능을 수행하는 것으로 알려졌으나 소화기계에서의 생물학적 기능은 밝혀진 바가 전혀 없다.
이에 우리 대학 생명과학과 및 줄기세포 연구센터 김세윤 교수, 양한슬 교수 연구팀은 연세대학교 의과대학 황성순 교수 연구팀과의 공동연구를 통해 장 상피세포에서의 IPMK 효소의 역할규명연구를 다각적으로 수행했다.
연구팀은 먼저 장 상피세포에서 IPMK 유전자가 결손된 생쥐 연구모델을 제작했고 이를 분석한 결과에 따르면 정상적인 환경에서는 뚜렷한 장 조직의 구조와 기능에 있어 문제가 발생하지 않았다. 그러나 덱스트란 황산나트륨(DSS)을 투여해 대장염을 유발할 경우, IPMK 유전자가 결손된 생쥐로부터 대장염 회복반응이 현저하게 둔화됨을 관찰했고 이로부터 IPMK 효소가 손상된 대장 조직이 회복되는데 필수적인 인자임을 규명했다.
특히 연구팀은 IPMK 효소가 제거된 장 조직에서는 솔세포(tuft cell)의 발생과 기능에 심각한 장애가 발생함을 관찰했다. 솔세포란 소장과 대장뿐 아니라 흉선, 췌장 등에 존재하는 세포로서 표면에 미세 융모구조를 보이는 독특한 세포다. 장 조직의 전체 세포 중 불과 2~3% 이하로 존재하는 솔세포는 외부로부터의 기생충 감염에 대응하는 면역기능을 수행한다. 또한 솔세포로부터 합성돼 분비되는 아세틸콜린 신경전달물질은 장내 줄기세포 및 신경세포를 자극해 장 조직의 항상성 유지와 손상 복구에 중요한 기능을 담당하는 것으로 알려져 있다. 이러한 중요성에도 불구하고 솔세포의 발생과 기능을 조절하는 분자 타깃에 대한 이해는 극히 부족한 것으로 알려져 있다.
공동연구팀은 첨단 단일세포 RNA 유전자 배열 순서 분석기술(single cell RNA sequencing)을 통해 IPMK 효소가 제거된 장 상피조직에서 아세틸콜린 분비를 담당하는 솔세포군의 발생이 특이적으로 감소함을 규명했다. 또한 이러한 분석과정에서 생쥐의 대장에 존재하는 솔세포는 크게 면역기능을 담당하는 세포군, 아세틸콜린 분비 솔세포군 외에 유전자 발현 능력이 감소한 새로운 솔세포군이 있다는 사실을 발견해 학계에 최초 보고했다.
연구팀 관계자는 "발굴한 IPMK 효소에 기반한 아세틸콜린 분비성 솔세포의 발생 및 기능조절은 향후 장 상피조직의 항상성 유지의 학문적 이해와 더불어 염증성 장 질환의 진단 및 치료기술 개발 등에 적극적으로 활용될 것ˮ이라며 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 서경배과학재단, KAIST 줄기세포 연구센터 지원사업, KAIST 그랜드챌린지 30 (KC30) 사업 및 포스코청암펠로십의 지원을 받아 수행됐다.
2022.10.06 조회수 10549
장 조직의 항상성과 염증성 장염 회복의 핵심 효소 발견
우리 대학 생명과학과 김세윤, 양한슬 교수 공동연구팀이 `장 상피조직의 발생과 염증성 장염 회복과정의 핵심 효소발굴'에 성공했다고 6일 밝혔다.
생명과학과 박승은 박사, 이동은 박사과정 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지인 `세포 및 분자 소화기학 및 간장학 (Cellular and Molecular Gastroenterology & Hepatology)'에 지난 8월 19일 字 온라인 게재됐다.
※ 논문명 : Gut Epithelial Inositol Polyphosphate Multikinase Alleviates Experimental Colitis via Governing Tuft Cell Homeostasis
※ 저자 정보 : 박승은 (한국과학기술원, 공동 제1 저자), 이동은 (한국과학기술원, 공동 제1 저자), 정재웅 (연세대학교 의과대학, 제2 저자), 이수형 (반더빌트 의과대학, 공동 저자), 박승주 (한국과학기술원, 공동 저자), 류재승 (한국과학기술원, 공동 저자), 오세규 (카이노젠, 공동 저자), 양한슬 (한국과학기술원, 공동 교신저자), 황성순 (연세대학교 의과대학, 공동 교신저자), 김세윤 (한국과학기술원, 공동 교신저자), 포함 총 10명
염증성 장 질환은 1980년대 중반까지만 해도 국내 발병률은 매우 낮은 질환이었으나 건강보험심사평가원 자료에 따르면 2011년 말 만성 염증성 장 질환인 크론병 환자가 1만3천여 명, 궤양성 대장염 환자가 2만9천여 명으로 집계됐으며 이후로도 환자 수가 빠르게 증가하고 있다.
궤양성 대장염과 크론병과 같은 염증성 장 질환(Inflammatory bowel disease)은 복통, 설사뿐 아니라 전신 무력감, 체중 감소, 장 천공 등의 합병증을 유발해 환자의 삶의 질을 크게 낮추는 심각한 질환이다.
이러한 염증성 장 질환은 아직 발병 메커니즘이 명확하게 규명되지 않았으며 서구화된 식습관과 함께 유전적 이상이나 면역학적 장애 또는 스트레스와 같은 환경적인 요인이 복합적으로 관여하는 것으로 여겨진다.
최근 염증성 장 질환의 환자군 일부에서 이노시톨 대사(체내 합성 또는 음식을 통하여 공급되는 이노시톨 영양소를 이노시톨 인산 물질들로 전환하는 세포 내 생화학적 반응)의 핵심 효소인 이노시톨 폴리인산 카이네이즈(Inositol polyphosphate multikinase, 이하 IPMK) 유전자에서 단일염기변이(single nucleotide polymorphism, SNP) 등이 보고됐다. IPMK 효소는 포유류의 이노시톨 대사에서 매우 중추적인 역할을 하는 단백질로서 세포의 성장과 대사뿐 아니라 면역 반응 및 중추 신경계 기억 조절 등의 다각적인 생물학적 기능을 수행하는 것으로 알려졌으나 소화기계에서의 생물학적 기능은 밝혀진 바가 전혀 없다.
이에 우리 대학 생명과학과 및 줄기세포 연구센터 김세윤 교수, 양한슬 교수 연구팀은 연세대학교 의과대학 황성순 교수 연구팀과의 공동연구를 통해 장 상피세포에서의 IPMK 효소의 역할규명연구를 다각적으로 수행했다.
연구팀은 먼저 장 상피세포에서 IPMK 유전자가 결손된 생쥐 연구모델을 제작했고 이를 분석한 결과에 따르면 정상적인 환경에서는 뚜렷한 장 조직의 구조와 기능에 있어 문제가 발생하지 않았다. 그러나 덱스트란 황산나트륨(DSS)을 투여해 대장염을 유발할 경우, IPMK 유전자가 결손된 생쥐로부터 대장염 회복반응이 현저하게 둔화됨을 관찰했고 이로부터 IPMK 효소가 손상된 대장 조직이 회복되는데 필수적인 인자임을 규명했다.
특히 연구팀은 IPMK 효소가 제거된 장 조직에서는 솔세포(tuft cell)의 발생과 기능에 심각한 장애가 발생함을 관찰했다. 솔세포란 소장과 대장뿐 아니라 흉선, 췌장 등에 존재하는 세포로서 표면에 미세 융모구조를 보이는 독특한 세포다. 장 조직의 전체 세포 중 불과 2~3% 이하로 존재하는 솔세포는 외부로부터의 기생충 감염에 대응하는 면역기능을 수행한다. 또한 솔세포로부터 합성돼 분비되는 아세틸콜린 신경전달물질은 장내 줄기세포 및 신경세포를 자극해 장 조직의 항상성 유지와 손상 복구에 중요한 기능을 담당하는 것으로 알려져 있다. 이러한 중요성에도 불구하고 솔세포의 발생과 기능을 조절하는 분자 타깃에 대한 이해는 극히 부족한 것으로 알려져 있다.
공동연구팀은 첨단 단일세포 RNA 유전자 배열 순서 분석기술(single cell RNA sequencing)을 통해 IPMK 효소가 제거된 장 상피조직에서 아세틸콜린 분비를 담당하는 솔세포군의 발생이 특이적으로 감소함을 규명했다. 또한 이러한 분석과정에서 생쥐의 대장에 존재하는 솔세포는 크게 면역기능을 담당하는 세포군, 아세틸콜린 분비 솔세포군 외에 유전자 발현 능력이 감소한 새로운 솔세포군이 있다는 사실을 발견해 학계에 최초 보고했다.
연구팀 관계자는 "발굴한 IPMK 효소에 기반한 아세틸콜린 분비성 솔세포의 발생 및 기능조절은 향후 장 상피조직의 항상성 유지의 학문적 이해와 더불어 염증성 장 질환의 진단 및 치료기술 개발 등에 적극적으로 활용될 것ˮ이라며 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 서경배과학재단, KAIST 줄기세포 연구센터 지원사업, KAIST 그랜드챌린지 30 (KC30) 사업 및 포스코청암펠로십의 지원을 받아 수행됐다.
2022.10.06 조회수 10549 기존 개념을 깬 새로운 면역 T 세포 발견
우리 대학 의과학대학원 신의철 교수 연구팀이 우리 대학 의과학대학원 박수형 교수, 연세대학교 의과대학 주동진, 박준용 교수팀과 공동 연구를 통해 선천면역과 적응면역의 특성을 모두 지니는 새로운 유형의 `NK 유사 T 세포'를 간에서 발견하고 그 작용 특성을 규명했다고 8일 밝혔다.
이번 연구는, 그동안 면역학의 영역에서 이분법적으로 나눠져 있던 선천면역과 적응면역의 경계에서 작동하는 새로운 면역세포를 발견하고 그 특성을 밝힘으로써 인체의 면역 반응을 새로운 시각에서 바라볼 수 있게 했다는 점에서 큰 의의가 있다.
의과학대학원 고준영 박사, 나민석 박사, 최승진 박사가 공동 제1 저자로 참여한 이번 연구 결과는 간장(肝腸)학 분야의 최고 국제 학술지 `간장학 저널(Journal of Hepatology)' 5월 26일 字 온라인판에 게재됐다 (논문명: Identification of a distinct NK-like hepatic T-cell population activated by NKG2C in a TCR-independent manner).
인체에 세균이나 바이러스 같은 병원성 미생물이 침입하면 먼저 선천면역이 작동한다. 선천면역은 신속하게 작동하는 장점이 있지만, 병원성 미생물의 종류를 구분하지 못하고 기억면역을 형성하지 못하는 단점이 있다. 한편 감염 후 4~5일 후부터는 적응면역이 서서히 작동한다. 적응면역은 느리게 활성화되는 대신 각각의 병원성 미생물을 구분하는 능력이 있고 회복 후에는 기억 면역 세포를 만들어 같은 미생물이 재침입하였을 때 재빠른 반응을 할 수 있다.
특히 바이러스 감염 시에는 바이러스에 감염된 세포를 제거하는 기능에 특화된 면역세포들이 중요한 역할을 하는데, 이들 중 NK 세포(자연살해 세포)는 선천면역, T 세포는 적응면역의 특성이 있는 대표적인 면역 세포다. 이 2가지 면역 세포는 바이러스에 감염된 세포를 인식하는 방식도 달라, T 세포는 바이러스 단백질 조각을 항원으로 감지하는 반면, NK 세포는 스트레스 분자 발현이 증가한 것을 통해 바이러스 감염 세포를 감지한다.
지금까지 면역학계에서는 이렇게 NK 세포와 T 세포를 명확히 구분되는 면역 세포로서 나누어 연구를 진행해 왔는데, 연구팀은 이번 연구를 통해 NK 세포와 T 세포의 특성을 모두 지니는 `NK 유사 T 세포'를 새롭게 발견한 것이다. 그리고 이러한 NK 유사 T 세포는 T 세포 수용체를 통해 바이러스 단백질 항원을 인식하는 대신에 NK 세포 수용체인 `NKG2C'를 통해 비정상 세포들을 감지하고 제거할 수 있다는 사실을 발견했다.
연구팀은 이번 연구에서 간에 존재하는 면역세포를 주로 분석했는데, 간은 면역학적으로 특이한 장기로 여겨지고 있다. 소장이나 대장으로부터 들어오는 혈액은 전신 순환계에 합류하기 전에 간을 먼저 지나게 된다. 이 과정에서 장으로부터 들어온 많은 외부 물질이나 병원성 미생물들은 간에서 걸러지게 되어, 간은 면역학적 1차 관문의 역할을 하게 된다. 한편 간은 면역학적 관용을 나타내는 장기로도 잘 알려져, 병원성 미생물에 대한 과도한 면역 반응을 조절하기도 한다. 연구팀은 이처럼 복잡하고 정교하게 조절되는 간의 면역학적 특성을 상세히 분석하기 위해 단일세포 전사체 분석이라는 최신 연구기법을 적용해 분석한 결과, 간 내에서 선천면역과 적응면역의 특성을 모두 지니는 NK 유사 T 세포를 발견했다. 그리고 B형간염 바이러스에 의한 만성 간 질환을 앓는 환자의 간에서는 이러한 NK 유사 T 세포의 수가 증가해 있는 것도 발견했다.
연구팀이 이번에 새롭게 발견한 NK 유사 T 세포가 바이러스 감염 등의 각종 질환에서 어떤 역할을 하는지는 아직 분명하지 않다. 현재 연구팀은 NK 유사 T 세포가 체내에서 감염뿐만 아니라 각종 원인에 의해 비정상적으로 변한 세포들을 선택적으로 제거해 체내 항상성을 유지하는 데 중요한 역할을 한다는 가설을 가지고 후속 연구를 활발히 진행하고 있다. 한편, 미국 스탠퍼드 의대의 마크 데이비스 교수 연구팀이 최근 NK 수용체를 발현하는 T 세포는 다른 면역세포의 기능을 억제한다는 논문을 사이언스지에 발표함에 따라, 연구팀은 이번에 발견한 NK 유사 T 세포가 체내 상황에 따라 면역억제 기능을 수행하는지에 대한 분석도 진행하고 있다.
이번 연구 결과는 연세의대 세브란스병원 외과 및 내과 연구팀과 KAIST 의과학대학원이 간의 면역학적 특성을 규명하기 위해 수행한 협동 연구의 성과로서, 중개 연구(translational research)를 통해 인간 면역학을 새롭게 이해하는 계기를 마련했다는 평가를 받는다.
의과학대학원 신의철 교수는 "최신 연구 방법인 단일세포 전사체 분석 기술을 이용해 복잡한 간장 내 면역세포들을 상세히 분석할 수 있었고, 그 결과로 새로운 유형의 면역 세포인 NK 유사 T 세포를 발견하게 된 중요한 연구ˮ라며 "앞으로 NK 유사 T 세포의 생리 및 병리적 기능을 밝히는 연구를 지속하겠다ˮ라고 말했다.
2022.06.08 조회수 10505
기존 개념을 깬 새로운 면역 T 세포 발견
우리 대학 의과학대학원 신의철 교수 연구팀이 우리 대학 의과학대학원 박수형 교수, 연세대학교 의과대학 주동진, 박준용 교수팀과 공동 연구를 통해 선천면역과 적응면역의 특성을 모두 지니는 새로운 유형의 `NK 유사 T 세포'를 간에서 발견하고 그 작용 특성을 규명했다고 8일 밝혔다.
이번 연구는, 그동안 면역학의 영역에서 이분법적으로 나눠져 있던 선천면역과 적응면역의 경계에서 작동하는 새로운 면역세포를 발견하고 그 특성을 밝힘으로써 인체의 면역 반응을 새로운 시각에서 바라볼 수 있게 했다는 점에서 큰 의의가 있다.
의과학대학원 고준영 박사, 나민석 박사, 최승진 박사가 공동 제1 저자로 참여한 이번 연구 결과는 간장(肝腸)학 분야의 최고 국제 학술지 `간장학 저널(Journal of Hepatology)' 5월 26일 字 온라인판에 게재됐다 (논문명: Identification of a distinct NK-like hepatic T-cell population activated by NKG2C in a TCR-independent manner).
인체에 세균이나 바이러스 같은 병원성 미생물이 침입하면 먼저 선천면역이 작동한다. 선천면역은 신속하게 작동하는 장점이 있지만, 병원성 미생물의 종류를 구분하지 못하고 기억면역을 형성하지 못하는 단점이 있다. 한편 감염 후 4~5일 후부터는 적응면역이 서서히 작동한다. 적응면역은 느리게 활성화되는 대신 각각의 병원성 미생물을 구분하는 능력이 있고 회복 후에는 기억 면역 세포를 만들어 같은 미생물이 재침입하였을 때 재빠른 반응을 할 수 있다.
특히 바이러스 감염 시에는 바이러스에 감염된 세포를 제거하는 기능에 특화된 면역세포들이 중요한 역할을 하는데, 이들 중 NK 세포(자연살해 세포)는 선천면역, T 세포는 적응면역의 특성이 있는 대표적인 면역 세포다. 이 2가지 면역 세포는 바이러스에 감염된 세포를 인식하는 방식도 달라, T 세포는 바이러스 단백질 조각을 항원으로 감지하는 반면, NK 세포는 스트레스 분자 발현이 증가한 것을 통해 바이러스 감염 세포를 감지한다.
지금까지 면역학계에서는 이렇게 NK 세포와 T 세포를 명확히 구분되는 면역 세포로서 나누어 연구를 진행해 왔는데, 연구팀은 이번 연구를 통해 NK 세포와 T 세포의 특성을 모두 지니는 `NK 유사 T 세포'를 새롭게 발견한 것이다. 그리고 이러한 NK 유사 T 세포는 T 세포 수용체를 통해 바이러스 단백질 항원을 인식하는 대신에 NK 세포 수용체인 `NKG2C'를 통해 비정상 세포들을 감지하고 제거할 수 있다는 사실을 발견했다.
연구팀은 이번 연구에서 간에 존재하는 면역세포를 주로 분석했는데, 간은 면역학적으로 특이한 장기로 여겨지고 있다. 소장이나 대장으로부터 들어오는 혈액은 전신 순환계에 합류하기 전에 간을 먼저 지나게 된다. 이 과정에서 장으로부터 들어온 많은 외부 물질이나 병원성 미생물들은 간에서 걸러지게 되어, 간은 면역학적 1차 관문의 역할을 하게 된다. 한편 간은 면역학적 관용을 나타내는 장기로도 잘 알려져, 병원성 미생물에 대한 과도한 면역 반응을 조절하기도 한다. 연구팀은 이처럼 복잡하고 정교하게 조절되는 간의 면역학적 특성을 상세히 분석하기 위해 단일세포 전사체 분석이라는 최신 연구기법을 적용해 분석한 결과, 간 내에서 선천면역과 적응면역의 특성을 모두 지니는 NK 유사 T 세포를 발견했다. 그리고 B형간염 바이러스에 의한 만성 간 질환을 앓는 환자의 간에서는 이러한 NK 유사 T 세포의 수가 증가해 있는 것도 발견했다.
연구팀이 이번에 새롭게 발견한 NK 유사 T 세포가 바이러스 감염 등의 각종 질환에서 어떤 역할을 하는지는 아직 분명하지 않다. 현재 연구팀은 NK 유사 T 세포가 체내에서 감염뿐만 아니라 각종 원인에 의해 비정상적으로 변한 세포들을 선택적으로 제거해 체내 항상성을 유지하는 데 중요한 역할을 한다는 가설을 가지고 후속 연구를 활발히 진행하고 있다. 한편, 미국 스탠퍼드 의대의 마크 데이비스 교수 연구팀이 최근 NK 수용체를 발현하는 T 세포는 다른 면역세포의 기능을 억제한다는 논문을 사이언스지에 발표함에 따라, 연구팀은 이번에 발견한 NK 유사 T 세포가 체내 상황에 따라 면역억제 기능을 수행하는지에 대한 분석도 진행하고 있다.
이번 연구 결과는 연세의대 세브란스병원 외과 및 내과 연구팀과 KAIST 의과학대학원이 간의 면역학적 특성을 규명하기 위해 수행한 협동 연구의 성과로서, 중개 연구(translational research)를 통해 인간 면역학을 새롭게 이해하는 계기를 마련했다는 평가를 받는다.
의과학대학원 신의철 교수는 "최신 연구 방법인 단일세포 전사체 분석 기술을 이용해 복잡한 간장 내 면역세포들을 상세히 분석할 수 있었고, 그 결과로 새로운 유형의 면역 세포인 NK 유사 T 세포를 발견하게 된 중요한 연구ˮ라며 "앞으로 NK 유사 T 세포의 생리 및 병리적 기능을 밝히는 연구를 지속하겠다ˮ라고 말했다.
2022.06.08 조회수 10505 진원생명과학(주)과의 공동 연구로 C형간염 DNA백신 면역증강 효과 확인
의과학대학원 신의철 교수 연구팀이 기존 치료법이 모두 실패한 만성 C형간염 환자를 대상으로 DNA백신(GLS-6150)을 접종해 심각한 부작용 없이 매우 안전하면서도 C형간염 바이러스에 대한 T세포 면역반응을 높인다는 사실을 임상연구를 통해 밝혔다.
세브란스병원 소화기내과 안상훈 교수, 부산대학교병원 소화기내과 허정 교수, 진원생명과학과 공동으로 진행한 이번 연구에서는 특히 IFNL3라는 사이토카인 면역증강물질 유전자를 백신에 포함했다. 이를 통해 면역반응을 억제하는 조절 T세포(Treg)를 감소시키면서 C형간염 바이러스 면역반응의 핵심 역할을 하는 세포독성 T세포의 기능을 강화할 수 있음을 밝혀냈다.
신의철 교수, 세브란스병원 안상훈 교수, 부산대학교병원 허정 교수가 공동 교신저자로 참여한 이번 연구결과는 간 연구 분야의 국제적 전문 학술지인 ‘저널 오브 헤파톨로지(Journal of Hepatology)’ 2월 20일 자 온라인판에 게재됐다.(논문명: IFNL3-adjuvanted HCV DNA vaccine reduces regulatory T-cell frequency and increases virus-specific T-cell response)
이번 연구를 통해 만성 C형간염 환자, 특히 항바이러스제를 이용하여 치료받은 완치자의 HCV 재감염을 예방하고 만성 C형간염 고위험군의 HCV 감염을 예방하는 백신의 개발 가능성을 확인했다.
이번 임상연구는 지난 2013년 10월 식약처의 임상승인을 받아 세브란스병원과 부산대학교병원에서 기존치료법에 모두 실패한 만성 C형간염 환자 18명을 대상으로 DNA 백신(GLS-6150)의 안전성, 내약성 및 면역원성을 평가하기 위한 다기관·공개·용량 증량·1상 임상시험으로 수행됐다. 이 중 14명을 대상으로 2014년 9월 식약처로부터 추가 임상승인을 받아 2016년에 1상 임상연구를 모두 완료했다. (Clinicaltrials.gov 번호: NCT02027116)
해당 연구팀은 항바이러스제로 치료된 만성 C형간염 완치자를 대상으로 DNA 백신(GLS-6150)의 안전성과 내약성 및 면역원성을 평가하는 임상연구의 승인을 2018년 2월 식약처로부터 받아 현재 세브란스병원과 부산대학교병원에서 세 번째 1상 임상연구를 수행하고 있다. (Clinicaltrials.gov 번호: NCT03674125)
신의철 교수는“이번 연구를 통해 지난 30여 년 동안 실패했던 C형간염 예방백신 개발의 새로운 가능성을 발견했다”라며 “예방백신을 성공적으로 개발하면 가까운 미래에 C형간염 바이러스를 지구상에서 사라지게 할 수도 있을 것이다”라고 말했다.
이번 연구는 진원생명과학(주)의 지원을 받아 C형간염 DNA백신(GLS-6150)을 사용했다.
2020.03.25 조회수 17447
진원생명과학(주)과의 공동 연구로 C형간염 DNA백신 면역증강 효과 확인
의과학대학원 신의철 교수 연구팀이 기존 치료법이 모두 실패한 만성 C형간염 환자를 대상으로 DNA백신(GLS-6150)을 접종해 심각한 부작용 없이 매우 안전하면서도 C형간염 바이러스에 대한 T세포 면역반응을 높인다는 사실을 임상연구를 통해 밝혔다.
세브란스병원 소화기내과 안상훈 교수, 부산대학교병원 소화기내과 허정 교수, 진원생명과학과 공동으로 진행한 이번 연구에서는 특히 IFNL3라는 사이토카인 면역증강물질 유전자를 백신에 포함했다. 이를 통해 면역반응을 억제하는 조절 T세포(Treg)를 감소시키면서 C형간염 바이러스 면역반응의 핵심 역할을 하는 세포독성 T세포의 기능을 강화할 수 있음을 밝혀냈다.
신의철 교수, 세브란스병원 안상훈 교수, 부산대학교병원 허정 교수가 공동 교신저자로 참여한 이번 연구결과는 간 연구 분야의 국제적 전문 학술지인 ‘저널 오브 헤파톨로지(Journal of Hepatology)’ 2월 20일 자 온라인판에 게재됐다.(논문명: IFNL3-adjuvanted HCV DNA vaccine reduces regulatory T-cell frequency and increases virus-specific T-cell response)
이번 연구를 통해 만성 C형간염 환자, 특히 항바이러스제를 이용하여 치료받은 완치자의 HCV 재감염을 예방하고 만성 C형간염 고위험군의 HCV 감염을 예방하는 백신의 개발 가능성을 확인했다.
이번 임상연구는 지난 2013년 10월 식약처의 임상승인을 받아 세브란스병원과 부산대학교병원에서 기존치료법에 모두 실패한 만성 C형간염 환자 18명을 대상으로 DNA 백신(GLS-6150)의 안전성, 내약성 및 면역원성을 평가하기 위한 다기관·공개·용량 증량·1상 임상시험으로 수행됐다. 이 중 14명을 대상으로 2014년 9월 식약처로부터 추가 임상승인을 받아 2016년에 1상 임상연구를 모두 완료했다. (Clinicaltrials.gov 번호: NCT02027116)
해당 연구팀은 항바이러스제로 치료된 만성 C형간염 완치자를 대상으로 DNA 백신(GLS-6150)의 안전성과 내약성 및 면역원성을 평가하는 임상연구의 승인을 2018년 2월 식약처로부터 받아 현재 세브란스병원과 부산대학교병원에서 세 번째 1상 임상연구를 수행하고 있다. (Clinicaltrials.gov 번호: NCT03674125)
신의철 교수는“이번 연구를 통해 지난 30여 년 동안 실패했던 C형간염 예방백신 개발의 새로운 가능성을 발견했다”라며 “예방백신을 성공적으로 개발하면 가까운 미래에 C형간염 바이러스를 지구상에서 사라지게 할 수도 있을 것이다”라고 말했다.
이번 연구는 진원생명과학(주)의 지원을 받아 C형간염 DNA백신(GLS-6150)을 사용했다.
2020.03.25 조회수 17447 조광현 교수, 간암 표적 치료제 내성 극복 위한 최적 약물조합 발견
〈 조 광 현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 간암 약물 치료의 효과를 높이는 새로운 방법을 찾아냈다. 특히 이번 연구는 바이오분야의 4차 산업혁명을 견인하고 있는 IT와 BT의 융합연구인 시스템생물학(Systems Biology) 연구로 이뤄졌다.
서울대병원 내과 윤정환 교수팀과 공동연구를 통해 이루어낸 이번 연구 결과는 국제 간 전문지인 헤파톨로지(Hepatology)에 게재됐다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업과 중견연구자지원사업의 지원을 받아 수행됐다.
간암은 전 세계적으로 남성에게는 다섯 번째, 여성에게는 일곱 번째로 발생률이 높은 암이며 암 사망원인의 두 번째를 차지한다. 특히 우리나라의 간암 사망률은 인구 10만 명 당 28.4명으로 경제협력개발기구(OECD) 국가 중 압도적인 1위이며 2위인 일본의 2배에 이르고 있다.
우리나라에서만 간암 환자가 매년 평균 1만 6000명이 새로 발생하고 있지만 5년 생존율이 12%에 미치지 못한다. 국가암정보센터에 따르면 지난해 암으로 사망한 사람 가운데 폐암이 1만 7399명으로 가장 많았고 간암은 1만 1311명으로 그 뒤를 이었다.
간암은 우리나라의 암 가운데 사회적 비용이 1위인 암이다. 그 이유는 다른 암에 비해 사망자가 많고 더 젊은 나이(40, 50대)에 사망하기 때문이다. 이에 부작용이 적고 생존율을 높여줄 수 있는 새로운 치료법 개발이 시급한 실정이다.
간암의 치료로는 수술 및 색전술, 약물 치료가 있지만 수술이 어려운 진행성 간암에서는 치료 방법이 극히 제한적이다.
진행성 간암의 표적 항암제로 소라페닙(Sorafenib)이 유일하게 승인돼 임상에서 쓰이고 있는데 국내에서만 매년 200억 원 이상 처방되고 있지만 일부 환자에서만 효능을 나타내며 또한 대부분의 경우 약제 내성이 발생한다.
소라페닙은 말기 간암 환자의 생존 기간을 약 3개월 정도 밖에 늘리지 못하지만 다국적 제약회사에 의해 개발된 많은 후발주자 약물들이 그 효과를 뛰어 넘는데 실패했다.
소라페닙은 다중타겟을 치료표적으로 하여 그 작용 기전이 모호하고 따라서 약제의 내성기전 또한 아직 잘 알려져 있지 않다.
조광현 교수가 이끈 융합 연구팀은 소라페닙 작용 및 내성 기전을 규명하기 위해 소라페닙을 간암 세포에 처리하였을 때 세포내 분자 발현이 변화하는 것을 분석했다.
이를 통해 암세포가 소라페닙에 대항하는 기전을 알아냈고 시스템생물학적 분석을 실시하여 암세포내 단백질 이황화 이성질화 효소(protein disulfide isomerase, PDI)가 암세포가 소라페닙에 대항하는데 핵심적 역할을 하는 것을 발견했으며 이 효소를 차단했을 때 소라페닙의 효능이 훨씬 증가함을 관찰했다.
공동연구를 수행한 서울대병원 내과 윤정환 교수 연구팀은 쥐를 이용한 동물실험에서 소라페닙과 단백질 이황화 이성질화 효소 차단제를 같이 처리하면 간암 증식 억제에 시너지가 있음을 관찰하였고 소라페닙에 저항성을 가진 간암 환자의 조직에서 이 효소가 증가되어 있음을 관찰하여, 향후 임상 적용을 위한 가능성을 확인하였다.
조광현 교수는 “세포내 중요한 역할을 담당하는 분자들은 대부분 복잡한 조절관계 속에 놓여있기 때문에 기존의 직관적인 생물학 연구로 그 원리를 밝히는 것은 근본적인 한계가 있다. 이번 연구는 IT와 BT의 융합연구인 시스템생물학으로 그 한계를 극복할 수 있음을 보여주는 대표적인 사례로, 특히 암에 대한 표적 치료제 작용을 네트워크 차원에서 분석하여 내성을 극복할 수 있는 새로운 치료법을 개발할 수 있는 가능성을 제시하였다”고 말했다.
□ 사진 설명
사진1. 간암세포를 이용한 세포실험을 이용해 시뮬레이션 결과를 확인
사진2. 구축된 ER stress 네트워크를 이용한 네트워크 분석 및 컴퓨터 시뮬레이션 결과
사진3. 간암 세포가 소라페닙에 반응할 때 전사체 변화를 분석하여 ER stress 반응이 주요하게 나타남을 발견하게 된 ER stress 네트워크 모델
2017.08.24 조회수 22172
조광현 교수, 간암 표적 치료제 내성 극복 위한 최적 약물조합 발견
〈 조 광 현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 간암 약물 치료의 효과를 높이는 새로운 방법을 찾아냈다. 특히 이번 연구는 바이오분야의 4차 산업혁명을 견인하고 있는 IT와 BT의 융합연구인 시스템생물학(Systems Biology) 연구로 이뤄졌다.
서울대병원 내과 윤정환 교수팀과 공동연구를 통해 이루어낸 이번 연구 결과는 국제 간 전문지인 헤파톨로지(Hepatology)에 게재됐다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업과 중견연구자지원사업의 지원을 받아 수행됐다.
간암은 전 세계적으로 남성에게는 다섯 번째, 여성에게는 일곱 번째로 발생률이 높은 암이며 암 사망원인의 두 번째를 차지한다. 특히 우리나라의 간암 사망률은 인구 10만 명 당 28.4명으로 경제협력개발기구(OECD) 국가 중 압도적인 1위이며 2위인 일본의 2배에 이르고 있다.
우리나라에서만 간암 환자가 매년 평균 1만 6000명이 새로 발생하고 있지만 5년 생존율이 12%에 미치지 못한다. 국가암정보센터에 따르면 지난해 암으로 사망한 사람 가운데 폐암이 1만 7399명으로 가장 많았고 간암은 1만 1311명으로 그 뒤를 이었다.
간암은 우리나라의 암 가운데 사회적 비용이 1위인 암이다. 그 이유는 다른 암에 비해 사망자가 많고 더 젊은 나이(40, 50대)에 사망하기 때문이다. 이에 부작용이 적고 생존율을 높여줄 수 있는 새로운 치료법 개발이 시급한 실정이다.
간암의 치료로는 수술 및 색전술, 약물 치료가 있지만 수술이 어려운 진행성 간암에서는 치료 방법이 극히 제한적이다.
진행성 간암의 표적 항암제로 소라페닙(Sorafenib)이 유일하게 승인돼 임상에서 쓰이고 있는데 국내에서만 매년 200억 원 이상 처방되고 있지만 일부 환자에서만 효능을 나타내며 또한 대부분의 경우 약제 내성이 발생한다.
소라페닙은 말기 간암 환자의 생존 기간을 약 3개월 정도 밖에 늘리지 못하지만 다국적 제약회사에 의해 개발된 많은 후발주자 약물들이 그 효과를 뛰어 넘는데 실패했다.
소라페닙은 다중타겟을 치료표적으로 하여 그 작용 기전이 모호하고 따라서 약제의 내성기전 또한 아직 잘 알려져 있지 않다.
조광현 교수가 이끈 융합 연구팀은 소라페닙 작용 및 내성 기전을 규명하기 위해 소라페닙을 간암 세포에 처리하였을 때 세포내 분자 발현이 변화하는 것을 분석했다.
이를 통해 암세포가 소라페닙에 대항하는 기전을 알아냈고 시스템생물학적 분석을 실시하여 암세포내 단백질 이황화 이성질화 효소(protein disulfide isomerase, PDI)가 암세포가 소라페닙에 대항하는데 핵심적 역할을 하는 것을 발견했으며 이 효소를 차단했을 때 소라페닙의 효능이 훨씬 증가함을 관찰했다.
공동연구를 수행한 서울대병원 내과 윤정환 교수 연구팀은 쥐를 이용한 동물실험에서 소라페닙과 단백질 이황화 이성질화 효소 차단제를 같이 처리하면 간암 증식 억제에 시너지가 있음을 관찰하였고 소라페닙에 저항성을 가진 간암 환자의 조직에서 이 효소가 증가되어 있음을 관찰하여, 향후 임상 적용을 위한 가능성을 확인하였다.
조광현 교수는 “세포내 중요한 역할을 담당하는 분자들은 대부분 복잡한 조절관계 속에 놓여있기 때문에 기존의 직관적인 생물학 연구로 그 원리를 밝히는 것은 근본적인 한계가 있다. 이번 연구는 IT와 BT의 융합연구인 시스템생물학으로 그 한계를 극복할 수 있음을 보여주는 대표적인 사례로, 특히 암에 대한 표적 치료제 작용을 네트워크 차원에서 분석하여 내성을 극복할 수 있는 새로운 치료법을 개발할 수 있는 가능성을 제시하였다”고 말했다.
□ 사진 설명
사진1. 간암세포를 이용한 세포실험을 이용해 시뮬레이션 결과를 확인
사진2. 구축된 ER stress 네트워크를 이용한 네트워크 분석 및 컴퓨터 시뮬레이션 결과
사진3. 간암 세포가 소라페닙에 반응할 때 전사체 변화를 분석하여 ER stress 반응이 주요하게 나타남을 발견하게 된 ER stress 네트워크 모델
2017.08.24 조회수 22172 C형 간염 바이러스의 간 손상 메카니즘 규명
- 부작용 없이 간세포 손상 억제하는 치료제 개발 길 열어 -- 의학분야 세계 최고수준 학술지 ‘헤파톨로지’ 9월호 표지논문 장식 -
의사출신으로 구성된 KAIST 연구진이 C형 간염 바이러스 기전을 밝혀내 치료제 개발에 탄력을 받게 됐다.
우리 학교 바이오및뇌공학과 최철희 교수와 의과학대학원 신의철 교수팀이 공동으로 C형 간염 바이러스에 감염된 환자의 간 손상에 대한 메카니즘을 세계 최초로 규명했다.
이번 연구결과로 앞으로 부작용이 없으면서도 간세포 손상이 적은 C형 간염 바이러스 치료제가 개발될 수 있을 것으로 기대된다.
C형 간염은 C형 간염 바이러스(HCV, Hepatitis C virus)에 감염되었을 때 이에 대응하기 위한 신체의 면역반응으로 인해 간에 염증이 생기는 질환이다.
C형 간염 바이러스는 전 세계적으로 약 1억 7천만 명, 그리고 우리나라에서도 1%정도가 감염되어 있는 것으로 추정된다. 감염되면 대부분 만성으로 변하며, 간경변증이나 간암을 유발해 사망할 수 있는 무서운 질병이다.
하지만 2005년 시험관 내 세포에서 C형 간염 바이러스의 감염이 성공하기 전까지는 세포실험이 불가능했고, 침팬지 이외에는 감염시키는 동물이 없어 동물실험이 어려워 연구에 한계가 있었다.
연구팀은 C형 간염 바이러스에 감염시킨 세포주를 이용해 바이러스가 면역을 담당하는 세포에 의해 분비되는 단백질인 종양괴사인자(TNF-α)에 의한 세포의 사멸이 크게 증가하는 메카니즘을 세계 최초로 밝혀냈다.
이와 함께 이러한 작용을 일으키는 바이러스 구성 단백질도 규명에도 성공했다.
기존에는 C형 간염 바이러스가 간 손상을 일으키는 기전을 밝혀내지 못해 주로 바이러스의 증식을 억제하는 데 초점을 맞춰 신약이 개발돼 부작용이 많았다.
이번 연구결과를 통해 바이러스에 의한 간세포 손상을 억제하는 부작용 없는 신약개발이 가능하게 될 것으로 전망된다.
최철희 교수는 “이번 연구를 통해 C형 간염 바이러스가 숙주의 간세포와 어떤 상호 작용을 하는지 밝혀내 감염 환자의 치료법을 획기적으로 개선할 수 있을 것”이라고 말했다.
신의철 교수는 “이번 연구는 기초의학과 응용의학의 융합연구가 성공한 대표적 사례”라며 “앞으로도 다학제간 융합연구를 실시하면 그동안 풀지 못했던 난제들을 효율적으로 해결할 수 있을 것”이라고 강조했다.
한편, 교육과학기술부 미래기반기술개발사업(신약타겟검증연구사업)의 지원을 받아 수행된 이번 연구 결과는 의학 분야의 세계적 학술지인 헤파톨로지(Hepatolog, Impact Factor=11.665) 9월호 표지 논문으로 선정됐다.
□ 연구 세부사항 설명
TNF-α(종양괴사인자)는 면역을 담당하는 세포에 의해 분비되는 단백질이다. HCV에 감염되면 바이러스의 증식을 억제하기 위해 체내의 면역작용이 활발해지고 TNF-α의 분비도 늘어난다.
TNF-α는 세포의 생존을 담당하는 NF-κB 신호전달과 세포의 죽음을 담당하는 JNK 신호 전달을 동시에 활성화시킨다. HCV에 감염되면, 세포의 생존을 담당하는 NF-κB 쪽 신호전달 경로만 선택적으로 활성을 억제하게 되고, TNF-α의 역할은 세포의 죽음 쪽으로 균형이 기울게 된다.
바이러스의 증식을 억제하기 위해 분비된 TNF-α가 오히려 간세포를 죽이게 되는 것이다. 이는 곧 간 손상을 뜻하며, HCV를 구성하는 10가지의 단백질 중 core, NF4B, NS5B 라는 단백질이 이러한 작용을 한다고 규명해냈다.
2012.09.04 조회수 18645
C형 간염 바이러스의 간 손상 메카니즘 규명
- 부작용 없이 간세포 손상 억제하는 치료제 개발 길 열어 -- 의학분야 세계 최고수준 학술지 ‘헤파톨로지’ 9월호 표지논문 장식 -
의사출신으로 구성된 KAIST 연구진이 C형 간염 바이러스 기전을 밝혀내 치료제 개발에 탄력을 받게 됐다.
우리 학교 바이오및뇌공학과 최철희 교수와 의과학대학원 신의철 교수팀이 공동으로 C형 간염 바이러스에 감염된 환자의 간 손상에 대한 메카니즘을 세계 최초로 규명했다.
이번 연구결과로 앞으로 부작용이 없으면서도 간세포 손상이 적은 C형 간염 바이러스 치료제가 개발될 수 있을 것으로 기대된다.
C형 간염은 C형 간염 바이러스(HCV, Hepatitis C virus)에 감염되었을 때 이에 대응하기 위한 신체의 면역반응으로 인해 간에 염증이 생기는 질환이다.
C형 간염 바이러스는 전 세계적으로 약 1억 7천만 명, 그리고 우리나라에서도 1%정도가 감염되어 있는 것으로 추정된다. 감염되면 대부분 만성으로 변하며, 간경변증이나 간암을 유발해 사망할 수 있는 무서운 질병이다.
하지만 2005년 시험관 내 세포에서 C형 간염 바이러스의 감염이 성공하기 전까지는 세포실험이 불가능했고, 침팬지 이외에는 감염시키는 동물이 없어 동물실험이 어려워 연구에 한계가 있었다.
연구팀은 C형 간염 바이러스에 감염시킨 세포주를 이용해 바이러스가 면역을 담당하는 세포에 의해 분비되는 단백질인 종양괴사인자(TNF-α)에 의한 세포의 사멸이 크게 증가하는 메카니즘을 세계 최초로 밝혀냈다.
이와 함께 이러한 작용을 일으키는 바이러스 구성 단백질도 규명에도 성공했다.
기존에는 C형 간염 바이러스가 간 손상을 일으키는 기전을 밝혀내지 못해 주로 바이러스의 증식을 억제하는 데 초점을 맞춰 신약이 개발돼 부작용이 많았다.
이번 연구결과를 통해 바이러스에 의한 간세포 손상을 억제하는 부작용 없는 신약개발이 가능하게 될 것으로 전망된다.
최철희 교수는 “이번 연구를 통해 C형 간염 바이러스가 숙주의 간세포와 어떤 상호 작용을 하는지 밝혀내 감염 환자의 치료법을 획기적으로 개선할 수 있을 것”이라고 말했다.
신의철 교수는 “이번 연구는 기초의학과 응용의학의 융합연구가 성공한 대표적 사례”라며 “앞으로도 다학제간 융합연구를 실시하면 그동안 풀지 못했던 난제들을 효율적으로 해결할 수 있을 것”이라고 강조했다.
한편, 교육과학기술부 미래기반기술개발사업(신약타겟검증연구사업)의 지원을 받아 수행된 이번 연구 결과는 의학 분야의 세계적 학술지인 헤파톨로지(Hepatolog, Impact Factor=11.665) 9월호 표지 논문으로 선정됐다.
□ 연구 세부사항 설명
TNF-α(종양괴사인자)는 면역을 담당하는 세포에 의해 분비되는 단백질이다. HCV에 감염되면 바이러스의 증식을 억제하기 위해 체내의 면역작용이 활발해지고 TNF-α의 분비도 늘어난다.
TNF-α는 세포의 생존을 담당하는 NF-κB 신호전달과 세포의 죽음을 담당하는 JNK 신호 전달을 동시에 활성화시킨다. HCV에 감염되면, 세포의 생존을 담당하는 NF-κB 쪽 신호전달 경로만 선택적으로 활성을 억제하게 되고, TNF-α의 역할은 세포의 죽음 쪽으로 균형이 기울게 된다.
바이러스의 증식을 억제하기 위해 분비된 TNF-α가 오히려 간세포를 죽이게 되는 것이다. 이는 곧 간 손상을 뜻하며, HCV를 구성하는 10가지의 단백질 중 core, NF4B, NS5B 라는 단백질이 이러한 작용을 한다고 규명해냈다.
2012.09.04 조회수 18645